TLR1

El receptor de tipus Toll 1 (TLR1 o també anomenat CD281, toll-like receptor en anglès) és una proteïna que, com el seu nom indica, pertany a la família dels receptors tipus Toll (TLR). Forma part dels receptors de reconeixement de patrons (PRR, de l'anglès pattern recognition receptor), es troba unit a la membrana plasmàtica cel·lular i té un paper fonamental en el sistema immunitari innat.[5] Generalment, treballa reconeixent senyals moleculars patògens, encara que té una afinitat més gran pels bacteris grampositius. Tot i que tots els TLR tenen un paper imprescindible en el sistema immunitari, cadascun reconeix diferents molècules. En aquest cas, el TLR1 es basa principalment reconeixent diacil i triacil lipopèptids.
En els humans, hi pot haver TLR a la superfície de macròfags i de neutròfils, o bé a la capa de la cèl·lula epitelial que delimita l'intestí gros i l'intestí prim, i són molt importants en la regulació de la microbiota intestinal i per a la detecció de patògens.
Els diferents TLR mostren diferents models d'expressió. En alguns casos, el gen que codifica TLR1 està àmpliament expressat i en nivells més elevats que altres gens de TLR; de fet, s'han observat diferents longituds de transcripció en aquest gen degudes suposadament a l'ús de llocs alternatius de poliadenilació i/o d'un empalmament alternatiu.
Des de Drosophila fins a Homo sapiens els TLR comparteixen semblances estructurals i funcionals. En línies generals, un cop un agent patogen travessa les barreres primàries físiques com ara la pell o la mucosa intestinal, els TLR reconeixen senyals moleculars associats a patògens (PAMP, de l'anglès pathogen-associated molecular patterns) que s'expressen en els agents infecciosos i regulen la producció de les citocines necessàries per desencadenar de manera efectiva la resposta immunitària. La imatge mostra els tipus de TLR i què detecten principalment.

Estructura
[modifica]Estructura primària
[modifica]Té una longitud de 786 aminoàcids i una massa de 90,291 kDa. La major part de la proteïna es troba fora a la membrana. Tanmateix, té un petit domini transmembrana i un domini citoplasmàtic.
Els quasi 800 aminoàcids es divideixen de maneres diferents. Els primers 24 aminoàcids de la proteïna TLR1 constitueixen el senyal peptídic de la proteïna, mentre que la resta formen part de la cadena. El domini extracel·lular està format pels aminoàcids des de la posició 25 fins a la 580. Els del domini transmembrana són des del 581 fins al 601 i, per acabar, el domini citoplasmàtic va des de l'aminoàcid 602 fins al 786.
Per altra banda, quan es parla d'«estructures PDB conegudes» es fa referència a estructures tridimensionals de cadenes proteiques llargues prèviament identificades i que han estat emmagatzemades en el Protein Data Bank.[6] Per a la estructura nativa de la proteïna s'han hagut de produir algunes modificacions dels aminoàcids. Aquestes modificacions en el TLR1 han estat la glicosilació i l'enllaç disulfur:
- Glicosilacions: 51,137, 163, 330, 429, 578
- Enllaços disulfur: 110↔32, 223↔230, 343↔368, 419↔442
Així doncs, s'han aconseguit identificar tots els aminoàcids dels receptor, que són els següents:

Estructura secundària
[modifica]Aquests diferents aminoàcids interaccionen entre ells de manera que tenen la capacitat de donar una estructura específica a la proteïna. Aquesta conformació li permetrà poder executar de manera eficaç la seva funció. Així és com està constituïda l'estructura secundària de la proteïna TLR1.

Estructura terciària
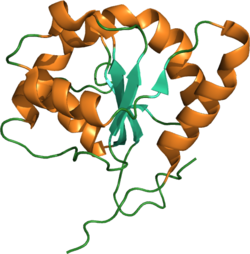
[modifica]No obstant això, per dur a terme les funcions cel·lulars, el receptor adopta una forma característica molt anomenada estructura terciària. Aquesta conformació està formada per làmines beta (fletxes verdoses de la imatge) i hèlix alfa (parts ataronjades). A més a més, també s'hi observen uns fils (en verd) que fan de connexió. Els fils són regions que no tenen una estructura fixa, sinó que varien en funció de l'activitat de la proteïna.

Localització
[modifica]Context cel·lular
[modifica]Normalment, els TLR existeixen com heterodímers i com que la seva funció està relacionada amb els sistema immunitari, es troben en cèl·lules immunitàries com ara macròfags, limfòcits B o mastòcits.[1]
El TLR1 pot trobar-se en diferents llocs de la cè·lula. En les cèl·lules de defensa (single-pass type I de proteïna de membrana) es troba a la membrana. En els fagosomes, es troben en les vesícules citoplasmàtiques i les membranes (single-pass type I de proteïna de membrana). En la membrana de l'aparell de Golgi, als lípids Raft. L'aparell de Golgi, com tot orgànul cel·lular està envoltat d'una bicapa lipídica. En aquesta bicapa hi ha regions amb una alta concentració de colesterol i de gangliòsids, formant l'anomenat lípid Raft. El TLR1 no es troba unit al lípid abans de la estimulació quan reconeix un agent patogen, sinó que es va acumulant fins que hi ha presència de lligands microbians.
Context genòmic
[modifica]El gen que codifica el TLR1 es troba al cromosoma 4, seqüència NC_000004.12 (4p14) i localitzacions: 38,787,555 - 38, 806, 262 (exon count número 7) [2]. El gen TLR1 es troba localitzat molt a prop dels gens que codifiquen les proteïnes de la família TLR, en concret el gen més proper d'aquesta família al TLR1 és el TLR10.[3]
Funció
[modifica]Totes les funcions d'aquesta proteïna estan estretament relacionades amb el sistema immunitari. La funció principal del TLR1 és el reconeixement de lipopèptids de diacil i de triacil present en agents patògens, amb l'objectiu d'activar el sistema immunitari quan es reconeguin. No obstant això, moltes de les funcions d'aquest receptor es poden dur a terme gràcies al TLR2, un receptor de la mateixa família. Poden actuar conjuntament o bé formant un heterodímer, és a dir una molècula formada per les dues cadenes dels receptors.
Reconeixement de lipopèptids de diacil i triacil
[modifica]TLR1
[modifica]L'evidència principal de la funció del TLR1 sobre els lipopèpitds de diacl i trial prové d'un estudi fet per Osamu Takeuchi l'any 2001, que prova que el TLR1 participa en el reconeixement de lipoproteïnes triacilades com ara la N-palmitoyl-S-lauryl lipopeptide o altres productes de micobacteris, però no reconeix LPS ni PGN (oligosacàrids i poligosacàrids) provinents de Salmonella minnesota i Staphylococcus aureus, respectivament. És a dir, no reconeix sacàrids provinents de bacteris gramnegatius.[7]

TLR1 actuant conjuntament amb TLR2
[modifica]Per una part, es coneix que el receptor TLR1 coopera conjuntament amb el TLR2 per controlar la resposta contra antígens bacterians lipoproteics. També forma un part d'un cluster format per TLR2:TLR1:CD12 en resposta a triacil lipopèptids, provocant un senyal en la superfície cel·lular dirigida cap a l'aparell de Golgi, mitjançant una via de lípid RAFT.
El TLR1, conjuntament amb el TLR2 actuant com un heterodímer, reconeix peptidoglicans i lipoproteïnes de diacil i de triacil. Aquesta interacció entre la proteïna TLR1 i els lipopèptids bacterians es produeix en els aminoàcids 313, 314, 315, 316 del TLR1.[9]
El TLR1 associat amb el TLR2 reconeix lipoproteïnes (19kDa) natives de micobacteris provinents de Mycobacterium tuberculosis. Per altra banda, es coneix que el TLR2 confereix capacitat de resposta davant PSM (de l'anglès phenol-soluble modulin), un factor secretat per Staphylococcus epidermidis, però que la presencia de TLR1 impedeix aquesta interacció. El TLR1 i el TLR2 cooperen per detectar Pam₃CSK₄ (lipopèptid sintètic) interactuant entre ells per reconèixer diferents PAMP. Tanmateix, no es coneix si això s'aconsegueix mitjançant la formació d'un heterodímer del TLR2 amb altres TLR o si, per altra banda, existeix un complex més gran constituït per TLR1, 2 i 6, amb d'altres.
Altres papers de defensa destacats
[modifica]El TLR1 també té un paper destacable en la defensa de la epidermis, de la pell. La senyalització de TLR indueix l'expressió de LEKTI (lympho-epithelial kazal-type inhibitor) en queratinòcits epidèrmics, que poden contribuir al control de les activitats aberrants de proteïna de serina en malalties inflamatòries de la pell. L'inhibidor del tipus LEKTI controla amb força les activitats de serina proteases com la peptidasa relacionada amb la kallikreïna (KLK) 5 i la KLK7 a l'epidermis. Els LEKTI són molècules essencials per la barrera epidèrmica de la pell.[10]
Algunes investigacions han descobert una possible interacció entre la proteïna TLR1 i el virus de la immunodeficiència humana adquirida degut a la unió entre glicopèptids. Aquesta interacció pot modificar l'expressió de la proteïna TLR1 en cèl·lules B, de manera que l'eficiència del receptor i la capacitat de la cèl·lula de reconèixer patògens baixa dràsticament. S'ha descobert que la interacció entre el virus i la proteïna pot ser degut al fet que les proteïnes estructurals del VIH actuïn com a PAMPs.[11]

També té una intervenció directa en aspectes d'inflamacions. Per una banda, se sap que una petita molècula específica per TLR1/TLR2 (SMU127) estimula la activació de NF-κB y promou la secreció de la citocina TNFα en macròfags humans i cèl·lules mononuclears.[12] Aquesta citocina s'encarrega de produir una acció pro-inflamatòria quan hi ha una infecció. Per altra banda, es creu que el TLR1 detecta la microbiota i proporciona senyals clau que regulen l'epiteli del cólon. Això fa limitar la inflamació a través de la prevenció d'unió bacteriana a la mucosa i l'exposició d'aquesta microbiota al sistema immunitari subjacent.[13]
El gen que codifica TLR1, com tots els gens, poden tenir polimorfismes, és a dir, variacions en la seqüència de DNA, donant així els diferents al·lels. Un estudi va suggerir que els polimorfismes dels gens de TLR1 poden estar associats a una protecció incrementada davant la malaltia de la lepra en dones. Els polimorfismes del gen TLR1 confereixen una susceptibilitat a la lepra que difereix entre homes i dones, de manera que les dones amb un genotip heterogeni de TLR1 SNP presenten una major resistència a aquesta malaltia.[14] Per tuberculosi.
Els trastorns relacionats amb el gen TLR1 i la seva proteïna s'han associat a malalties com ara la lepra, la malaltia de Lyme, la melioidosi o la toxoplasmosi ocular; són malalties causades per bacteris o protozous, en què el trastorn del receptor provoca una menor activitat i això es tradueix en la pèrdua de possibilitats per activar el sistema immunitari en el cas que el receptor detectés l'agent patogen.[15]
Referències
[modifica]- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000174125 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000044827 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «. "A family of human receptors structurally related to Dosophila Toll"». Proc. Natl. Acad. Sci. U.S.A, 1-1998.
- ↑ Berman, H. M. «The Protein Data Bank» (en anglès). Nucleic Acids Research, 28, 1, 01-01-2000, pàg. 235–242. DOI: 10.1093/nar/28.1.235. ISSN: 1362-4962.
- ↑ Takeuchi, Osamu; Sato, Shintaro; Horiuchi, Takao; Hoshino, Katsuaki; Takeda, Kiyoshi «Cutting Edge: Role of Toll-Like Receptor 1 in Mediating Immune Response to Microbial Lipoproteins» (en anglès). The Journal of Immunology, 169, 1, 01-07-2002, pàg. 10–14. DOI: 10.4049/jimmunol.169.1.10. ISSN: 0022-1767. PMID: 12077222.
- ↑ Lee, J.O.; Jin, M.S.; Kim, S.E. «Crystal structure of the TLR1-TLR2 heterodimer induced by binding of a tri-acylated lipopeptide» (en anglès), 02-10-2007. DOI: 10.2210/pdb2z7x/pdb. [Consulta: 23 octubre 2018].
- ↑ «TLR1 - Toll-like receptor 1 precursor - Homo sapiens (Human) - TLR1 gene & protein» (en anglès). [Consulta: 21 octubre 2018].
- ↑ Sugimoto, Saeko; Morizane, Shin; Nomura, Hayato; Kobashi, Mina; Sugihara, Satoru «Toll-like receptor signaling induces the expression of lympho-epithelial Kazal-type inhibitor in epidermal keratinocytes». Journal of Dermatological Science, 15-09-2018. DOI: 10.1016/j.jdermsci.2018.09.001. ISSN: 1873-569X. PMID: 30270115.
- ↑ Henrick, Bethany M.; Yao, Xiao-Dan; Rosenthal, Kenneth Lee; INFANT study team «HIV-1 Structural Proteins Serve as PAMPs for TLR2 Heterodimers Significantly Increasing Infection and Innate Immune Activation». Frontiers in Immunology, 6, 2015, pàg. 426. DOI: 10.3389/fimmu.2015.00426. ISSN: 1664-3224. PMC: PMC4541371. PMID: 26347747.
- ↑ Chen, Zhipeng; Cen, Xiaohong; Yang, Junjie; Tang, Xiaoshan; Cui, Kai «Structure-based discovery of a specific TLR1-TLR2 small molecule agonist from the ZINC drug library database». Chemical Communications (Cambridge, England), 54, 81, 09-10-2018, pàg. 11411–11414. DOI: 10.1039/c8cc06618c. ISSN: 1364-548X. PMID: 30246199.
- ↑ Kamdar, Karishma; Johnson, Andrew M. F.; Chac, Denise; Myers, Kalisa; Kulur, Vrishika «Innate Recognition of the Microbiota by TLR1 Promotes Epithelial Homeostasis and Prevents Chronic Inflammation». Journal of Immunology (Baltimore, Md.: 1950), 201, 1, 01-07-2018, pàg. 230–242. DOI: 10.4049/jimmunol.1701216. ISSN: 1550-6606. PMID: 29794015.
- ↑ Alvarenga Niitsuma, Eyleen Nabyla; Fernandes, Gabriel da Rocha; Lana, Francisco Carlos Félix «The TLR1 gene is associated with higher protection from leprosy in women». PloS One, 13, 10, 2018, pàg. e0205234. DOI: 10.1371/journal.pone.0205234. ISSN: 1932-6203. PMID: 30289892.
- ↑ Database, GeneCards Human Gene. «TLR1 Gene - GeneCards | TLR1 Protein | TLR1 Antibody». [Consulta: 21 octubre 2018].