Trisulfur de diantimoni
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 675,4476888 Da |
| Estructura química | |
| Fórmula química | S₆Sb₄ |
| SMILES canònic | |
| Identificador InChI | Model 3D |
El trisulfur de diantimoni, o sulfur d'antimoni(III), és un compost binari constituït per antimoni i sofre, la qual fórmula química és .
Estat natural
[modifica]
El trisulfur de diantimoni existeix com un cristal·lí negre sòlid i un pols amorf vermell-taronja; la barreja pot ser carmina o vermell marronós. En la seva forma mineral, l'estibina, el trisulfur d'antimoni té una estructura cristal·lina del sistema ortoròmbic, de vegades molt gran i sòlid i en altres ocasions esvelt i fràgil.
Història
[modifica]El trisulfur de diantimoni vermell es troba de manera natural en el mineral estibina. Les vetes d'aquest mineral són més freqüents a França, Hongria i Indonèsia (illa de Borneo). L'estibina s'esmenta en el llibre De Gradibus, text compilat per Constantí Africà, qui introduí el terme antimoni. Els primers usos mèdics de l'estibina foren condicionats per la seva insolubilitat en aigua. L'auge del trisulfur de diantimoni i altres sals a partir del segle xvi es deu a Paracels. En els seus rudimentaris preparats destil·lava trisulfur de diantimoni, juntament amb múltiples impureses, recomanant els extractes obtinguts per tractar les afeccions de la pell, des de les úlceres cutànies a la lepra.[1]
Propietats
[modifica]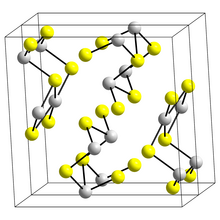
El trisulfur de diantimoni a temperatura ambient és un sòlid de densitat 4,562 g/cm³ i punt de fusió 550 °C. és pràcticament insoluble en aigua, només 0,000 175 g en 100 g d'aigua. És soluble en dissolucions alcalines i en àcid clorhídric i àcid sulfúric. També en etanol. És inflamable i la combustió es pot iniciar per causa d'una fricció, calor, espires o flames.
El trisulfur de diantimoni cristal·litza en el sistema ortoròmbic. Cada àtom d'antimoni està unit a tres àtoms d'oxigen que formen una piràmide trigonal. El cristall està format per cintes de trisulfur de diantimoni (quatre per a cada cel·la) paral·leles a la direcció c, que formen cadenes de parells de cintes . El Sb i el S dels veïns tenen distàncies compreses entre 311–364 pm. Cada parella està dèbilment vinculada a la cadena de veïns.[2]
Preparació
[modifica]El trisulfur de diantimoni pur s'obté del seu mineral, l'estibina. Aquest mineral primer se separa d'altres minerals per trituració i flotació. Després s'escalfa a 550–600 ° C en un recipient perforat. El material fos pur es recull i es refreda.

També es prepara passant sulfur d'hidrogen per una dissolució de triclorur d'antimoni segons la reacció: o tractant la dissolució de triclorur d'antimoni amb tiosulfat de sodi .
Com a alternativa, també es pot escalfar antimoni metàl·lic o òxid d'antimoni(III) amb sofre:
Tots aquests mètodes preparatius anteriors produeixen trisulfur d'antimoni amorf.[3]
Aplicacions
[modifica]
El trisulfur de diantimoni s'utilitza en focs artificials, en certs tipus de llumins, com a pigment (negre, vermell, groc, taronja) i en la fabricació de vidre de robí.[4] Les pintures de camuflatge contenen trisulfur de diantimoni, que reflecteix la radiació infraroja.[5] També s'empra com a lubricant industrial.[2]
Referències
[modifica]- ↑ «Antimonio en la historia farmacéutica - info-farmacia». Arxivat de l'original el 2020-11-08. [Consulta: 1r novembre 2020].
- ↑ 2,0 2,1 Dante, R.C.. «Metal sulfides». A: Handbook of Friction Materials and Their Applications. Elsevier Ltd., 2016. DOI 10.1016/C2015-0-00634-7.
- ↑ «ANTIMONY(III) SULFIDE | 1345-04-6». Chemical Book. [Consulta: 2 novembre 2020].
- ↑ Freedman, L.D. [et al.].. Kirk-Othmer. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2007. DOI 10.1002/0471238961.0114200906180505.a01.
- ↑ Li, T. Kirk-Othmer. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2007. DOI 10.1002/0471238961.011420091209.a01.









