Sofre
| Aquest article tracta sobre l'element químic. Si cerqueu el mineral natiu, vegeu «sofre natiu». |
| Sofre | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
16S
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||
Microcristalls sinteritzats de color groc llimona  Línies espectrals del sofre | |||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Sofre, S, 16 | ||||||||||||||||||||||||||||||||||||
| Categoria d'elements | No metalls | ||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 16, 3, p | ||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 32,065(5) | ||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ne] 3s2 3p4 2, 8, 6 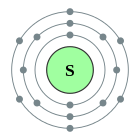
| ||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(alfa) 2,07 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(beta) 1,96 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(gamma) 1,92 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
1,819 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| Punt de fusió | 388,36 K, 115,21 °C | ||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 717,8 K, 444,6 °C | ||||||||||||||||||||||||||||||||||||
| Punt crític | 1.314 K, 20,7 MPa | ||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | (mono) 1,727 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | (mono) 45 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 22,75 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 3, 2, 1, -1, -2 (òxid àcid fort) | ||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,58 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 999,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2a: 2.252 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3a: 3.357 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Radi covalent | 105±3 pm | ||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 180 pm | ||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Ortoròmbica 
| ||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | ||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) (amorf) 2×1015 Ω·m | ||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | (amorf) 0,205 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 7,7 GPa | ||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,0 | ||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del sofre | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El sofre és un element químic de nombre atòmic 16 i símbol S, i també és un mineral. És un no-metall abundant i insípid de color groc[2] i fa una olor característica, similar a la dels ous podrits.[3] El sofre es troba principalment en sulfurs (S2-) i sulfats (SO₄2-), i també en forma nativa (especialment en regions volcàniques). És un element químic essencial per a tots els organismes que es troba en dos dels aminoàcids que formen les proteïnes, la metionina i la cisteïna, i en coenzim A, molècula clau del metabolisme de tots els éssers vius. S'usa principalment com a fertilitzant però també en la fabricació de pólvora, laxants, llumins i insecticides.
Aquest element és generat en estels massius en què predominen temperatures que provoquen la fusió entre un nucli de silici i un altre d'heli en un procés denominat nucleosíntesi de supernoves.[4]
Característiques principals
[modifica]Es tracta d'un no-metall de color groc, bla, fràgil, lleuger, desprèn una olor característica d'ou podrit en combinar-se amb hidrogen i crema amb flama de color blau desprenent diòxid de sofre (SO₂). És insoluble en aigua però es dissol en disulfur de carboni (CS₂) i toluè (C6H5CH3). És multivalent i són comuns els estats d'oxidació -2, +2, +4 i +6.
En tots els estats, sòlid, líquid i gasós presenta formes al·lotròpiques les relacions dels quals no són completament conegudes. Les estructures cristal·lines més comuns són l'octaedre ortoròmbic (sofre α) i el prisma monoclínic (sofre β) sent la temperatura de transició d'una a una altra de 96 °C; en ambdós casos el sofre es troba formant molècules de S₈ amb forma d'anell, sent la diferent disposició d'aquestes molècules la que provoca les diferents estructures cristal·lines. A temperatura ambient, la transformació del sofre monoclínic en ortoròmbic, més estable, és molt lenta.
En fondre el sofre s'obté un líquid que flueix amb facilitat format per molècules de S₈, però si s'escalfa el color es torna marró rogenc i s'incrementa la viscositat. Aquest comportament es deu a la ruptura dels anells i la formació de llargues cadenes d'àtoms de sofre que poden aconseguir diversos milers d'àtoms de longitud que s'enreden entre si disminuint la fluïdesa del líquid; el pic màxim de viscositat s'aconsegueix entorn dels 200 °C. Refredant ràpidament, del líquid viscós s'obté una massa elàstica, de consistència semblant a la de la goma, denominada «sofre plàstic» (sofre γ) i formada per cadenes que no han tingut temps de reordenar-se per a formar molècules de S₈; transcorregut cert temps la massa perd la seua elasticitat cristal·litzant en el sistema ròmbic. Estudis amb rajos X mostren que aquesta forma amorfa pot estar constituïda per molècules de S₈ amb estructura d'hèlice espiral.
En estat vapor també forma molècules de S₈, però a 780 °C ja s'aconseguix l'equilibri amb molècules diatòmiques i per damunt d'aproximadament 1800 °C la dissociació és completa i es troben àtoms de sofre.
Aplicacions
[modifica]El sofre s'usa en multitud de processos industrials com la producció d'àcid sulfúric (H₂SO₄) per a bateries, la fabricació de pólvora i el vulcanitzat del cautxú. El sofre té usos com fungicida i en la manufactura de fosfats fertilitzants. Els sulfits s'usen per a blanquejar el paper i en llumins. El tiosulfat de sodi (Na₂S₂O₃) o d'amoni ((NH₄)₂S₂O₃) s'empren en la indústria fotogràfica com a «fixador», ja que dissol el nitrat de plata (AgNO₃); i el sulfat de magnesi (MgSO₄, també anomenada sal Epsom) té usos diversos com laxant, exfoliant o suplement nutritiu per a plantes.
Rol biològic
[modifica]Els aminoàcids cisteïna, metionina homocisteïna i taurina contenen sofre, igual que alguns enzims; això el converteix en un constituent bàsic dels organismes vius, ja que els enllaços disulfur entre polipèptids són de gran importància per a l'estructura i acoblament de les proteïnes. En contenen algunes vitamines, participa en la síntesi del col·lagen, neutralitza els tòxics i ajuda el fetge en la secreció de bilis. Es troba en llegums, cols, espàrrecs, porros, alls, cebes, peix, formatges i rovell d'ou; a diferència del sofre inorgànic, el sofre dels aliments no és tòxic i se n'elimina l'excés amb l'orina; el dèficit retarda el creixement.
Les plantes absorbixen el sofre del sòl en forma d'ió sulfat (SO₄2-), en l'anomenat cicle del sofre, i alguns bacteris utilitzen el sulfur d'hidrogen (H₂S) de l'aigua com a donant d'electrons, en un procés semblant a una fotosíntesi primitiva.
Història
[modifica]
El sofre (del llatí sulphur, -uris, vinculat amb el sànscrit śulbāri) és conegut des de l'antiguitat i ja Homer recomanava, en el segle ix aC, evitar la pestilència del sofre (zeio en grec, relacionat amb zeos-Zeus).
| « | Ell, tanmateix, li va dir a Euriclea, la dida estimada: "Porta'm foc, vella, i porta'm el sofre, remei de desgràcies, i ensofraré la sala. […]" | » |
| — Homer, Odissea (XX, 480-483) | ||
Els egipcis ho utilitzaven per purificar els temples. En el Gènesi (19,24), els hebreus deien que Déu (Jahvè) va fer ploure sobre Sodoma i Gomorra sofre i foc des del cel. A la Apocalipsis 20:10 es diu que el diable serà llançat a un llac de foc i sofre. Segons el Diccionari sànscrit-anglès (1899) de Monier Monier-Williams, en sànscrit el sofre se l'anomenava śulbāri (pronunciat /shulbári/), sent śulba o śulva: ‘coure’, i a-rí o a-rís: ‘enemic, envejós’ (lit. ‘no liberal’).
Aproximadament en el segle xii, els xinesos van inventar la pólvora, mescla explosiva de nitrat de potassi (KNO₃), carbó i sofre. Els alquimistes de l'edat mitjana coneixien la possibilitat de combinar el sofre amb el mercuri, però no va ser fins al 1789 quan Antoine L. Lavoisier va convèncer la comunitat científica que el sofre no era un compost sinó un element químic a la seva obra Traité élementaire de chimie. Durant tota l'Edat Mitjana es va vincular a Satanàs amb les olors dels gasos sulfurosos que es desprenien dels volcans, que se suposaven eren entrades als inferns subterranis.
Abundància i obtenció
[modifica]
El sofre, element molt abundant en l'escorça terrestre, es troba en grans quantitats combinat en forma de sulfurs (pirita, galena) i de sulfats (algeps). En forma nativa es troba en les proximitats d'aigües termals, zones volcàniques i en menes de cinabri, galena, esfalerita i estibina, i s'extrau per mitjà del procés Frasch consistent a injectar vapor d'aigua sobreescalfat per a fondre el sofre que posteriorment és bombat a l'exterior utilitzant aire comprimit.
També està present, en petites quantitats, en combustibles fòssils (carbó i petroli) la combustió del qual produïx diòxid de sofre que combinat amb aigua produïx la pluja àcida; per a evitar-ho les legislacions dels països industrialitzats exigixen la reducció del contingut de sofre dels combustibles, constituint aquest sofre, posteriorment refinat, un percentatge important del total produït en el món. També s'extrau del gas natural que conté sulfur d'hidrogen que una vegada separat es crema per a obtindre sofre:
- 2 H₂S + O₂ → 2 S + 2 H₂O
El color distintiu d'Io, el satèl·lit volcànic de Júpiter, es deu a la presència de diferents formes de sofre en estat líquid, sòlid i gasós; el sofre es troba, a més, en diversos tipus de meteorits i es creu que la taca fosca que pot observar-se prop del cràter lunar Aristarc pot ser un dipòsit de sofre.
| 1. | 17,5 | |
| 2. | 8,7 | |
| 3. | 7,5 | |
| 4. | 6,9 | |
| 5. | 6,5 | |
| 6. | 3,6 | |
| 7. | 3,5 | |
| 8. | 3,4 | |
| 9. | 3,3 | |
| 10. | 3,0 | |
| 11. | 2,2 | |
| 12. | 1,8 | |
| 13. | 1,5 | |
| 14. | 1,1 | |
| 15. | 0,9 | |
| 21. | 0,5 |
Font: USGS.
Estats d'oxidació i compostos
[modifica]Moltes de les olors desagradables de la matèria orgànica es deuen a compostos que contenen sofre com el sulfur d'hidrogen. Dissolt en aigua és àcid (pKa1 = 7,00, pKa2 = 12,92) i reacciona amb els metalls. Els sulfurs metàl·lics es troben en la naturalesa, sobretot el de ferro (pirita) que pot presentar resistència negativa i la galena, sulfur de plom natural, en el que per primera vegada es va observar l'efecte semiconductor del rectificat.
El nitrur de sofre polímer (SN)x, sintetitzat el 1975 per Alan G. MacDiarmid i Alan J. Heeger, presenta propietats metàl·liques, a pesar d'estar constituït per no-metalls, i inusuals propietats elèctriques i òptiques. Aquest treball va servir de base per al posterior desenvolupament, amb Hideki Shirakawa, de plàstics conductors i semiconductors que va motivar la concessió del Nobel de Química, el 2000, als tres investigadors.
Els òxids més importants són el diòxid de sofre (SO₂), que en aigua forma una solució d'àcid sulfurós (H₂SO₃), i el triòxid de sofre (SO₃), que en solució forma l'àcid sulfúric, sent els sulfits i els sulfats les sals respectives.
La varietat de compostos sofredats són conseqüència d'una gran varietat de possibles estats d'oxidació de l'àtom de sofre. A la Taula[5] es recullen alguns exemples de famílies de compostos sofrets, en funció de l'estat d'oxidació del sofre.
| Estat d'oxidació del sofre |
Exemple/Família de compostos |
|---|---|
| Àcid sulfhídric (H2S) ió sulfur d'hidrogen (HS-), ió sulfur (S2-) | |
| Disulfà(H2S2), disulfur(S2-2), polisulfurs (-S-Sn-S-), tiosulfat (S2O3-2) | |
| Sofre elemental (Sn), polisulfans orgànics (R-Sn-R), politionats (-O3S-Sn-SO3-) | |
| Diclorurodisulfà (Cl-S-S-Cl) | |
| Diclorur de sofre(SCl2), sulfoxilat (SO2-2) | |
| Ditionit (S2O4-2) | |
| Diòxid de sofre (SO2), sulfit (SO3-2), bisulfit (HSO3-) | |
| Ditionat (S2O6-2), sulfonat (RSO3-) | |
| Triòxid de sofre (SO3), sulfat (SO4-2), peroxosulfat (SO5-2) |
Isòtops
[modifica]Es coneixen 25 isòtops del sofre, quatre dels quals són estables: S-32 (95,02%), S-33 (0,75%), S-34 (4,21%) i S-36 (0,02%). A banda del S-35, format a l'incidir la radiació còsmica sobre l'argó 40 atmosfèric i que té una vida mitjana de 87 dies, els altres isòtops radioactius són de vida curta.
Precaucions
[modifica]El disulfur de carboni, el sulfur d'hidrogen, i el diòxid de sofre han de manejar-se amb precaució. A més de ser prou tòxic (més que el cianur), el diòxid de sofre reacciona amb l'aigua atmosfèrica per a produir la pluja àcida i en altes concentracions reacciona amb l'aigua en els pulmons formant àcid sulfurós que provoca hemorràgies, omplint els pulmons de sang amb la consegüentment asfíxia. Encara que molt pudent fins i tot en concentracions baixes, quan la concentració s'incrementa el sentit de l'olfacte ràpidament se satura desapareixent l'olor pel que a les víctimes potencials de l'exposició els pot passar desapercebuda la seua presència en l'aire fins que es manifesten els seus efectes, possiblement mortals.
Igual que succeeix amb les sals de l'àcid cianhídric, els cianurs, les sals de l'àcid sulfhídric, els sulfurs, han de manejar-se amb molta cura, evitant que puguin entrar en contacte amb àcids o dissolucions àcides (fins i tot lleugerament àcides), que donarien lloc a l'emanació del tòxic àcid sulfhídric.
El diòxid de sofre reacciona amb l'aigua atmosfèrica per produir la pluja àcida. Irrita les mucositats i els ulls i provoca tos en ser inhalat.
Els vapors de l'àcid sulfúric poden provocar hemorràgia als pulmons, omplint-los de sang amb la consegüent asfíxia.
El sofre a les arts plàstiques
[modifica]
A l'orfebreria l'ús del sofre està àmpliament estès, en particular per a l'oxidació de la plata, és a dir, per a la creació de la pàtina (de color negre).
Hi ha diverses tècniques per a aquest fi; una d'aquestes és barrejar sofre en pols amb una matèria grassa —vaselina, oli—, aplicar l'ungüent sobre la peça de plata i, mitjançant l'ús d'un bufador, escalfar el metall i la barreja, fins que obtingui un color negrós. Posteriorment, rentar amb aigua i sabó neutre. El patinat és durador.
De la mateixa manera es pot patinar la plata amb sulfat de potassi i aigua.
Referències
[modifica]- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press, 2000. ISBN 0849304814.
- ↑ «azufre». A: Alfabético temática Invicta (en castellà). Colòmbia: Editorial Norma, 2001, p. 932. ISBN 978-958-04-5870-8. Arxivat 2024-08-06 a Wayback Machine.
- ↑ «Sulphur - S» (en anglès). Lenntech. Arxivat de l'original el 24 de novembre 2016. [Consulta: 7 desembre 2016].
- ↑
 Fusión Estelar (subtiltulado en castellano) a YouTube
Fusión Estelar (subtiltulado en castellano) a YouTube
- ↑ Pacheco-Arias, R. E. (2013). Estudio de la Oxidación Elemental con Sulfolobus Metallicus a 67°C. Universidad de Chile. Arxivat 2024-07-31 a Wayback Machine. Santiago de Chile, 2013.
Enllaços externs
[modifica]- Enciclopèdia Lliure Arxivat 2006-08-13 a Wayback Machine. (castellà)
- Los Alamos National Laboratory - sofre Arxivat 2004-10-16 a Wayback Machine. (anglès)
- webelements.com - sofre (anglès)
- environmentalchemistry.com - sofre (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||
