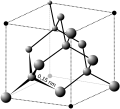
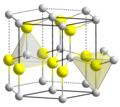
Estructura cristal·lina

L'estructura cristal·lina és la distribució espacial ordenada dels àtoms o molècules que formen un cristall. Les substàncies adopten, en cristal·litzar, l'estructura més estable. La tendència dels àtoms és omplir l'espai de la millor manera possible, adoptant la configuració de màxima simetria per minimitzar energia. S'anomena cel·la unitària, o cel·la unitat, al volum d'un cristall que, repetit a tot l'espai, reprodueix l'estructura de tot el cristall.

Sistemes cristal·lins
[modifica]La cel·la unitària
[modifica]Un concepte bàsic en les estructures cristal·lines és la cel·la unitària o cel·la unitat, la unitat més petita de volum que permet apilar cel·les idèntiques per omplir tot l'espai. Repetint el patró de la cel·la unitària, una vegada darrere l'altra, en totes les direccions, es pot construir tota la xarxa cristal·lina.[1] Tot i això, una cel·la unitària no té necessàriament un volum mínim i, per tant, no és sempre una cel·la elemental o primitiva (cel·la unitària de volum mínim).[2]

La cel·la unitat es caracteritza per les longituds de les tres arestes (a, b i c) i els angles que aquestes arestes formen entre elles (α, β i ɣ).[3]
Una cel·la unitat que només té punts de la xarxa en els seus vèrtexs és anomenada cel·la primitiva, representada per P. Si, a més, conté punts de la xarxa en altres posicions, s'anomena cel·la centrada. Entre les cel·les centrades, les més importants són la cel·la centrada en el cos (hi ha un punt de la xarxa al centre de la cel·la), representada per I; la cel·la centrada en les cares (té punts de xarxa a la intersecció de les diagonals de totes les cares), representada per F, i la cel·la centrada en els extrems (té punts de xarxa a la intersecció de les diagonals de dues cares oposades), representada per S.[3]
Només hi ha catorze formes diferents de cel·la unitària, així que molts cristalls diferents comparteixen un únic tipus de cel·la unitària. Una característica important d'una cel·la unitària és el nombre d'àtoms que conté. El nombre total d'àtoms en tot el cristall és el nombre en cada cel·la multiplicat pel nombre de cel·les unitàries. El coure i l'alumini tenen cadascun un àtom per cel·la unitària, mentre que el zinc i el clorur de sodi en tenen dos. La majoria dels cristalls tenen només uns pocs àtoms per cel·la unitària, però hi ha algunes excepcions. Els cristalls de polímers, per exemple, tenen milers d'àtoms en cada cel·la unitària.[1]
Xarxes de Bravais
[modifica]Els cristalls es poden classificar en sis sistemes cristal·lins, o set segons altres autots, segons la simetria màxima de les seves cares, la qual cosa dona lloc a catorze tipus de xarxes cristal·lines tridimensionals que existeixen a la natura (xarxes de Bravais), cadascuna caracteritzada per una cel·la unitat diferent:
- Triclínic: Són els que presenten una forma menys simètrica de tots amb tres eixos de diferents longituds i angles d'inclinació (a ≠ b ≠ c, α ≠ β ≠ γ). Exemples d'aquest sistema són l'albita, l'anortita, el caolí i la cianita.[4]
- Monoclínic: Els cristalls monoclínics (amb una sola inclinació) tenen tres eixos cristal·logràfics de diferent longitud. Un d'ells presenta angles rectes respecte als altres dos, que no són perpendiculars entre ells, encara que es trobin al mateix pla (a ≠ b ≠ c, α = β = 90° ≠ γ). Tenen un eix de simetria doble. Aquest és el sistema en que cristal·litzen la majoria dels minerals com el guix, la ortosa, la malaquita o la jadeïta.[4]
- Ortoròmbic: Els cristalls en aquest sistema presenten tres eixos cristal·logràfics en angles rectes i tots de diferent longitud (a ≠ b ≠ c, α = β = γ = 90°). Tenen tres eixos de simetria dobles. Exemples de minerals que cristal·litzen en aquest sistema son l'oliví, l'aragonita, el topazi, la marcassita o la baritina.[4]
- Tetragonal: Aquest tipus de cristall presenta tres eixos cristal·logràfics en angles rectes, dos d'igual longitud i el tercer més llarg o més curt (a = b ≠ c, α = β = γ = 90°). Tenen un sol eix de simetria principal i quàdruple. Exemples d'aquest sistema cristal·lí són el rútil, el zircó, la cassiterita i els calomelans.[4]
- Hexagonal i trigonal: Hi ha cristal·lògrafs que consideren aquests dos tipus de cristalls com a pertanyents a un únic sistema mentre que, d'altres, els consideren dos sistemes separats. Ambdós cristalls tenen tres eixos cristal·logràfics d'igual longitud i un quart eix perpendicular al pla dels altres tres eixos, inclinats tots ells en angles de 120º (a = b ≠ c, α = β = 90°, γ = 120°). La diferència és a la simetria, triple als trigonals i sèxtuple als hexagonals. Exemples de minerals que cristal·litzen en el sistema hexagonal es troben el beril·li (maragda i aiguamarina) i l'apatita. En el sistemes trigonals trobaríem la calcita, el quars o la turmalina, entre d'altres.[4]
- Cúbic o isomètric: Els cristalls cúbics presenten tres eixos cristal·logràfics en angles rectes i d'igual longitud i quatre eixos de simetria triples (a = b = c, α = β = γ = 90°). Les principals formes d'aquest sistema son, el cub, l'octaedre i el dodecaedre ròmbic que es donen, per exemple, en l'halita, el coure, l'or, l'argent, el platí, el ferro, la fluorita o la magnetita, entre d'altres.[4]
| Família | Sistema cristal·lí | Grup puntual
(notació de Schönflies) |
Xarxes de Bravais[5] | |||
|---|---|---|---|---|---|---|
| Primitiva (P) | Centrada a les bases (S) | Centrada en el cos (I) | Centrada a les cares (F) | |||
| Triclínic (a) | Ci | 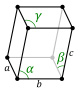
aP |
||||
| Monoclínic (m) | C2h | 
mP |

mS |
|||
| Ortoròmbic (o) | D2h | 
oP |

oS |
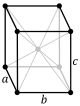
oI |

oF | |
| Tetragonal (t) | D4h | 
tP |

tI |
|||
| Hexagonal (h) | Romboèdric | D3d | 
hR |
|||
| Hexagonal | D6h | 
hP |
||||
| Cúbic (c) | Oh | 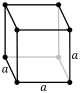
cP |

cI |

cF | ||
Defectes cristal·lins
[modifica]

Un cristall mai té una estructura perfecta; diverses imperfeccions poden afectar-ne l'ordre. Un defecte puntual és una petita imperfecció que afecta uns pocs àtoms. El tipus més senzill de defecte puntual és la falta d'un àtom i es coneix com a vacant cristal·lina.[6] Si el cristall està format per àtoms o molècules neutres no hi ha cap altre efecte, però si està format per ions la manca d'un d'ell requereix l'absència també d'un d'una càrrega contrària. La combinació d'una vacant aniònica i d'una catiònica s'anomena defecte de Schottky.[7][8]
Com que tots els àtoms ocupen espai, àtoms addicionals no poden estar situats als llocs reticulars d'altres àtoms, però es poden trobar entre ells; aquests àtoms es coneixen com àtoms intersticials. Les vibracions tèrmiques poden fer que un àtom abandoni el seu lloc original i es mogui a un lloc intersticial proper, creant un parell vacant-intersticial. La combinació d'una vacant i d'un àtom intersticial s'anomena defecte de Frenkel.[7][8]
Vacants i intersticials són els tipus de defectes que es troben en un cristall pur. En un altre tipus de defecte, anomenat impur, hi ha un àtom present que és diferent dels àtoms del cristall hoste. Les impureses poden ocupar espais intersticials o substituir un àtom hoste en el seu lloc reticular.[7][8]
No hi ha una distinció clara entre un aliatge i un cristall amb moltes impureses. Un aliatge es forma quan s'afegeixen suficients impureses que són solubles en el metall hoste. No obstant això, la majoria dels elements no són solubles en la majoria dels cristalls. En general, els cristalls poden tolerar algunes impureses per cada milió d'àtoms hostes. Si s'afegeixen massa impureses del tipus insoluble, aquestes es combinen per formar el seu propi cristal·lí petit. Aquestes incloses es coneixen com precipitats i constitueixen un gran defecte.[1]
El germani és una impuresa comuna en el silici. Preferix la mateixa unió tetraèdrica que el silici i substitueix amb facilitat els àtoms de silici. De manera similar, el silici és una impuresa comuna en el germani. Cap cristall gran es pot fer sense impureses; el cristall més pur mai crescut estava fet de germani. Tenia aproximadament 1010 impureses en cada centímetre cúbic de material, el que és menys d'una impuresa per cada bilió d'àtoms.[1]

Sovint, les impureses fan que els cristalls siguin més útils. En absència d'impureses, l'α-alúmina és incolora. Les impureses de ferro i titani li donen un color blau, i el mineral de qualitat gemma resultant es coneix com a safir. Les impureses de crom són les responsables del color vermell característic dels robins, l'altre gemma de l'α-alúmina. Els semiconductors purs rarament condueixen bé l'electricitat a temperatures ambientals. La seva capacitat de conduir electricitat és causada per les impureses. Aquestes impureses s'afegeixen deliberadament al silici en la fabricació de circuits integrats. En les làmpades fluorescents, la llum visible és emesa per impureses en els fòsfors (materials lluminiscents).[1]

Altres imperfeccions en els cristalls involucren molts àtoms, són defectes lineals i superficials. El bessat és un tipus especial de defecte en la frontera de grans, en què un cristall està units amb la seva imatge especular. Un altre tipus d'imatge és una dislocació, que és un defecte de línia que pot recórrer la longitud del cristall. Un dels molts tipus de dislocacions es deu a un pla addicional d'àtoms que s'insereix en algun lloc de l'estructura cristal·lina. Un altre tipus, anomenat dislocació de vora, es produeix quan hi ha una fila d'àtoms que falta. Les dislocacions es formen quan un cristall es fa créixer, i cal molta cura per produir un cristall sense elles. Les dislocacions són estables i existiran durant anys. Alleugen l'estrès mecànic. Si es pressiona un cristall, aquest s'adaptarà a l'estrès induït creant dislocacions a la superfície, que es mouen gradualment cap a l'interior. Les dislocacions fan que un cristall sigui mecànicament més dur. Quan una barra de metall es treballa en fred per laminació o martelleig, s'introduïxen dislocacions i fronteres de grans; això provoca l'enduriment.[8]
Estructures de diferents cristalls
[modifica]Estructures de metalls
[modifica]

Les estructures de retícula més comunes per als metalls s'obtenen apilant les esferes atòmiques en l'arranjament més compacte possible (empaquetat dens). Hi ha dues disposicions periòdiques possibles. En cadascuna d'elles, la primera capa, designada normalment A, té els àtoms apilats en una retícula triangular en un pla en la qual cada àtom té sis veïns immediats. La segona capa, la B, té la mateixa estructura triangular en el pla; els àtoms ocupen els forats formats per la primera capa. La primera capa té dos conjunts equivalents de forats, però els àtoms de la segona capa només poden ocupar un conjunt. La tercera capa té la mateixa estructura, però hi ha dues opcions per seleccionar els forats que els àtoms ocuparan:
- La tercera capa s'anomena també A si se situa sobre els àtoms de la primera capa, generant una seqüència de capes alternes ...ABABAB…, que es coneix com empaquetat hexagonal (HC). El cadmi i el zinc cristal·litzen amb aquesta estructura.[9]
- L'altra possibilitat és col·locar els àtoms de la tercera capa, anomenada C, sobre cap de les dues primeres, sinó que sobre el conjunt de forats de la primera capa que romanen sense ocupar. La quarta capa es col·loca sobre la primera, i així hi ha una repetició de tres capes ...ABCABCABC..., que es coneix empaquetat cúbic, té la retícula cúbica centrada en les cares (CCC), o retícula cúbica compacta. El coure, l'argent i l'or cristal·litzen en retícules CCC.[9]

En les estructures HC i CCC, les esferes omplen el 74 % del volum, la qual cosa representa l'apilament més compacte possible d'esferes. Cada àtom té 12 veïns. El nombre d'àtoms en una cel·la unitària és de dos per a les estructures HC i d'un per a les CCC. Hi ha 32 metalls amb la retícula HC (per exemple titani, reni i osmi) i 26 amb la CCC (per exemple coure, argent i or).[9][10]
- Una altra disposició possible és la retícula cúbica centrada en cos (CC), en la qual cada àtom té vuit veïns disposats als vèrtexs d'un cub. És l'estructura de clorur de cesi, que és una disposició cúbica. Si tots els àtoms en aquesta estructura són de la mateixa espècie, és una retícula CC. Les esferes ocupen el 68 % del volum. Hi ha 23 metalls amb l'arranjament CC, com el ferro, el bari o el tungstè.[9][10]
La suma d'aquests tres números (32 + 26 + 23) supera el nombre d'elements que formen metalls (63), ja que alguns elements es troben en dues o tres d'aquestes estructures. L'estructura CCC també es troba en els cristalls dels gasos nobles sòlids neó, argó, criptó i xenó.[1]
Estructures d'aliatges
[modifica]-
Fase de Laves .
-
Fase de Laves .
-
Fase de Laves .
Els àtoms tenen tendència a formar aliatges cristal·lins quan són de mida similar. Dins dels aliatges cristal·lins es poden trobar dos tipus d'ordenació diferents. La majoria d'aliatges a baixes temperatures es presenten com a cristalls binaris amb una ordenació perfecta. Un exemple il·lustratiu és l'aliatge de coure i zinc. El coure té una estructura CCC (cúbica centrada en les cares), mentre que el zinc es presenta com una estructura HC (empaquetat hexagonal). Un aliatge amb una proporció equitativa del 50% de zinc i coure exhibeix una estructura diferent, coneguda com a β-llautó. A baixes temperatures, aquest aliatge mostra l'estructura de clorur de cesi, que es caracteritza per una reixa CC (cúbica centrada en el cos) amb àtoms alternants de coure i zinc, i una cel·la unitària cúbica. Tanmateix, si la temperatura es puja per sobre dels 470 °C, es produeix una transició de fase cap a un altre estat cristal·lí. En aquest cas, l'ordenació a altes temperatures també és CC, però ara cada lloc de la reixa té la mateixa probabilitat d'albergar un àtom de coure o de zinc. En aquest estat, els dos tipus d'àtoms ocupen els llocs de manera aleatòria, tot i que encara es manté una ordenació a gran distància. En altres paraules, a temperatures inferiors als 470 °C, es pot predir amb certesa la ubicació de l'àtom en milers de llocs de distància, així com si aquest lloc estarà ocupat per un àtom de coure o de zinc. No obstant això, a temperatures per sobre dels 470 °C, la probabilitat d'incorporar qualsevol dels dos tipus d'àtoms és la mateixa. Aquest estat a altes temperatures es presenta com a cristal·lí però desordenat. Aquesta desordenació es produeix a través d'una fusió parcial, però sense passar a l'estat líquid, sinó a un estat menys ordenat. Aquest comportament és típic dels aliatges metàl·lics. Altres aliatges comuns inclouen l'acer, un aliatge de ferro i carboni; l'acer inoxidable, un aliatge de ferro, níquel i crom; el peltre i la soldadura, un aliatge d'estany i plom; i el metall de Britània, un aliatge d'estany, antimoni i coure.[1]
Estructures d'elements no metàl·lics
[modifica]Els elements del grup 14 de la taula periòdica, com ara el carboni, el silici, el germani i l'α-estany, prefereixen l'enllaç covalent. El carboni té diverses estructures cristal·lines possibles. Cada àtom en el vincle covalent té quatre veïns immediats, que es troben als vèrtexs d'un tetraedre. Aquest arranjament es coneix com la retícula de diamant. Hi ha dos àtoms en una cel·la unitària, que és CCC. A més del diamant, l'altra forma comuna de carboni és el grafit, que és un material en capes. Cada àtom de carboni té tres veïns propers coplanars, formant un arranjament anomenat retícula d'abella. Els cristalls de grafit tridimensionals es formen apilant capes similars.
Una altra forma de carboni cristal·lí es basa en una molècula amb 60 àtoms de carboni anomenada buckminsterful·lerè (C60). La forma molecular és esfèrica. Cada carboni està enllaçat amb tres veïns, com en el grafit, i la forma esfèrica s'aconsegueix amb una barreja de 12 anells amb cinc costats i 20 anells amb sis costats. Les molècules C60, també són força resistents i gairebé incompressibles. Els cristalls es formen de manera que les boles estan arranjades en una retícula CCC amb un espai d'un nanòmetre entre els centres de les boles adjacents. La molècula similar C70 té la forma d'una pilota de rugbi; les molècules C70 també formen un cristall CCC quan es superposen. Els ful·lerens sòlids formen cristalls moleculars, amb una unió feble —proporcionada per forces de van der Waals— entre les molècules.

Molts elements formen gasos diatòmics: hidrogen, oxigen, nitrogen, fluor, clor, brom i iode. Quan es refreden a baixa temperatura, es formen sòlids de molècules diatòmiques. El nitrogen té l'estructura HC, mentre que l'oxigen té una estructura més complexa.

Les estructures cristal·lines més interessants són les dels elements que no són metàl·lics, covalents ni diatòmics. Encara que el bor i el sofre tenen diverses estructures cristal·lines diferents, cadascun té un arranjament en el qual es troba normalment. Dotze àtoms de bor formen una molècula amb forma d'icosaedre. Els cristalls es formen empilant les molècules. L'estructura β-romboèdrica del bor té set d'aquestes molècules icosaèdriques en cada cel·la unitària, amb un total de 84 àtoms. Les molècules de sofre solen disposar-se en anells; l'anell més comú té vuit àtoms. L'estructura típica és l'α-sofre, que té 16 molècules per cel·la unitària, o 128 àtoms. En els cristalls comuns de seleni i tel·luri, els àtoms estan disposats en cadenes helicoidals, que s'apilen com fusta tallada. No obstant això, el seleni també forma anells de vuit àtoms, similars al sofre, i forma cristalls amb ells. El sofre també forma cadenes helicoidals, similars al seleni, i les apila juntes en cristalls.
Les estructures dels cristalls binaris
[modifica]
Els cristalls binaris, constituïts per dos elements químics, es troben en moltes estructures. Algunes parelles d'elements formen més d'una estructura. A temperatura ambient, el sulfur de cadmi pot cristal·litzar-se en la estructura de blenda de zinc o en la estructura de wurzita. L'òxid d'alumini també té dues possibles estructures a temperatura ambient, α-alúmina (corindó) i β-alúmina. Altres cristalls binaris mostren diferents estructures a diferents temperatures. Entre els cristalls més complexos es troben els del diòxid de silici , que té set estructures diferents a diverses temperatures i pressions; la més comuna d'aquestes estructures és el quars. Algunes parelles d'elements formen diversos cristalls en els quals els ions tenen diferents valències químiques. El cadmi i el fòsfor formen els cristalls Cd₃P₂, CdP₂, CdP4, Cd7P10 i Cd6P7. Només en el primer cas els ions s'assignen les valències químiques esperades de Cd2+ i P3-.[1]
Dins dels cristalls binaris, les estructures més fàcils de visualitzar són aquelles amb igual nombre dels dos tipus d'àtoms i que constitueixen la majoria dels cristalls binaris amb igual nombre de cations i anions:
-
Estructura del clorur de sodi .
-
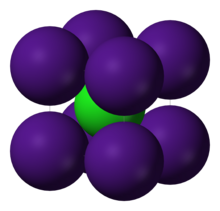
Estructura del clorur de cesi .
-
Estructura de la blenda de zinc .
-
Estructura de la wurtzita .
- L'estructura del clorur de sodi es basa en un cub amb els àtoms de sodi i clor situats als cantons alterns d'un cub i l'estructura es repeteix. L'estructura dels àtoms de sodi per separat o dels àtoms de clor per separat és CCC (cúbica centrada en les cares) i defineix la cel·la unitària. Així, l'estructura del clorur de sodi està composta per dues reixes CCC que es penetren mútuament.
- La reixa del clorur de cesi es basa en l'estructura CC (cúbica centrada en el cos); cada àtom és o cesi o clor. En aquest cas, la cel·la unitària és un cub.
- La tercera estructura important per als cristalls binaris AB és la de blenda de zinc . La seva cel·la unitària és CCC. Es basa en l'estructura del diamant, on cada àtom és A o B. Molts semiconductors binaris tenen aquesta estructura, inclosos aquells amb un àtom de la tercera (bor, alumini, gal·li o indi) i un de la cinquena (nitrogen, fòsfor, arsènic o antimoni) columna de la taula periòdica (GaAs, InP, etc.). La majoria dels calcogenurs (O, S, Se, Te) de cadmi i zinc (CdTe, ZnSe, ZnTe, etc.) també tenen l'estructura de blenda de zinc.
- L'estructura de wurzita, també sulfur de zinc , es basa en la reixa hexagonal compacta HC, on cada àtom és A o B.
La molècula de ful·lerè forma cristalls binaris MxC60 amb àtoms alcalins, on M és potassi, rubidi o cesi. Les molècules de ful·lerè mantenen la seva forma esfèrica, i els àtoms alcalins es col·loquen entre elles. L'índex x pot prendre diversos valors. Un compost amb x = 6 (per exemple, K6C60) és un aïllant amb els ful·lerens en una estructura CC (cúbica centrada en el cos). El cas x = 4 és un aïllant amb l'estructura tetragonal centrada en el cos, mentre que el cas x = 3 és un metall amb els ful·lerens en una estructura cfc. K₃C60, Rb₃C60 i Cs₃C60 són superconductors a baixes temperatures.[1]
Determinació d'estructures cristal·lines
[modifica]
Les estructures cristal·lines es determinen mitjançant experiments de dispersió utilitzant una part del cristall com a blanc. S'envia un feix de partícules cap al blanc, i en impactar-hi, algunes de les partícules es dispersen a partir del cristall i reboten en diverses direccions. Una mesura de les partícules dispersades proporciona dades brutes, que són després processades per ordinador per obtenir una imatge de les disposicions atòmiques. Les posicions són inferides a partir de les dades analitzades pel computador.[1]

El físic alemany Max von Laue (1879-1960) fou el primer a suggerir el 1912 que aquesta mesura es podria fer utilitzant raigs X. Es necessiten freqüències altes perquè aquestes ones tenen una longitud d'ona curta. Von Laue se'n adonà que els àtoms estan separats només per uns pocs àngstroms. Per poder mesurar les disposicions atòmiques, les partícules que es dispersen del blanc també han de tenir una longitud d'ona d'uns pocs àngstroms. Es necessiten raigs X quan el feix consisteix en radiació electromagnètica. Els raigs X només es dispersen en certes direccions, i hi ha molts raigs X associats a cada direcció. Les partícules dispersades apareixen en punts que corresponen a llocs on la dispersió de cada àtom idèntic produeix una ona sortint que té totes les longituds d'ona en fase.[1]
Combinar la radiació dispersada de tots els àtoms del cristall fa que totes les ones sortints s'afegeixin coherentment en certes direccions i produeixin un senyal fort a la radiació dispersada. Si la longitud addicional del camí és cinc vegades la longitud d'ona, per exemple, el punt apareix en un lloc. Si és sis vegades la longitud d'ona, el punt està en un altre lloc. Així, els diferents punts corresponen als diferents múltiples de la longitud d'ona dels raigs X. La mesura proporciona dos tipus d'informació: les direccions dels punts i la seva intensitat. No obstant això, aquesta informació és insuficient per deduir l'estructura cristal·lina exacta, ja que no hi ha un algorisme pel qual l'ordinador pugui anar directament de les dades a l'estructura. El cristal·lògraf ha de proposar diverses estructures i calcular com dispersarien els raigs X. Els resultats teòrics es comparen amb les mesures, i s'escull l'arranjament teòric que millor s'ajusta a les dades. Encara que aquest procediment és ràpid quan hi ha només uns pocs àtoms en una cel·la unitària, pot trigar mesos o anys per a estructures complexes. Algunes molècules de proteïnes, per exemple, tenen centenars d'àtoms. Es cultiven cristalls de les proteïnes, i s'utilitzen raigs X per mesurar l'estructura. L'objectiu és determinar com estan arranjats els àtoms dins de la proteïna, en comptes de com estan arranjades les proteïnes en el cristall.[11]
També es poden utilitzar feixos de neutrons per determinar l'estructura cristal·lina. El feix de neutrons s'obté perforant un forat en el costat d'un reactor nuclear. Els neutrons energètics produïts en la fissió nuclear escapen a través del forat. Cada neutró té una determinada longitud d'ona (dualitat ona-corpuscle) que depèn del seu moment lineal. Les direccions de dispersió estan determinades per la longitud d'ona, com és el cas dels raigs X.[12]
Els raigs X i els neutrons proporcionen la base per a dues tecnologies competidores en cristal·lografia. Tot i que són semblants en principi, els dos mètodes tenen algunes diferències. Els raigs X es dispersen pels electrons dels àtoms de manera que més electrons provoquen més dispersió. Els raigs X detecten fàcilment àtoms de nombre atòmic elevat, que tenen molts electrons, però no poden localitzar fàcilment àtoms amb pocs electrons. En els cristalls units per enllaços per pont d'hidrogen, els raigs X no detecten els protons en absolut. En canvi, els neutrons es dispersen pel nucli atòmic. Es dispersen fàcilment pels protons i són excel·lents per determinar l'estructura de sòlids units per enllaços per pont d'hidrogen. Un inconvenient d'aquest mètode és que alguns nuclis absorbeixen completament els neutrons, i hi ha poca dispersió des d'aquests objectius.[12]
També es poden utilitzar feixos d'electrons per mesurar l'estructura cristal·lina, ja que els electrons energètics tenen una longitud d'ona adequada per a aquestes mesures. El problema amb els electrons és que es dispersen fortament pels àtoms. La interpretació correcta dels resultats experimentals requereix que un electró només es dispersi d'un àtom i surti del cristall sense tornar a dispersar-se. La difracció d'electrons de baixa energia (LEED) és una tècnica en què es dirigeix un feix d'electrons cap a la superfície. Els electrons dispersats que es reflecteixen des de la superfície es mesuren. Es dispersen moltes vegades abans de sortir enrere, però principalment surten en poques direccions que apareixen com a "punts" a les mesures. Una anàlisi dels diversos punts dona informació sobre l'arranjament cristal·lí. Com que els electrons es dispersen fortament pels àtoms de les primeres capes de la superfície, la mesura només dona els arranjaments dels àtoms en aquestes capes. S'assumeix que aquesta mateixa estructura es repeteix en tot el cristall. Un altre experiment de dispersió implica electrons d'energia extremadament alta. La taxa de dispersió disminueix amb l'energia de l'electró, de manera que els electrons molt energètics normalment es dispersen només un cop. S'han construït diversos microscopis electrònics basats en aquest principi.[1]
Referències
[modifica]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 «Crystal - Structure, Lattice, Symmetry | Britannica» (en anglès). [Consulta: 23 agost 2023].
- ↑ UNIVERSITAT POLITÈCNICA DE CATALUNYA; TERMCAT, CENTRE DE TERMINOLOGIA; ENCICLOPÈDIA CATALANA. Diccionari de física [en línia]. 2a ed. Barcelona: TERMCAT, Centre de Terminologia, cop. 2019. (Diccionaris en Línia) (Ciència i Tecnologia)
- ↑ 3,0 3,1 UNIVERSITAT POLITÈCNICA DE CATALUNYA; TERMCAT, CENTRE DE TERMINOLOGIA; ENCICLOPÈDIA CATALANA. Diccionari de química [en línia]. 3a ed. Barcelona: TERMCAT, Centre de Terminologia, cop. 2020. (Diccionaris en Línia) (Ciència i Tecnologia)
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Bonewitz, Ronald Louis. Rocas y minerales (en castellà). Barcelona: Ediciones Omega, S.A., 2013, p. 18. ISBN 9788428215961.
- ↑ Kolasinski, Kurt W. Physical chemistry: how chemistry works. Chichester, West Sussex: Wiley, 2017. ISBN 978-1-118-75112-1.
- ↑ «Diccionari de geologia». [Consulta: 25 agost 2023].
- ↑ 7,0 7,1 7,2 Moeller, T. Química inorgánica: texto superior para uso de los estudiantes de las facultades de ciencias y escuelas de ingeniería. 3a. Barcelona: Reverté, 1973. ISBN 9788429173901.
- ↑ 8,0 8,1 8,2 8,3 Cruells Cadevall, M.; Llorca i Isern, N., Viñals Olià, J.. Ciència dels materials. 2a. Publicacions i Edicions de la Universitat de Barcelona, 2011.
- ↑ 9,0 9,1 9,2 9,3 Callister, William D. Introducción a la ciencia e ingeniería de los materiales. Limusa Wiley, 2009.
- ↑ 10,0 10,1 «Compare Metals». [Consulta: 24 agost 2023].
- ↑ 11,0 11,1 Bennett, Dennis W. Understanding single-crystal X-ray crystallography. Weinheim: Wiley-VCH-Verl, 2010. ISBN 978-3-527-32677-8.
- ↑ 12,0 12,1 Han, Fuxiang. Problems in Solid State Physics with Solutions (en anglès). WORLD SCIENTIFIC, 2011-10. DOI 10.1142/9789814365031_0010. ISBN 978-981-4365-02-4.