Història de la bateria elèctrica

La història de la pila reflecteix el desenvolupament històric de les diferents cel·les electroquímiques emprades per obtenir un corrent elèctric a partir de l'energia química continguda en unes substàncies químiques que pateixen una reacció d'oxidació-reducció.
En aquest cas, el nom de pila es refereix de manera genèrica a tots els dispositius que generen un corrent continu a partir d'una reacció química, encara que existeixen diferències entre ells: cel·les voltaiques (primàries i secundàries), piles elèctriques, acumuladors, bateries i piles de combustible. Per veure aquestes diferències, consultar el article sobre generadors electroquímics.
La pila de Bagdad de l'antiguitat
[modifica]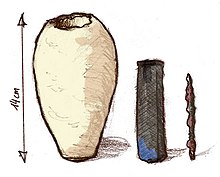
Al voltant de 1936, els arqueòlegs van descobrir en un poblet prop de Bagdad, un conjunt de vasos de terracota cadascuna dels quals contenia un rotllo de làmina de coure que albergava una vareta de ferro. Alguns científics especulen que aquests artefactes podrien ser antigues cel·les galvàniques (amb prop de 2.000 anys d'antiguitat, encara que el càlcul de l'edat segueix sent debatut), als quals se'ls anomena la "Pila de Bagdad". Es creu que un àcid comú dels aliments, com el suc de llimona o vinagre, va servir com un electròlit. En rèpliques modernes s'han produït amb èxit corrents elèctrics, donant crèdit a aquesta hipòtesi. Si la mostra va ser de fet una pila, va poder haver estat utilitzada per galvanoplàstia, per produir lleus descàrregues elèctriques com a font d'experiència religiosa, o simplement utilitzada per emmagatzemar rotlles antics. [2]
Pila voltaica
[modifica]
el 1780, Luigi Galvani estava disseccionant una granota, subjecta amb un ganxo de metall. Quan va tocar la pota de la granota amb el seu bisturí de ferro, la cama es va encongir com si l'animal encara estigués viu. Galvani creia que l'energia que havia impulsat la contracció muscular observada vi de la mateixa cama, i la va anomenar "electricitat animal".
No obstant això, Alessandro Volta, un amic i col·lega científic, no estava d'acord, creient que aquest fenomen va ser causat realment per la unió o contacte entre dos metalls diferents estan units per un intermediari humit. El mateix Volta va verificar experimentalment aquesta hipòtesi, i la va publicar a 1791. Va ser perfeccionada fins que, a 1800, Volta va inventar la primera bateria o generador electroquímic capaç de produir una corrent elèctric mantinguda en el temps, i per això va ser coneguda com a pila fotovoltaica. La pila fotovoltaica consisteix en parells de discos de coure i zinc apilats un sobre l'altre (d'aquí el nom de pila), separats per una capa de tela o de cartró impregnat en salmorra (aquest era el electròlit). A diferència de la ampolla de Leiden, la pila voltaica produïa una corrent continu i estable, i perdia poca càrrega amb el temps quan no la utilitza, encara que els seus primers models no podien produir una tensió prou forta com per produir espurnes.[3] experimentar amb diversos metalls i va trobar que el zinc i la argent li va donar els millors resultats.
Volta creia que el corrent es produïa com a resultat de la unió entre dos materials diferents, amb només tocar-se un a l'altre (aquesta teoria científica obsoleta va ser coneguda com la tensió de contacte), i no com a resultat de reaccions químiques (però, vegeu efecte termoelèctric). En conseqüència, va considerar que la corrosió que patien les planxes de zinc podia ser un defecte relacionat que potser podria corregir d'alguna manera amb el canvi de materials. No obstant això, cap científic havia aconseguit evitar aquesta corrosió. De fet, es va observar que la corrosió era més ràpid quan es produïa més corrent. Això va suggerir que la corrosió era realment part integrant de la capacitat de la bateria per produir un corrent. Això, en part, va portar al rebuig de la teoria de la tensió de contacte a favor de la teoria electroquímica. En les il·lustracions de Volta de la seva pila de corona i la pila voltaica (primera figura de dalt), apareixen discos de metall extra, ara sabem que innecessaris, a la part superior ia la inferior. La figura que apareix en aquesta secció, de la pila fotovoltaica de zinc-coure, té el disseny modern, una indicació que "la tensió de contacte" no és la font o causa de la força electromotriu de la pila voltaica.

Els models de pila originals de Volta tenen alguns errors tècnics, com fuites de l'electròlit i curtcircuit s provocats a causa del pes dels discs que comprimeixen els draps xops a la salmorra. L'anglès William Cruickshank resoldre aquest problema mitjançant la fixació dels elements en una caixa en lloc de amuntegats en una pila. Això va ser conegut com la bateria de pastera.[4] El mateix Volta va dissenyar una variant que consisteix en una cadena de vasos plens d'una solució de sal, units per arcs metàl·lics submergits en el líquid. Això va ser conegut com la Corona d'Copes o pila de corona. Aquests arcs estaven fets de dos metalls diferents (per exemple, zinc i coure), soldats entre si. Aquest model també va demostrar ser més eficient que les piles originals,[5] encara que no va ser tan popular.
Un altre problema de les piles de Volta era la seva curta durada (una hora en el millor dels casos), la qual cosa estava causat per dos fenòmens. El primer era que el corrent produïa l'electròlisi de la dissolució d'electròlits, la qual cosa originava una pel·lícula de bombolles d'hidrogen que es formaven a l'elèctrode de coure, que augmentava constantment la resistència interna de la bateria (Aquest efecte, anomenat polarització, és contrarestat en les cèl·lules modernes amb mesures addicionals). L'altre era un fenomen anomenat d'acció local, pel qual es formaven minúsculs curtcircuits al voltant de les impureses del zinc, causant la seva degradació. Aquest últim problema va ser resolt el 1835 per William Sturgeon, que va descobrir que barrejant una mica de mercuri amb el zinc s'eliminava aquest inconvenient.[6]
Malgrat els seus defectes, les piles de Volta proporcionaven un corrent més permanent que les gerres o ampolles de Leiden, i va fer possible molts experiments i descobriments nous, com l'electròlisi de l'aigua, realitzada per primera vegada per Anthony Carlisle i William Nicholson (químic).

1836 - La pila Daniell
[modifica]
Un químic britànic anomenat John Frederic Daniell va buscar una manera d'eliminar el problema de les bombolles d'hidrogen que apareixen a la pila voltaica, i la seva solució va ser utilitzar un segon electròlit per consumir l'hidrogen produït pel primer. el 1836, va inventar la pila Daniell, que consistia en un atuell de coure plena d'una dissolució de sulfat de coure (II), en el qual se submergeix un recipient de fang sense esmaltar ple de àcid sulfúric i un elèctrode de zinc. La barrera de fang era porosa, el que permetia als ions passar a través seva, però impedia la barreja de les dues dissolucions. Sense aquesta barrera, quan no hi havia corrent es va comprovar que els ions de coure (II) es derivaven cap a l'ànode de zinc i patien la reducció sense produir un corrent, destruint la vida de la bateria.[7]
Amb el temps, l'acumulació de coure podria bloquejar els porus de la barrera de fang i escurçar la vida de la bateria. No obstant això, la cel de Daniell proporcionen un corrent major i més fiable que la pila voltaica, a causa del dipòsit de coure electrolític en el càtode (un conductor) en lloc d'hidrogen (un aïllant). També era més segura i menys corrosiva. Tenia una tensió de funcionament del voltant de 1,1 volts. Va ser àmpliament utilitzada en les xarxes de telègraf, fins que va ser suplantada per la pila Leclanché a finals de la dècada de 1860.[6]
1844 - La pila de Grove
[modifica]
La pila de Grove va ser inventada per William Robert Grove a 1844 i és una modificació de la pila Daniell. Consistia en un ànode de zinc submergit en àcid sulfúric i un càtode de platí submergit en àcid nítric, separats per fang porós. La pila de Grove proporcionava un corrent elevat i un voltatge gairebé dues vegades superior al de la pila Daniell, pel que va ser la favorita de les xarxes telegràfiques d'Amèrica durant un temps. No obstant això, es desprenien vapors tòxics d'òxid nítric quan estava en operació.[6] La tensió també es reduïa considerablement quan la càrrega disminuïa, el que va arribar a ser una responsabilitat quan les xarxes telegràfiques es van fer més complexes. El platí també era molt car. La pila de Grove va ser substituïda per la més barata, més segura i de millor rendiment pila de gravetat en la dècada de 1860.
1859 - La bateria de plom-àcid: la primera bateria recarregable.
[modifica]
Fins aquest punt, totes les bateries existents havien de ser buidades de manera permanent quan s'esgotaven els reactius i acabaven totes les seves reaccions químiques. El 1859, Gaston Planté va inventar la bateria de plom-àcid, el primer acumulador, és a dir, la primera bateria que pot recarregar (en realitat, regenerar les substàncies químiques gastades) fent passar un corrent en sentit invers a través d'ella. Una bateria de plom-àcid es compon d'un ànode de plom i un càtode de diòxid de plom submergits en àcid sulfúric. Tots dos elèctrodes reaccionen amb l'àcid per produir sulfat de plom (II), però la reacció a l'ànode de plom allibera electrons mentre que la reacció en l'òxid de plom dels capta, el que produeix un corrent. Aquestes reaccions químiques poden ser revertides mitjançant l'aplicació d'un corrent en sentit invers, el que permet recarregar-, igual que es doni de fer abans del seu primer ús.
El primer disseny de Planta consistia en dues plaques de plom separades per bandes de goma i enrotllades en espiral.[8] Les seves bateries es van utilitzar per primera vegada per alimentar la llum en els vagons del tren mentre s'aturava en una estació. El 1881, Camille Alphonse Faure va inventar una versió millorada que consistia en una gelosia o reixeta de plom en la qual s'espesseix una pasta de diòxid de plom, formant una placa. Diverses planxes podien apilar per obtenir un major rendiment. Aquest disseny va ser més fàcil de produir en massa.
En comparació amb altres bateries, el disseny de planta era més aviat pesat i voluminós per la quantitat d'energia que podria emmagatzemar. No obstant això, podria produir pics de corrent molt grans. També tenia una resistència interna molt baixa, de manera que una mateixa bateria es pot utilitzar per alimentar múltiples circuits.[6]
La bateria de plom encara s'utilitza avui en els automòbils i altres aplicacions on el pes no és un factor important. El principi bàsic no ha canviat des de 1859, encara que en la dècada de 1970 es va desenvolupar una variant que utilitza un electròlit en forma de gel en lloc d'un líquid (comunament conegut com la bateria de gel), permetent que la bateria pugui ser utilitzada en diferents posicions sense errors o fuites.
Avui en dia les cel·les electroquímiques es classifiquen com a "primàries" si produeixen un corrent només fins que els reactius químics s'han esgotat, i "secundàries", si les reaccions químiques pot ser revertides mitjançant la recàrrega de la cel·la. La bateria de plom-àcid va ser, per tant, la primera bateria o cel·la secundària.
1860 - La cel·la de gravetat
[modifica]
Aquesta variant particular de la pila Daniell, també és coneguda com a cel de pota de gall a causa de la forma distintiva d'un dels seus elèctrodes.
En algun moment durant la dècada de 1860, un francès amb el nom de Callaud inventar una variant de la pila Daniell anomenada cel de gravetat.[6] Aquesta versió més simple prescindir de la barrera porosa. Això va reduir la resistència interna del sistema i per tant la bateria va produir un corrent més intensa. Ràpidament es va convertir en la bateria d'elecció per a les xarxes telegràfiques americanes i britàniques, i es va utilitzar fins a la dècada de 1950.[9] En la indústria del telègraf, aquesta bateria es muntava sovint in situ pels mateixos treballadors de telègrafs, i quan aquesta s'esgotava, era renovada mitjançant la substitució dels components consumits.[10]

La cel de gravetat consistia d'un flascó de vidre, amb un càtode de coure assentat a la part inferior i un ànode de zinc (amb forma semblant a una pota de gall), penjat per sota de la vora. S'escampaven cristalls de sulfat de coure (II) al costat del càtode, i el flascó s'omplia amb aigua destil lada. Quan el corrent circulava, es formava una capa de dissolució de sulfat de zinc a la part superior al costat del ànode. Aquesta capa superior es mantenia separada de la capa de sulfat de coure del fons per la seva menor densitat i per la polaritat de la cèl·lula.
La capa de sulfat de zinc era clara en contrast amb el color blau profund de la capa de sulfat de coure, que permetia a un tècnic comprovar la durada de la pila a primera vista. D'altra banda, aquesta configuració significava que la bateria només es podia utilitzar en un lloc fix, en cas contrari les dissolucions es barrejarien o es vessaria. Un altre inconvenient era que havia d'estar circulant, de manera contínua, un corrent per evitar que les dues dissolucions es barregessin per difusió, pel que aquesta cel no era adequada per a un ús intermitent.
Pila Leclanché
[modifica]
El 1866, Georges Leclanché va inventar una bateria que consistia en un ànode de zinc i un càtode de diòxid de manganès embolicats en un material porós, submergits en un pot de dissolució de clorur d'amoni. El càtode de diòxid de manganès estava barrejat amb una mica de carboni que millorava la conductivitat elèctrica i l'absorció d'electròlits.[11] subministrava un voltatge de 1,4-1,6 volt s.[6] Aquesta cèl·lula va aconseguir un èxit molt ràpid en telegrafia, senyalització i timbres elèctrics. Es va utilitzar per alimentar els primers telèfons, generalment des d'una caixa de fusta col·locada al costat de la paret, abans que els telèfons van poder obtenir l'energia de la pròpia línia. No podia proporcionar un corrent sostinguda durant molt de temps. En converses llargues, la bateria s'esgotava, fent inaudible la conversa.[12] Això es devia al fet que certes reaccions químiques en la cèl·lula augmentaven la resistència interna i, per tant, baixava el voltatge. Aquestes reaccions s'invertien quan la bateria es quedava inactiu, de manera que aquestes piles només eren adequades per a un ús intermitent.[6]
Pila de zinc-carboni - la primera pila seca
[modifica]
El 1887, Carl Gassner patentar una variant de la cel Leclanché que va arribar a ser coneguda com la pila seca, ja que no té un electròlit líquid lliure. En comptes d'això, va barrejar el clorur d'amoni amb guix de París per a crear una pasta, amb una mica de clorur de zinc afegit per a allargar la vida útil. Va submergir el càtode de diòxid de manganès dins la pasta, i va tancar el conjunt en una carcassa de zinc, que també actuava com ànode.
A diferència de les piles humides, la pila seca Gassner era més sòlida, no requeria manteniment, no es vessava i podia ser utilitzada en qualsevol posició. Subministrava un potencial de 1,5 volts. La primera pila seca produïda en massa va ser el model Columbia, comercialitzat per primera vegada per la National Carbon Company (NCC) el 1896. Aquesta companyia va millorar el model de Gassner, substituint el guix de París per cartró en espiral, una innovació que deixava més espai per al càtode i feia que la bateria fos més fàcil de muntar. Va ser la primera bateria apropiada per al públic en general i va fer pràctics els dispositius elèctrics portàtils. La llanterna elèctrica es va inventar aquest mateix any.[13] La bateria de zinc-carboni encara es fabrica avui en dia.
Paral·lelament, el 1887 Frederic Guillem Luis Hellesen va desenvolupar el seu propi disseny de pila seca. S'ha afirmat que el disseny de Hellesen va precedir el de Gassner.[14]

Bateria de níquel-cadmi
[modifica]El 1899, un científic suec anomenat Waldman Jungner va inventar la bateria de níquel-cadmi, una bateria recarregable que tenia elèctrodes de níquel i cadmi en una dissolució de hidròxid de potassi. Es va comercialitzar a Suècia el 1910 i va arribar als Estats Units el 1946. Els primers models eren robustos i tenien una densitat d'energia significativament més gran que les bateries de plom àcid, però eren molt més cars.
Bateria de níquel-ferro
[modifica]Waldman Jungner també va inventar una bateria de níquel-ferro el mateix any que la seva bateria de Ni-Cd, però va resultar ser inferior a la seva homòloga de cadmi i, per tant, mai es va molestar a patentar. Produïa molt més hidrogen gasós quan estava carregada, el que significa que no pot tancar-se, i el procés de càrrega era menys eficient (encara que era més barat).
No obstant això, Thomas Edison va recollir el disseny de la bateria de níquel-ferro de Jungner, la patentar ell mateix i la va vendre el 1903. Edison volia comercialitzar un substitut més lleuger i durador per a la bateria de plom-àcid que impulsava a alguns dels primers automòbils, i esperava que d'aquesta manera els cotxes elèctrics es convertirien en l'estàndard, amb la seva empresa com a proveïdor de la bateria principal. No obstant això, els clients van trobar que el seu primer model era propens a fuites i de curta durada de la bateria, i no superava a la bateria de plom-àcid per molt. Encara que Edison va ser capaç de produir un model més fiable i potent set anys més tard, aquesta vegada el Ford model T, de baix cost i bona fiabilitat, havia fet que les actuacions amb motor de gasolina fossin la norma. Tot i això, la bateria d'Edison va aconseguir un gran èxit en altres aplicacions.[15]
Pila alcalina
[modifica]
Fins a finals de la dècada de 1950 la bateria de zinc-carboni va seguir sent una bateria popular de cel·les primàries, però la durada relativament baixa d'aquesta bateria obstaculitzava les vendes. Les primeres piles alcalines eren similars a la de carboni-zinc però substituint l'electròlit per hidròxid de potassi (KOH). Noteu que el potassi és un metall alcalí, i d'aquí rep el seu nom.

El 1955, un enginyer que treballava per a l'empresa Eveready (ara coneguda com a Energizer) anomenat Lewis Urry intentava trobar una manera d'estendre la vida de les bateries de zinc-carboni, però Urry va decidir en canvi que les piles alcalines eren més prometedores. Fins aquest moment, les més duradores piles alcalines eren inviables cares. La bateria de Urry es componia d'un càtode de diòxid de manganès i un ànode de zinc en pols amb un electròlit alcalí.[16] A base de zinc en pols es va dotar a l'ànode d'una major superfície. Aquestes bateries van sortir al mercat el 1959.
Les piles alcalines primàries són més cares però són capaços de descarregar proporcionant corrents elevades i mantenint el rendiment. Les piles secundàries (recarregables) són més barates que les de níquel-cadmi, tenen bona retenció de càrrega i treballen en un ampli marge de temperatures.
| Pila alcalina | Pila d'òxid de plata | Pila de Liti-Manganès |
|---|---|---|

|

|
|
| Model LR44 o AG13, de 3 volts | Diversos models (SR44, etc) | Models CR de diferents mides. |
Pila de mercuri
[modifica]La pila de zinc-òxid de mercuri (II) és coneguda normalment com a pila de mercuri o pila de botó perquè sol tenir forma de disc petit. S'utilitza en audiòfons, cèl·lules fotoelèctriques i rellotges de polsera elèctrics. L'elèctrode negatiu és de zinc, l'elèctrode positiu d'òxid de mercuri (II) i l'electròlit és una dissolució de hidròxid de potassi. La bateria de mercuri produeix 1,34 V, aproximadament.[16]
Són molt tòxiques i perjudicials per l'ambient, per contenir fins a un 30% de mercuri. A causa de la seva toxicitat, ja no està permesa la seva comercialització, encara que es fan servir com a cel de referència per comparar amb les altres piles.
La pila d'òxid de plata
[modifica]La pila d'òxid de plata és semblant a la pila de mercuri, canviant l'òxid de mercuri per òxid de plata, i subministra 1,5 volts. Serveixen per corrents petites (rellotges, etc).[16] Té bona relació energia-pes i pobres respostes a baixa temperatura. Contenen un 1% de mercuri.
Anys 70's - L'acumulador de níquel-hidrogen
[modifica]
La pila de níquel hidrogen va entrar en el mercat com un subsistema d'emmagatzematge d'energia per satèl·lits de comunicacions comercials.[17][18] utilitza cel d'hidrogen pressuritzat a més de 1.200 psi (82,7 Bar]) Els aliatges de níquel poden dissoldre o alliberar hidrogen reversiblement i de manera proporcional a canvis en la pressió i temperatura. Aquest hidrogen es oxidaría a l'ànode. S'ha especulat que aquest tipus de pila podria reemplaçar a les de níquel-cadmi per a alguns usos.
Les reaccions electroquímiques implicades en aquest generador són més complexes que en altres tipus de piles. L'hidrogen és oxidat fins a formar aigua sobre elèctrodes de níquel sinteritzat porós, mentre l'aigua és rovellada.[19]
Finals dels 80's- L'Acumulador de níquel i hidrur metàl·lic
[modifica]
Les primeres piles recarregables de níquel metall hidrur (NiMH) de grau consumidor per a petits usos van aparèixer al mercat el 1989 com una variant de la bateria de níquel-hidrogen de la dècada de 1970.[20] Les bateries de NiMH tendeixen a tenir major longevitat que les bateries de Ni-Cd (i les seves esperances de vida segueixen augmentant a mesura que els fabricants experimenten amb noves aliatges) i, atès que el cadmi és tòxic, les bateries de NiMH són menys perjudicials per al medi ambient.
Pila de liti
[modifica]
El liti és el metall amb menor densitat i té el major potencial electroquímic i el major quocient energia-pes, així que en teoria, seria un material ideal perquè puguin fabricar piles i bateries. No es pot emprar un electròlit aquós, ja que reaccionaria amb el liti. L'experimentació amb piles de liti va començar el 1912 amb G. N. Lewis, i en la dècada de 1970 es van vendre les primeres bateries de liti. S'empren actualment diverses piles amb liti en l'ànode i diferents substàncies en el càtode:
- Pila de liti i sulfur de ferro (1,6 volts). Són de mida petita i baix cost.
- Pila de liti i diòxid de manganès (uns 3 volts). Similars a les anteriors.
- Pila de liti i diòxid de sofre. El càtode en aquest cas és gasós. S'empra per a aplicacions militars.
- Pila de liti i clorur de tionil. Treballen a molt baixes temperatures però el seu ús ha de ser curós per la seva toxicitat.
- Pila de liti i monofluoruro de carboni (uns 3,2 volts). S'empra per a petits dispositius com càmeres.
Anys 1990 - L'acumulador d'ió liti
[modifica]A la dècada de 1980, el químic nord-americà John B. Goodenough va dirigir un equip de recerca de Sony que produiria finalment la bateria de ions de liti, recarregable i una versió més estable de la bateria de liti (el liti pur reaccionava violentament al contacte amb un medi aquós). Les primeres unitats es van vendre el 1991. En aquestes bateries és important controlar els processos de càrrega i descàrrega, ja que per sobre de 60 graus Celsius poden explotar.
El càtode sol ser un òxid de cobalt i liti, mentre que l'ànode es compon de carboni porós. Aquest ànode és força car, de manera que s'estan estudiant alternatives amb níquel, manganès, o combinacions d'aquests metalls amb ions alumini o crom,[21]
El 1996, es va llançar al mercat la bateria de polímer de ió de liti. Aquestes bateries allotgen seva electròlit en un polímer sòlid compost en lloc de en un dissolvent líquid, i els elèctrodes i els separadors es lamina entre si. Aquesta última diferència permet que la bateria pugui quedar tancada en un embolcall flexible en lloc d'una carcassa metàl·lica rígida, el que significa que aquest tipus de bateries pot ser fabricat específicament per adaptar-se a un dispositiu en particular. També tenen una densitat d'energia més gran que les bateries de ions de liti normal. Aquests avantatges l'han convertit en una bateria d'elecció per als dispositius electrònics portàtils, com telèfons mòbils i PDA s, ja que permeten un disseny més flexible i compacte.
Pila de zinc-aire
[modifica]
Se les distingeix per tenir uns petits orificis en una de les cares. Subministren un voltatge constant durant tota la seva vida operativa i per això són molt adequades per a diverses aplicacions mèdiques i de comunicacions. Tenen una llengüeta de plàstic col·locada a la fàbrica que tanca els orificis de presa d'aire de la pila fins que hagi de ser utilitzada. No s'ha de retirar aquesta llengüeta abans del seu ús. Per activar la pila, simplement es retira la llengüeta i s'espera un minut per que l'aire entre i activeu els ingredients.
Referències
[modifica]- ↑ Joan de Andrés, Origen, progressos i estat actual de tota la literatura. pàg. 824 Verbum Editorial, 2001, ISBN 847962115X
- ↑ Gregory Corder, "Using an Unconventional History of the Battery to Engage students and explore the importance of evidence", Virginia Journal of Science Education 1
- ↑ Origin of Electrical Power , National Museum of American History; Darrer accés: 2 Gen, 2007
- ↑ Institute and Museum of the History of Science. .imss.fi.it/museum/esim.asp? c = 100497 Trough Battery [Consulta: 15 gener 2007].[Enllaç no actiu]
- ↑ Volta and the "Pile" Arxivat 2009-04-02 a Wayback Machine., Case Western Reserve University; Last access on Jan 2, 2007
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 James B. Calvert. jcalvert/tel/morse/morse.htm The Electromagnetic Telegraph.
- ↑ Giorgio Carboni, Experiments in Electrochemistry
- ↑ http://www.corrosion-doctors.org/Biographies/PlantelBio.htm, Corrosion-doctors.org; Last access on Jan 3, 2007
- ↑ gsraven/tools/tools4.html Tools of Telegraphy Arxivat 2010-07-02 a Wayback Machine., Telegraph Lore; Last access Jan 9, 2007
- ↑ Gregory S. Raven, gsraven/telegraph_tales/drgw/part2/jbnpage7.htm Recollections of a Narrow Gauge Lightning Slinger Arxivat 2010-07-02 a Wayback Machine.
- ↑ . html Zinc-Carbon Batteries[Enllaç no actiu], molecular Expressions; Darrer accés Jan 9, 2007
- ↑ Battery Facts. html Leclanché Cell [Consulta: 9 gener 2007].[Enllaç no actiu]
- ↑ The Columbia Dry Cell Battery Arxivat 2010-11-19 a Wayback Machine., American Chemical Society; Darrer accés: 9 gener 2007
- ↑ Energi på quede Arxivat 2007-09-28 a Wayback Machine., Jytte Thorndahl; Darrer accés: 26 juny 2007
- ↑ IEEE Virtual Museum. Edison's Alkaline Battery [Consulta: 10 gener 2007].
- ↑ 16,0 16,1 16,2 = PA67 Electricitat: principis i aplicacions. Richard J. Fowler. Editorial Reverté, 1994. ISBN 8429130284. Pàg 67
- ↑ A nickel/Hydrogen battery for PV systems
- ↑ «Nickel-Hydrogen Battery Technology-Development and Status». Arxivat de l'original el 2009-03-18. [Consulta: 26 juliol 2010].
- ↑ Diccionari de ciències. Diccionaris Oxford -Complutense. Diumenge Agustín Vázquez. Editorial Complutense, 2000. ISBN 8489784809.Pág. 787
- ↑ In search of the perfect battery
- ↑ battery . (2010). A: Encyclopædia Britannica. Darrer accés: 7 març 2010, de [Encyclopædia Britannica Online: http://www.britannica.com/EBchecked/topic/56126/battery]
Vegeu també
[modifica]Enllaços externs
[modifica]- "Elements de Física". Eduardo Lozano i Ponce de León. Madrid, 1907.
- Llibre desè - Electricitat dinàmica. Capítol primer: Pila voltaica; les seves modificacions. A: Tractat elemental de física experimental i aplicada i de meteorologia amb nombrosa col·lecció de problemes. A. Ganot. Ed Carlos Bailly-Bailliere. Madrid, 1862.
- Piles i acumuladors, màquines de corrent continu. Enciclopèdia CEAC d'electricitat. José Ramírez Vázquez, Amadeu diumenge Forcada. CEAC, 1981. ISBN 8432960020
