Cucumisina
| Identificadors | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número EC | 3.4.21.25 | ||||||||
| Bases de dades | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| Estructures PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| |||||||||
La cucumisina [EC 3.4.21.25], també coneguda com a al·lergen Cuc m 1 (Cucumis melo), hordolisina, macluralisina, proteasa D (Cucumis melo), taraxalisina i SEP-1 endopeptidasa (Hordeum vulgare), és un enzim que contribueix al desenvolupament de les plantes i a les senyalitzacions en cascada. Concretament, es tracta d'una serina endopeptidasa similar en estructura a la subtilisina microbiana i suposa un 10% del total de les proteïnes del suc de fruites del meló (Cucurbitaceae). Aquest tipus de proteases, enzims hidrolases, contenen un aminoàcid serina essencial per a la catàlisi enzimàtica i degraden enllaços peptídics.
La cucumisina té una elevada especificitat funcional i pot ser utilitzada en la indústria alimentària per l'elaboració formatges.[1]
Història
[modifica]Al 1960, R.F.Hartley classificà les peptidases en subgrups segons les característiques dels mecanismes catalítics. A hores d'ara, es coneixen sis tipus de catalítics de peptidases: les seríniques, les ciesteíniques, les treoníniques, les aspàrtiques, les glutamíniques i les metalopeptidases.
No va ser fins 1966, amb la determinació de la seqüència d'aminoàcids de la subtilisina (Smith et al) i de la seva estructura l'any 1969 (Wright et al), que es va saber que la subtilisina és clarament diferent a la quimotripsina. Actualment, se sap que la seqüència d'aminoàcids al voltant del residu reactiu histidina de la cucumisina és diferent de la mateixa seqüència en els enzims de les quimotripsines.[2]
Aquest enzim proteolític va ser purificat del sarcocarp per primer cop al 1975 per T.Kaneda i Tominaga.[1]
Estructura
[modifica]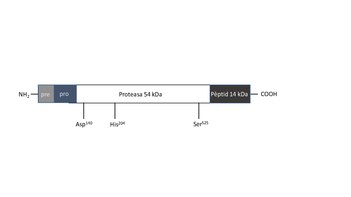
La cucumisina és una proteïna oligòmera que, per tant, presenta una estructura quaternària, la qual està formada per dues cadenes polipeptídiques amb una estructura molecular gairebé idèntica.
Aquestes cadenes polipeptídiques presenten tres dominis: el domini catalitic, el domini PA inserit al domini catalitic i un domini tipus C-terminal Fn-III. El domini catalitic adopta una forma de plec com la subtilisina, que consisteix en un full 𝛽 amb set cadenes paral·leles molt retorçat, flanquejat per nou hèlix 𝛼. El domini PA es troba inserit entre Met330 i Leu465 i inclou tres hèlix 𝛼 i nou cadenes 𝛽. El tercer domini està col·locat de forma adjacent al 𝛼10 del domini catalític mitjançant una regió linker flexible. El domini tipus Fn-III de la cucumisina forma una estructura de sandwich amb vuit cadenes 𝛽. Aquestes interaccions interdominiques impliquen diferents ponts d'hidrogen i contactes hidrofòbics amb els residus 𝛽24, 𝛽25 i 𝛽31 del domini tipus FN-III. La superfície enterrada entre el domini catalític i el domini tipus FN-III és de 1480Ų.[3]
L'estructura secundaria té gran relació amb l'activitat inhibidora del precursor de la cucumisina, és a dir, que és indispensable per la seva inhibició sobre l'enzim madur.[4]
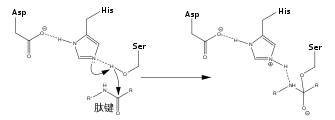
Pel que fa al centre actiu, la família de les proteases serines tenen una triada catalítica formada per serina, histidina i àcid aspàrtic/àcid glutàmic. Aquests residus corresponent a la Ser525, His204 i Asp140 de la curcumisina.[3]
Característiques
[modifica]- Pes molecular: 50kDa-78kDa
- La massa molecular de la cucumisina és aproximadament el doble que la de la subtilisina. De fet, aquesta gran massa molecular és la que li aporta estabilitat.[5]
- Les subtilisines són enzims estables a rangs de pH d'entre 7 i 10, amb una temperatura de fusió de 78 °C. La cucumisina en particular, la qual pertany a aquest subgrup proteic de les subtilisines, és també molt estable en un ampli rang de pH (2-11), i la seva temperatura de fusió és de 81º C. El pH òptim per al funcionament de la cucumisina és de 10,5 i la temperatura òptima és de 70º C. Per tant, és un enzim que actua en medis alcalins.
- Com moltes altres proteases, la cucumisina es sintetitza com un precursor preproenzimàtic, el qual té una forta activitat inhibidora sobre la cucumisina madura. El pèptid senyal de 22 residus s'elimina del precursor de la cucumisina al reticle endoplasmàtic i el propèptid de 88 residus s'elimina autocatalíticament per produir finalment cucumisina madura.
- És una serina proteasa alcalina i termoestable. És el principal al·lergen del meló (cucumis melo).[6]
Funció
[modifica]La cucumisina, com la resta de proteases, té la funció de regular el creixement i desenvolupament de la planta, així com les seves respostes davant d'un estímul. També té un paper molt important en el control de qualitat, la degradació i la substitució de determinades proteïnes.
Tot i la prevalença i la importància de les subtilases a les plantes, la informació sobre la seva activitat enzimàtica és molt limitada. La estructura primària de la cucumisina i altres subtilases de les plantes suggereix que són enzims secretors.[4]
Classificació
[modifica]Una de les principals classificacions acceptades i verificades a nivell mundial, tant d'enzims proteolítics en general com dels seus respectius inhibidors ens la proporciona la base de dades MEROPS, que classifica les proteïnes segons la taxonomia i la semblança de seqüències en diferents espècies, clans i famílies. Aquí trobem la cucumisina classificada dins el clan SB (conté tant exopeptidases com endopeptidases), dins la família S8, on hi trobem un cladograma d'espècies i un cladograma filogenètic. El codi de la cucumisina en la classificació MEROPS és S08.092. Una altra classificació ens la brinda la base de dades ENZYME, que ordena els enzims segons el seu número EC (Enzyme Comission number) 3.4.21.25.
Cal destacar que la cucumisina està classificada dins el subgrup de les subtilisines (subfamília S8A) ja que els residus d'aminoàcids de la triada catalítica estan caracteritzats per residus d'Asp140, His204 i Ser525. A més, l'ordre de la triada és idèntic a la de les subtilisines trobades en les espècies bacterianes de Bacillus pel que fa a l'estructura primària.[7]
Caràcter al·lergogen[6]
[modifica]El Cucumis melo, conegut com a Cuc m1 és considerat un al·lergogen oral ja que mostra gran resistència a la digestió de la pepsina i a les elevades temperatures.
Degut a l'autòlisi, la cucumisina nadiua de 67 kDa, al·lergen actiu, produeix un polipèptid de 14 kDa i una proteasa de 54 KDa, ambdues resistents a un posterior processament. L'activitat de la proteasa caseïnolítica perdura, per tant, després de l'autolisi.
Per tot això, a la cucumisina nadiua, a la madura i a la de l'extrem NH₂ se les coneix com a al·lèrgens Cuc m 1.01, Cuc m 1.02 i Cuc 1.03 respectivament.
Referències
[modifica]- ↑ 1,0 1,1 Gagaoua, Mohammed; Ziane, Ferhat; Nait Rabah, Sabrina; Boucherba, Nawel; Ait Kaki El-Hadef El-Okki, Amel «Three phase partitioning, a scalable method for the purification and recovery of cucumisin, a milk-clotting enzyme, from the juice of Cucumis melo var. reticulatus» (en anglès). International Journal of Biological Macromolecules, 102, 01-09-2017, pàg. 515–525. DOI: 10.1016/j.ijbiomac.2017.04.060. ISSN: 0141-8130.
- ↑ «MEROPS - the Peptidase Database». [Consulta: 6 novembre 2020].
- ↑ 3,0 3,1 Murayama, Kazutaka; Kato-Murayama, Miyuki; Hosaka, Toshiaki; Sotokawauchi, Ami; Yokoyama, Shigeyuki «Crystal Structure of Cucumisin, a Subtilisin-Like Endoprotease from Cucumis melo L.» (en anglès). Journal of Molecular Biology, 423, 3, 10-2012, pàg. 386–396. DOI: 10.1016/j.jmb.2012.07.013.
- ↑ 4,0 4,1 Nakagawa, Masataka; Ueyama, Megumi; Tsuruta, Hiroki; Uno, Tomohide; Kanamaru, Kengo «Functional analysis of the cucumisin propeptide as a potent inhibitor of its mature enzyme». The Journal of Biological Chemistry, 285, 39, 24-09-2010, pàg. 29797–29807. DOI: 10.1074/jbc.M109.083162. ISSN: 1083-351X. PMC: 2943254. PMID: 20639575.
- ↑ «Identification of the reactive histidine of cucumisin, a plant serine protease: Modification with peptidyl chloromethyl ketone derivative of peptid substrate» (en anglès). BQ20_TMarcet, 07-11-2020. [Consulta: 4 novembre 2020].
- ↑ 6,0 6,1 Sankian, Mojtaba; Talebi, Farideh; Moghadam, Maliheh; Vahedi, Fatemeh; Azad, Farahzad Jabbari «Molecular Cloning and Expression of Cucumisin (Cuc m 1), a Subtilisin-like Protease of Cucumis melo in Escherichia coli» (en anglès). Allergology International, 60, 1, 01-01-2011, pàg. 61–67. DOI: 10.2332/allergolint.10-OA-0195. ISSN: 1323-8930.
- ↑ Sotokawauchi, Ami; Kato-Murayama, Miyuki; Murayama, Kazutaka; Hosaka, Toshiaki; Maeda, Iori «Structural basis of cucumisin protease activity regulation by its propeptide» (en anglès). Journal of Biochemistry, 161, 1, 1-2017, pàg. 45–53. DOI: 10.1093/jb/mvw053. ISSN: 0021-924X.
