Peròxid d'hidrogen
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 34,005 Da i 34,005 g/mol |
| Trobat en el tàxon | |
| Rol | Oxidant, agent antiinfecciós local i metabòlit primari |
| Estructura química | |
| Fórmula química | H₂O₂ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,39 g/cm³ (a 20 ℃, líquid) |
| Viscositat cinemàtica | 1,245 cm²/s |
| PKa | 11,62 11,75 |
| Moment dipolar elèctric | 1,573 D |
| Punt de fusió | −0,432 ℃ −0,43 ℃ |
| Punt d'ebullició | 150,2 ℃ (a 760 Torr) |
| Entropia molar estàndard | 109,6 J/(mol K) |
| Moment dipolar elèctric | 1,573 D |
| Entalpia estàndard de formació | −136,11 kJ/mol |
| Pressió de vapor | 5 mmHg (a 30 ℃) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 1,4 mg/m³ (10 h, Estats Units d'Amèrica) |
| IDLH | 104,25 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| amargor | |
El peròxid d'hidrogen és un compost inorgànic molecular, un peròxid inorgànic, constituït per dos àtoms d'oxigen enllaçats entre sí i enllaçats cadascun d'ells a un hidrogen, de fórmula química . Les seves dissolucions aquoses s'anomenen aigua oxigenada. Té un paper com a agent oxidant, desinfectant, explosiu, agent antimicrobià, cofactor enzimàtic, metabòlit xenobiòtic humà, inductor d'apoptosi, antagonista de l'àcid γ-aminobutíric o GABA, neurotoxina, genotoxina, biomarcador, metabòlit de Saccharomyces cerevisiae, de Escherichia coli, del ratolí i agent de blanqueig.
El peròxid d'hidrogen hom el troba de manera natural en les cèl·lules de tots els organismes aeròbics, com a producte residual de la β-oxidació peroxisomal. Donada la seva toxicitat ha de transformar-se ràpidament en compostos menys perillosos. Aquesta tasca la realitza l'enzim catalasa que catalitza la descomposició en aigua i oxigen.
Història
[modifica]El peròxid d'hidrogen fou obtingut per primera vegada el 1818 pel químic francès Louis-Jacques Thénard (1777-1857) a partir del peròxid de bari que tractà amb àcid nítric i l'anomenà aigua oxigenada.[1][2] El 1880 s'inicià la producció comercial basada en aquesta reacció, però aviat fou abandonada per la baixa concentració en què s'obtenia el peròxid d'hidrogen, l'elevat cost i la seva baixa estabilitat.[3]
El 1908 a Àustria l'empresa Österreichische Chemische Werke, de Weiẞenstein, inicià la producció emprant el procés electroquímic. Aquest mètode es basa en l'electròlisi d'una dissolució d'àcid sulfúric que produeix àcid perdisulfúric , el qual s'hidrolitza donant àcid sulfúric i peròxid d'hidrogen. L'empresa austríaca modificà el procés substituint l'àcid sulfúric per sulfat d'amoni .[3]
El 1932 James H. Walton i George W. Filson proposaren la producció de peròxid d'hidrogen per una oxidació i posterior reducció d'hidrazobenzens. George Pfleiderer de l'empresa alemanya BASF desenvolupà després un procés per a la auto-oxidació alcalina d'hidrazobenzè per obtenir peròxid de sodi emprant una amalgama de sodi com a reductor. A Finlàndia una fàbrica a Kuusankoski de l'empresa Kymmene AB operà amb aquest procés. A la BASF, Hans Joachim Riedl el millorà emprant hidroquinones i entre 1935 i 1945 la BASF inicià la construcció de dues plantes a Heidebreck i Waldenberg per operar amb aquest procés de Riedl-Pfleiderer, però degut a la finalització de la II Guerra Mundial no començaren a operar.[3]

El govern del III Reich durant la II Guerra Mundial desenvolupà l'aplicació del al 80% com a propulsor de vehicles. Hellmuth Walter el 1933 inicià el desenvolupament de submarins amb una turbina de 400 CV impulsada per amb injecció líquida. Tanmateix l'aplicació més important fou el generador de gas de V-2, el primer coet de combustible líquid realment funcional. El V-2 cremava etanol amb l'oxigen obtingut per la descomposició del en reaccionar amb una dissolució de permanganat de potassi.[4]
El francès Paul-Antoine Giguère el 1950 mitjançant espectroscòpia infraroja determinà l'estructura de la molècula de peròxid d'hidrogen.[5][6] El 1953 l'empresa estatunidenca EI Du Pont de Nemours fou la primera que inicià la producció basada en el procés de Riedl-Pfleiderer.[3]
El 2011 es detectaren per primera vegada molècules de peròxid d'hidrogen fora de la Terra mitjançant el telescopi APEX (Atacama Pathfinder Experiment) de Xile, dins la regió Rho Ophiuchi de la Via Làctia, a uns 400 anys llum de distància. La proporció de peròxid d'hidrogen és d'una molècula per cada 10.000 molècules d'hidrogen. La formació de peròxid d'hidrogen està fortament vinculada a altres dues molècules fonamentals per la vida: l'oxigen i l'aigua.[7]
Estructura
[modifica]La molècula de peròxid d'hidrogen és una molècula constituïda per dos àtoms d'oxigen i dos d'hidrogen enllaçats . Tanmateix no és lineal, sinó que està continguda en dos plans quasi perpendiculars.[5][6] Malgrat l'enllaç és un enllaç covalent sigma, la molècula té una barrera rotacional relativament alta a 2460 cm−1 (29,45 kJ/mol),[8] si se la compara amb la de l'età (12,5 kJ/mol). L'explicació d'aquest fet cal cercar-lo en la repulsió de les dues parelles d'electrons que no formen enllaç de cada oxigen que impedeixen la rotació de l'enllaç simple .
Les estructures de les molècules en estat gasós i en estat sòlid són lleugerament diferents degut als efectes de l'enllaç d'hidrogen entre molècules diferents, només present en estat sòlid.[9] En estat sòlid cristal·litza en el sistema tetragonal, grup espacial D4
4P4121.[10]
Propietats
[modifica]Propietats físiques
[modifica]El peròxid d'hidrogen a temperatura ambient és un líquid xaropós, de gust aspre i astringent. A 0 °C té una densitat de 1,4649 g/cm³. En estat sòlid la seva densitat és d'1,64 g/cm³. Congela a –0,89 °C i s'ha calculat que el seu punt d'ebullició ha de ser 151,4 °C. És soluble en aigua, en etanol i en dietilèter però insoluble en benzè.[11]

Propietats químiques
[modifica]Descomposició
[modifica]És una substància molt inestable, que té tendència a perdre oxigen per a convertir-se en aigua:
Les partícules de pols, els àlcalis lliures, els metalls pesant en forma col·loidal i els seus ions i la llum catalitzen aquesta descomposició. El líquid anhidre i les dissolucions concentrades no es poden envasar en envasos de vidre perquè l'ataca donant una dissolució alcalina que accelera la descomposició. Els envasos també són opacs per evitar la descomposició per la llum. Hi ha substàncies que actuen com inhibidors de la descomposició (acetanilida, 8-hidroxiquinoleïna, etanol, dietilèter i àcids) i s'empren com estabilitzants de les dissolucions.[11] En els organismes aeròbics l'enzim catalasa és el catalitzador que accelera aquesta descomposició.
Propietats àcides
[modifica]El peròxid d'hidrogen és un àcid molt feble (Ka = 2,4×10–11) que s'ionitza donant cations oxidani o oxoni i anions hidrogen(peròxid)(1–) o dioxidanur :
Propietats redox
[modifica]Pot actuar com un oxidant o com un reductor degut a que l'anió peròxid , on l'oxigen té número d'oxidació –1, pot reduir-se a anió òxid , amb número d'oxidació –2, o oxidar-se a dioxigen , amb número d'oxidació 0. Les semireaccions són:
Són importants les reaccions en medi àcid d'oxidació dels iodurs a diiode (), dels sulfurs i sulfits a sulfats () i dels arsenits a arsenats (). Quant a les reaccions de reducció destaquen les del permanganat de potassi a manganès (2+):
del sulfat de ceri(IV), dels hipoclorits a clorurs (), dels periodats a iodats (), de l'ozó a dioxigen (), de l'òxid d'argent a argent (), i de les sals d'or a or metàl·lic.[11]
Obtenció
[modifica]Prop del 99% del peròxid d'hidrogen que es produeix de forma industrial es realitza mitjançant el procés de l'antraquinona conegut com a procés de Riedl-Pfleiderer.[12]

La primera etapa és l'oxidació d'un derivat de l'antraquinona amb un hidrocarbur no polar, com ara la 2-etilantraquinona. Es prepara una dissolució de 2-etilantraquinona en un dissolvent polar i es mescla amb una suspensió d'un catalitzador basat en níquel o pal·ladi en un suport sòlid. Per aquesta mescla es fa passar hidrogen a una temperatura de 320 K, i es produeix la hidrogenació a 2- etilantraquinol.
A la segona etapa la dissolució de 2-etilantraquinol s'oxida amb aire a un hidroperòxid, que reacciona amb aigua per recuperar la 2-etilantranquinona i produir una solució diluïda de peròxid d'hidrogen.
A l'etapa tercera s'afegeix aigua per extreure el peròxid d'hidrogen com una solució aquosa que conté un 40% de peròxid d'hidrogen. La capa de dissolvent orgànic es recicla a la unitat d'hidrogenació per a reaccions posteriors.
Finalment a la darrera etapa la dissolució aquosa de peròxid d'hidrogen es tracta amb dissolvents orgànics i mitjançant l'aire que es bombeja per eliminar quinona residual i dissolvents i produir el producte estàndard al 40%. Algunes aplicacions requereixen un producte de major concentració produït per concentració o destil·lació al buit fins a concentracions de fins al 70%.
Usos
[modifica]La concentració habitual de l'aigua oxigenada per a usos mèdics és d'entre el 3% i el 10%. La concentració de les dissolucions aquoses de peròxid d'hidrogen s'acostuma a expressar en volums, això és els litres d'oxigen que es generarien en la descomposició de tot el peròxid d'hidrogen present en un litre de dissolució, en condicions normals. Així, per exemple, una dissolució de peròxid d'hidrogen de 10 volums equival a una dissolució al 3% d'aigua oxigenada.
La producció mundial de peròxid d'hidrogen se situa el 2015 al voltant de les 4,3 milions de tones, essent els principals productors la Xina (1,5 milions de tones), els Estats Units (0,4 milions de tones); Bèlgica i Tailàndia (0,3 milions de tones cadascun) i Canadà (0,2 milions de tones).[12]
Aplicacions industrials
[modifica]
Un 50% de la producció mundial de peròxid d'hidrogen (2015) s'utilitza com lleixiu per blanquejar polpa de paper i paper.[12][13] Una altra aplicació principal és la manufactura de percarbonat de sodi i perborat de sodi usats com a blanquejadors en detergents per a la roba, que representen el 20% de la producció. El 15 % s'empra per a blanquejar teixits de cotó i llana. El 10 % s'empra per substituir el clor sense gaire o gens d'increment de cost econòmic en el tractament d'aigües potables, evitant els residus tòxics.[12]
Es fa servir en la producció de certs peròxids orgànics com peròxid de dibenzoil usat en la polimerització i altres processos químics. També es fa servir en epòxids com l'òxid de propilè. En el procés de manufactura PCB el peròxid d'hidrogen es mescla amb àcid clorhídric per gravar la superfície de coure. Una combinació amb un catalitzador de metall preciós en pols, peròxid d'hidrogen, metanol i aigua pot produir vapor superescalfat en només dos segons alliberant només CO₂ amb diverses aplicacions.[14] En reactors nuclears força l'oxidació i dilució de la corrosió dipositada en el combustible. També es fa servir en l'exploració de petroli i gas per oxidar la roca matriu.
Funció biològica
[modifica]L'escarabat bombarder el fa servir per reaccionar amb la hidroquinona per desencoratjar els seus depredadors. Segons la revista Nature, amb estudis fets sobre el peix zebra, el peròxid d'hidrogen té un paper en el sistema immunitari.[15][16] El peròxid d'hidrogen té papers importants com a molècula senyalitzadora en diversos processos biològics.[17] També té un paper en l'envelliment[18] i el càncer[19]
Ús domèstic
[modifica]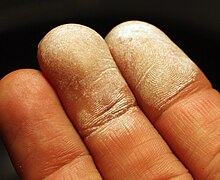
El peròxid de sodi diluït entre el 3% i el 8% es fa servir per blanquejar (fer ros) el cabell quan es mescla amb hidròxid d'amoni. S'absorbeix per la pell i la blanqueja temporalment per embolisme de capil·laritat. Blanqueja els ossos. Lleva les taques de sang que siguin recents dels vestits i altres superfícies.
En horticultura es fa servir de vegades en hidroponia, car l'oxigen que produeix augmenta el desenvolupament de les arrels de les plantes i va bé contra algunes plagues i malalties de les arrels.[20][21][22] En petits aquaris es fa servir per proporcionar oxigen als peixos petits.[23][24]
El peròxid d'hidrogen combinat amb salfumant i sal de taula forma un producte substitutiu de productes químics industrials com el clorur fèrric o el persulfat d'amoni per a fer circuits impresos d'afeccionat.[25]
Ús com propel·lent
[modifica]
A alta concentració (85%–98%) el peròxid d'hidrogen s'anomena diu HTP o High Test Peroxide. Es pot fer servir com monopropel·lent (no barrejat amb combustible) o com component oxidant (coet bipropel·lent).
S'ha emprant com a bipropel·lent de coets, de míssils, de torpedes i de naus espacials. Les combinacions emprades o estudiades són: i un hidrocarbur; amb hidrazina; amb querosè, que fou el més emprat en coets britànics fins a la dècada del 1960 i recuperat en la dècada del 1990 en el projecte Black Horse.[26]
Com a monopropel·lent s'empra en coets motxilla que permeten a una persona enlairar-se amb el motor a l'esquena. En el Bell Rocket Belt el nitrogen a pressió expulsa el peròxid d'hidrogen cap un compartiment on un catalitzador produeix la descomposició del peròxid d'hidrogen en aigua i dioxigen que són expulsats cap a l'exterior.
Ús terapèutic
[modifica]És un agent antimicrobià i oxidant considerat segur.[27] Per exemple el peròxid d'hidrogen del 35% es fa servir en hospitals per prevenir la transmissió d'infeccions. És un esporicida esterilitzant. És una equivocació creure que el peròxid d'hidrogen és un desinfectant i antisèptic per tractar les ferides.[28][29] En la seva aplicació com a desinfectant, s'aprofita la seva capacitat per a oxidar i destruir teixits, que en ser aplicada en zones localitzades, es pretén que només afecti els teixits més externs de les ferides, provocant la destrucció dels possibles agents patògens.
Mentre que és un agent netejador efectiu, el peròxid d'hidrogen no és un agent efectiu per reduir les infeccions bacterianes de les ferides. A més pot impedir la cicatrització perquè destrueix les cèl·lules de la pell recentment formada.[30]
- Es pot fer servir com a pasta de dents barrejat amb la correcta quantitat d'hidrogencarbonat de sodi i sal.[31]
- El peròxid d'hidrogen i el peròxid de benzoil de vegades es fan servir per tractar l'acne[32]
- També s'usa com emètic en veterinària.[33]
En explosius
[modifica]El peròxid d'hidrogen era un dels principals ingredients de la bomba del metro de Londres del 7 de juliol de 2005 que va matar 57 persones.[34] També es va utilitzar a les bombes contra el metro de Madrid.
Referències
[modifica]- ↑ Thénard, L.J. «Observations sur des combinaisons nouvelles entre l'oxygène et divers acides». Annales de Chimie et de Physique, 8, 1818, pàg. 306-313.
- ↑ Thénard, L.J. «Observations sur l'influence de l'eau dans la formation des acides oxigénés». Annales de Chimie et de Physique, 9, 1818, pàg. 314-317.
- ↑ 3,0 3,1 3,2 3,3 Goor, G. «Hydrogen Peroxide: Manufacture and Industrial Use for Production of Organic Chemicals». A: Catalytic oxidations with hydrogen peroxide as oxidant. Dordrecht: Kluwer Academic Publishers, 1992. ISBN 0-7923-1771-8.
- ↑ Grzegorz Rarata; Wojciech Florczuk; Jaromir Smetek «Research on Preparation and Propulsive Applications of Highly Concentrated Hydrogen Peroxide». Jour. of Aerospace Science and Technology, 2, 1, 28-01-2016. DOI: 10.17265/2332-8258/2016.01.006.
- ↑ 5,0 5,1 Giguère, Paul A. «The Infra‐Red Spectrum of Hydrogen Peroxide». Journal of Chemical Physics, 18, 1, 1950, pàg. 88. Arxivat de l'original el 2 desembre 2017. DOI: 10.1063/1.1747464.
- ↑ 6,0 6,1 Giguère, Paul A. «Molecular association and structure of hydrogen peroxide». Journal of Chemical Education, 60, 5, 1983, pàg. 399–401. DOI: 10.1021/ed060p399.
- ↑ Encuentran agua oxigenada en el espacio
- ↑ Hunt, Robert H.; Leacock, Robert A.; Peters, C. Wilbur; Hecht, Karl T. «Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential». The Journal of Chemical Physics, 42, 6, 1965, pàg. 1931. Arxivat de l'original el 9 abril 2014. Bibcode: 1965JChPh..42.1931H. DOI: 10.1063/1.1696228.
- ↑ Dougherty, Dennis A.; Anslyn, Eric V. Modern Physical Organic Chemistry. University Science, 2005, p. 122. ISBN 978-1-891389-31-3.
- ↑ Abrahams, S. C.; Collin, R. L.; Lipscomb, W. N. «The crystal structure of hydrogen peroxide». Acta Crystallographica, 4, 1, 01-01-1951, pàg. 15-20. DOI: 10.1107/S0365110X51000039.
- ↑ 11,0 11,1 11,2 Babor, Joseph A.. Química general moderna : una introducción a la química física y a la química descriptiva superior (inorgánica, orgánica y bioquímica). 8{487} ed., reimp. Barcelona: Marín, imp. 1979. ISBN 84-7102-997-9.
- ↑ 12,0 12,1 12,2 12,3 Lazonby, John. «Hydrogen peroxide» (en anglès britànic). [Consulta: 4 desembre 2019].
- ↑ Ronald Hage, Achim Lienke «Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching». Angewandte Chemie International Edition, 45, 2, 2005, pàg. 206–222. DOI: 10.1002/anie.200500525. PMID: 16342123.
- ↑ «Instant steam puts heat on MRSA, Society Of Chemical Industry». Arxivat de l'original el 2009-01-05. [Consulta: 8 agost 2011].
- ↑ «Natural bleach 'key to healing'». BBC News, 06-06-2009 [Consulta: 2 juliol 2009].
- ↑ Niethammer, Philipp; Clemens Grabher, A. Thomas Look & Timothy J. Mitchison «A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish». Nature, 459, 7249, 03-06-2009, pàg. 996–999. DOI: 10.1038/nature08119. ISSN: doi=10.1038/nature08119. PMC: 2803098. PMID: 19494811 [Consulta: 2 juliol 2009].
- ↑ reference)
- ↑ (reference)
- ↑ (reference)
- ↑ Fredrickson, Bryce. «Hydrogen Peroxide and Horticulture». [Consulta: 25 gener 2009].[Enllaç no actiu]
- ↑ Ways to use hydrogen peroxide in the garden
- ↑ Oxygation Unlocks Yield Potentials of Crops in Oxygen-Limited Soil Environments Advances in Agronomy, Volume 88, 2005, Pages 313-377 Surya P. Bhattarai, Ninghu Su, David J. Midmore
- ↑ Great-lakes.org
- ↑ «fws.gov». Arxivat de l'original el 2008-04-23. [Consulta: 8 agost 2011].
- ↑ «PCB Etchant from household materials». Arxivat de l'original el 2011-08-14. [Consulta: 8 agost 2011].
- ↑ «Encyclopedia Astronautica Index: H». [Consulta: 5 desembre 2019].
- ↑ «Sec. 184.1366 Hydrogen peroxide». U.S. Government Printing Office via GPO Access, 01-04-2001. [Consulta: 7 juliol 2007].
- ↑ O’Connor, Anahd «Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds». New York Times, 19-06-2007 [Consulta: 13 juliol 2011].
- ↑ Carroll, Aaron E.; Rachel C. Vreeman «Medical myths don't die easily». CNN, 12-07-2011 [Consulta: 13 juliol 2011].
- ↑ «Hydrogen peroxide disrupts scarless fetal wound repair». Cat.inist.fr. Arxivat de l'original el 2013-12-14. [Consulta: 5 setembre 2010].
- ↑ Shepherd, Steven. «Brushing Up on Gum Disease». FDA Consumer. Arxivat de l'original el 14 maig 2007. [Consulta: 7 juliol 2007].
- ↑ Milani, Massimo; Bigardi, Andrea; Zavattarelli, Marco «Efficacy and safety of stabilised hydrogen peroxide cream (Crystacide) in mild-to-moderate acne vulgaris: a randomised, controlled trial versus benzoyl peroxide gel». Current Medical Research and Opinion, 19, 2, 2003, pàg. 135–138(4). DOI: 10.1185/030079902125001523. PMID: 12740158.
- ↑ «Drugs to Control or Stimulate Vomiting». A: Merck Veterinary manual. Merck & Co., Inc, 2006. Arxivat 2016-03-24 a Wayback Machine.
- ↑ BBC News, - 7/7 inquests: Coroner warns over bomb ingredient


![{\displaystyle {\ce {2H2O2 ->[catalasa] 2H2O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cadcae4d1c39bf30ce680d09c26ca757475cc71)




























