Àcid nítric
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 62,995643 Da |
| Trobat en el tàxon | |
| Rol | explosiu i àcid fort |
| Estructura química | |
| Fórmula química | HNO₃ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,5 g/cm³ (a 77 ℃) |
| Índex de refracció | 1,397 |
| PKa | −1,64 |
| Moment dipolar elèctric | 2,17 D |
| Punt de fusió | −42 ℃ −41,6 ℃ |
| Punt d'ebullició | 83 ℃ (a 760 Torr) 83 ℃ (a 101,325 kPa) |
| Moment dipolar elèctric | 2,17 D |
| Entalpia estàndard de formació | −174,1 kJ/mol |
| Entalpia de vaporització | 39,1 kJ/mol |
| Pressió de vapor | 48 mmHg (a 20 ℃) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 5 mg/m³ (10 h, Estats Units d'Amèrica) |
| Límit d'exposició a curt termini | 10 mg/m³ (cap valor) |
| IDLH | 64,5 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
L'àcid nítric és un oxoàcid de nitrogen de fórmula , a temperatura ambient és un líquid incolor[1] que forma fums a l'aire humit i que té tendència a descompondre's per a formar òxids de nitrogen.[2] És un àcid fort, corrosiu i tòxic, que pot produir cremades greus.
L'àcid nítric és un oxidant molt actiu.[3]
Usat sovint com a reactiu al laboratori, és usat per fabricar explosius com la nitroglicerina i el trinitrotoluè (TNT), així com fertilitzants com el nitrat d'amoni . També té usos en la metal·lúrgia i el refinatge, ja que reacciona amb la major part de metalls, i en la síntesi de compostos orgànics. És l'àcid tradicionalment emprat en la calcografia, gravat en planxa de metall.
Mesclat amb àcid clorhídric forma l'aigua règia, que pot dissoldre l'or i el platí. L'àcid nítric és també un component de la pluja àcida.
Història
[modifica]El seu descobriment se li atribueix a l'alquimista persa Jàbir ibn Hayyan, conegut pel nom llatinitzat de Geber, que va ser també el primer a documentar-ho al segle viii. Els alquimistes medievals del segle xiii l'utilitzaven per a refinar els metalls preciosos, l'or i l'argent i era conegut com a aqua fortis (aigua forta) [1] o aqua valens (aigua poderosa)[2]. També va ser conegut com a esperit de nitre.[1]
L'any 1650, el químic i alquimista alemany Johann Rudolph Glauber (1604 - 1670), el va sintetitzar a partir de l'àcid sulfúric i el nitrat de sodi, 1776, el químic francès Antoine Lavoisier (1743 - 1794), va demostrar que l'àcid nítric contenia oxigen i el 1785, el químic britànic Henry Cavendish (1731 - 1810), va aconseguir sintetitzar-ho a partir de l'aire humit fent saltar guspires elèctriques,[4] el 1816, Joseph Louis Gay-Lussac (1778 - 1850), en determinà la composició.[5]
La primera font d'àcid nítric va ser el salnitre (nitrat de potassi) tractat amb àcid sulfúric, durant el segle xix el nitrat de Xile (nitrat de sodi) va reemplaçar el salnitre. Amb l'arribada del segle xx van aparèixer noves tècniques per a produir-lo. A Noruega, on l'electricitat era molt barata es van començar a utilitzar forns d'arc elèctric per a aconseguir òxids de nitrogen i àcid nítric directament a partir de l'aire. Tanmateix la vida d'aquesta tècnica fou curta i vers el 1930 ja havia quedat en desús. A la mateixa època, el 1908, l'alemany Wilhelm Ostwald (1853 – 1932) va desenvolupar a Bochum un procés per a produir àcid nítric a partir de l'oxidació catalítica de l'amoníac, és el que es coneix com a Procediment Ostwald. El 1913 ela químics alemanys Fritz Haber (1868 - 1934) i Carl Bosch (1874 - 1940) van aconseguir la síntesi de l'amoníac, mitjançant el procés de Haber-Bosch, amb una font segura i econòmica d'amoníac, aquest producte va esdevenir clau en la producció industrial d'àcid nítric. Aquest procés encara s'utilitza avui dia.[2]
Estructura
[modifica]La molècula d'àcid nítric és plana, amb el nitrogen situat al centre i els tres oxígens disposats en els vèrtexs d'un triangle equilàter. Les longituds d'enllaç del nitrogen amb els oxígens no units a l'hidrogen són de 122 pm i la del nitrogen amb l'oxigen unit a l'hidrogen 141 pm, un poc més llarg que els altres dos. La molècula es pot descriure a partir de la teoria d'enllaç de valència. L'àtom de nitrogen adopta hibridació sp² i forma enllaços simples σ amb els tres oxígens. Amb l'orbital p que queda lliure al N es pot formar un enllaç doble π amb un altre orbital p d'un hidrogen. Finalment la semblança experimental dels dos enllaços sense enllaç a l'hidrogen es pot explicar a partir d'estructures ressonants:[5]
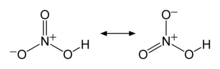

L'angle entre els oxígens no enllaçats a l'hidrogen és de 130,27º superior als 120º que hauria de tenir si les direccions dels enllaços fossin els vèrtexs d'un triangle equilàter. Això és a causa de la repulsió elèctrica d'aquests dos oxígens.[7]
Propietats
[modifica]Propietats físiques
[modifica]L'àcid nítric pur és un líquid incolor, de densitat 1,5129 g/cm³, que bull a 83 °C i se solidifica en forma de sòlid blanc a –41,6 °C cristal·litzant en el sistema monoclínic.[8] En presència d'aire humit dona lloc a un núvol de gotes molt petites de dissolució d'àcid nítric en aigua. Es mescla amb aigua en totes les proporcions, és higroscòpic. Forma una mescla azeotròpica, de punt d'ebullició constant de 121,9 °C que conté un 68,4 % d' i densitat 1,407 g/cm³, que és l'àcid nítric concentrat comercial.[5] La corba de punts de congelació per a solucions aquoses d'àcid nítric té dos màxims corresponents als punts de fusió dels dos hidrats d'àcid nítric: el monohidrat (77,77% en massa d'àcid) a –37,62 °C i el trihidrat (58,83% en massa d'àcid) a 18,47 °C. Els mínims locals es produeixen a 32, 71 i 91% en massa d'àcid.[8]

L'àcid pur és inestable i es descompon si se l'escalfa o entra en contacte amb la llum, donant diòxid de nitrogen , aigua i oxigen, segons la reacció:
En estat líquid està parcialment dissociat de dues maneres. Una és amb el pentaòxid de dinitrogen i aigua:
i també està ionitzat segons la reacció:

L'àcid groc, que conté òxids de nitrogen s'anomena àcid nítric fumant.[5] La seva tendència a la descomposició per a formar diòxid de nitrogen s'accelera en presència de la llum o si s'augmenta la temperatura. En funció de la concentració de diòxid de nitrogen dissolt, el seu color oscil·la entre groc i vermell.[2]
Propietats químiques
[modifica]Reaccions àcid-base
[modifica]En dissolució aquosa és estable i presenta les característiques d'un àcid fort (pKa = –1,38).[8] Amb l'aigua produeix l'equilibri:
Aquesta ionització augmenta en augmentar la dilució. Si la concentració és 0,1 mol/l la dissociació arriba al 93%, per la qual cosa se'l considera un àcid fort. Malgrat que és un àcid molt fort, pot actuar també com a base en presència d'un àcid més fort, com ara l'àcid perclòric i l'àcid sulfúric , formant el catió nitroni :[5]
Reaccions redox
[modifica]L'àcid nítric, en medi aquós, es comporta, en general, com oxidant. El seu potencial normal de reducció val +0,96 V, essent la semireacció de reducció:
Tant el poder oxidant com la velocitat de reacció augmenten molt en augmentar la concentració a causa de la presència de diòxid de nitrogen i tetraòxid de dinitrogen com a productes de descomposició del pentaòxid de dinitrogen present en les dissolucions concentrades. L'acció oxidant s'incrementa si hi ha excés de diòxid de nitrogen dissolt, és l'àcid nítric fumant.[7]

Si la concentració és menor a 2 mol/l, el poder oxidant és relativament petit. L'àcid concentrat ataca a tots els metalls, amb l'excepció del rodi, iridi, or i platí. L'atac consisteix en la formació de l'òxid del metall i la dissolució d'aquest dins de l'àcid.[7] Amb els metalls menys actius, com ara el plom, l'argent i el coure, redueixen l'àcid nítric concentrat a diòxid de nitrogen:
Amb àcid nítric diluït es forma monòxid de nitrogen:
En la majoria dels casos se solen produir ambdós òxids de nitrogen, essent major la concentració del diòxid quan l'àcid nítric és més concentrat.[5]
Els metalls més actius, com ara el zinc i el ferro, redueixen l'àcid nítric diluït a òxid de dinitrogen :
Si l'àcid està molt diluït, es forma nitrogen i, fins i tot, nitrat d'amoni :[5]
Tanmateix hi ha metalls com l'alumini i el ferro que, en contacte amb l'àcid concentrat, es passiven. Aquest fenomen consisteix en la formació d'una fina capa compacta d'òxid damunt de la superfície del metall que protegeix el seu interior de l'atac de l'àcid.[7]
Si reacciona amb no metalls, es produeixen els oxoàcids de major estat d'oxidació d'aquests, amb despreniment de monòxid de nitrogen o diòxid de nitrogen:[5]
L'àcid nítric també oxida composts. Així el sulfur d'hidrogen i el diòxid de sofre reaccionen segons les reaccions:
La mescla d'àcid nítric i àcid clorhídric en la proporció d'1 mol d'àcid nítric i 3 mol de clorur d'hidrogen es coneix amb el nom d'aigua règia, nom que li donaren els alquimistes perquè és una dissolució que dissol l'or, que consideraven el rei dels elements. En aquesta dissolució reaccionen el clorur d'hidrogen i l'àcid nítric formant-se clor i clorur de nitrosil :
Obtenció
[modifica]L'àcid nítric no es troba habitualment a la naturalesa, excepte en molt petites quantitats a l'aire després d'una tempesta. També se'l troba a l'aire a causa de la contaminació per òxids de nitrogen produïts per combustions de combustibles fòssils (carbó, petroli i gas natural) i posterior reacció amb la humitat de l'aire. Aquest àcid és un dels principals components de la pluja àcida.
Al laboratori
[modifica]L'obtenció d'àcid nítric al laboratori es pot fer mitjançant la reacció del nitrat de sodi amb àcid sulfúric segons la reacció:
És una reacció reversible a temperatures ordinàries, però en escalfar es desprèn àcid nítric en forma de vapor i l'equilibri es desplaça cap a la dreta. Els vapors es condensen en refrigerants refredats amb aigua.[5]
Procediment Ostwald
[modifica]La producció industrial es duu a terme mitjançant el procediment Ostwald, dissenyat pel químic alemany Wilhelm F. Ostwald, premi Nobel de Química el 1909. Aquest procediment es basa en l'oxidació catalítica de l'amoníac i fou emprat extensament a Alemanya durant la Primera Guerra Mundial i després a tot el món.[5]
L'amoníac, procedent del procés de Haber-Bosch o del procés de la cianamida, es mescla amb unes deu vegades el seu volum d'aire, escalfat a uns 600 °C. Aquesta mescla es posa en contacte, durant només un temps de només 0,01 s per impedir la dissociació del monòxid de nitrogen format, amb una reixa de platí, que actua de catalitzador. La reacció és exotèrmica i la temperatura puja fins als 1000 °C. La reacció és:[5]
Posteriorment s'afegeix més aire per refredar la mescla i produir una nova oxidació del monòxid de nitrogen a diòxid de nitrogen :[5]
Finalment es fa reaccionar amb aigua i s'obté àcid nítric i àcid nitrós . Aquest es descompon en diòxid de nitrogen, monòxid de nitrogen i aigua, i es recupera el monòxid de nitrogen que torna a la cambra de reacció. Aquestes reaccions són:[5]
Mètodes d'arc
[modifica]Hi ha diversos mètodes d'arc (de Birkeland-Eyde, de Schönherr i de Pauling) que han caigut en desús i que feien passar una mescla de gasos a través d'una descàrrega elèctrica a uns 3000 °C.
Aplicacions
[modifica]
L'àcid nítric s'empra com a reactiu en diverses síntesis industrials i de laboratori. La major quantitat d'àcid nítric s'empra majoritàriament per produir nitrat d'amoni , que s'empra com adob. Altres aplicacions són l'obtenció de productes orgànics (àcid adípic, isocianats, nitrobenzé…), per a la fabricació d'explosius (nitroglicerina, trinitrotoluè…), per a la producció d'altres adobs, etc.[8]
Una aplicació de l'àcid nítric és la preparació d'un reactiu d'atac per a l'observació al microscopi de l'estructura dels acers. Aquest reactiu s'anomena Nital 4 i està format per quatre parts d'àcid nítric i 96 parts d'alcohol. El procediment consisteix en atacar durant deu segons aproximadament una proveta prèviament polida de l'acer que es vol estudiar.[9]
Perills
[modifica]L'àcid nítric és un potent oxidant molt corrosiu per la qual cosa en contacte amb la pell produeix cremades importants.[8] Si es posa en contacte amb substàncies combustibles com ara llana o trementina, pot iniciar foc i, fins i tot, explosions.[5]
Vegeu també
[modifica]Referències
[modifica]- ↑ 1,0 1,1 1,2 «nítric .xml Àcid nítric». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ 2,0 2,1 2,2 2,3 Kirk-Othmer, 1995-vol 17, p. 38.
- ↑ Babor, Joseph A.; Ibarz Aznárez, José. Química general moderna (en castellà). 7ª, 3ª reimpressió. Barcelona: Marín, S.A., 1965, p. 629. Dipòsit Legal: BI. 2.290-1962.
- ↑ Kent, 1992, p. 1990-1991.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 5,13 Babor, Joseph A.. Química general moderna : una introducción a la química física y a la química descriptiva superior (inorgánica, orgánica y bioquímica). 8{487} ed., reimp. Barcelona: Marín, imp. 1979. ISBN 8471029979.
- ↑ Cox, A. Peter; Riveros, José M. «Microwave Spectrum and Structure of Nitric Acid» (en anglès). The Journal of Chemical Physics, 42, 9, 5-1965, pàg. 3106–3112. DOI: 10.1063/1.1696387. ISSN: 0021-9606.
- ↑ 7,0 7,1 7,2 7,3 Gutiérrez Ríos, Enrique.. Química inorgánica. 2. ed., revisada. Barcelona: Reverté, 1994, ©1984. ISBN 8429172157.
- ↑ 8,0 8,1 8,2 8,3 8,4 PubChem. «Nitric acid» (en anglès). [Consulta: 3 novembre 2019].
- ↑ Apraiz Barreiro, José. Tratamientos térmicos de los aceros (en castellà). 8ª. Bilbao: Patronato de publicaciones de la Escuela técnica superior de ingenieros industriales, 1974, p. 132. ISBN 84-400-7897-8.
Bibliografia
[modifica]- Kirk-Othmer. Kirk-Othmer Encyclopedia of Chemical Technology. Volume 17 (en anglès). Quarta edició. Wiley-Interscience, 1995. ISBN 978-0-471-52686-5.
- Kent, James A. Riegel's Handbook of Industrial Chemistry (en anglès). Novena edició. Springer Science+Business Media, 1992. DOI 10.1007/978-1-4757-6431-4. ISBN 978-1-4757-6433-8.















































