Història de la taula periòdica

La taula periòdica és una ordenació dels elements químics per ordre creixent de nombre atòmic i de manera que queden agrupats els que tenen propietats semblants en les columnes. La taula periòdica actual deriva de la dissenyada pel químic rus Dmitri I. Mendeléiev el 1869, tot i que anteriorment altres científics havien descobert la periodicitat de les propietats però no profunditzaren en el seus descobriments. Les altres propostes més destacades són les tríades de Döbereiner (1829), el cargol tel·lúric de Béguyer de Chancourtois (1862), la llei de les octaves de Newlands (1864, 1865, 1866), la taula d'Odling (1864), la taula de Hinrichs (1864) i la taula de Meyer (1864, 1970). Es tracta d'un descobriment simultani, ja que cap dels autors coneixia els treballs dels altres.
A partir del descobriment de la llei periòdica molts autors han dissenyat centenars de taules periòdiques: planes, en tres dimensions, rectangulars, circulars, en espiral, etc. Actualment la taula periòdica més usada és la de la IUPAC (Unió Internacional de Química Pura i Aplicada) que deriva directament de la de Mendeléiev amb modificacions posteriors com les de Brauner (posició de la sèrie dels lantanoides), Ramsay (grup dels gasos nobles), Werner (separació dels elements de transició o del bloc d) i Seaborg (posició de la sèrie dels actinoides).
Els inicis de la química
[modifica]Robert Boyle, al segle xvii, trencà amb l'alquímia i definí els elements químics com aquelles substàncies que no podien ser descompostes en altres més simples. Per tal d'explicar les lleis ponderals, John Dalton, el 1808 proposà una nova teoria atòmica. Segons aquesta teoria, els elements estaven formats per àtoms, indivisibles i indestructibles, tots iguals entre si, però diferents dels àtoms dels altres elements. La unió dels àtoms donava lloc a la varietat de substàncies conegudes. La ruptura de les unions entre els àtoms per formar noves unions era l'origen de les transformacions químiques.
Conèixer les propietats dels àtoms, i en especial el seu pes, es transformà en la tasca fonamental de la química i, gràcies a les idees d'Amedeo Avogadro i Stanislao Cannizzaro, durant la primera meitat del segle xix, gran part de la labor química consistí a determinar els pesos dels àtoms i les fórmules químiques de molts compostos.
Descobriments de la periodicitat dels elements
[modifica]Les tríades de Döbereiner
[modifica]| Element | Massa molar (g/mol) |
Densitat (g/cm³) |
|---|---|---|
| Clor | 35.45 | 0.0032 |
| Brom | 79.90 | 3.1028 |
| Iode | 126.90 | 4.933 |
| Calci | 40.08 | 1.55 |
| Estronci | 87.62 | 2.54 |
| Bari | 137.33 | 3.594 |
En començar l'any 1829 s'havien descobert només 39 elements químics dels 90 que existeixen a la naturalesa, i el farmacèutic alemany Johann Wolfgang Döbereiner observà que hi havia diversos grups de tres elements químics de propietats semblants, que anomenà tríades, en què la massa atòmica i la densitat d'un d'ells era la mitjana aritmètica dels altres dos.[1] Així, el calci, l'estronci i el bari formaven compostos de composició similar (per exemple, els òxids tenen la mateixa fórmula , i ) i amb propietats similars (sòlids a temperatura ambient, fàcilment oxidables…), i observà que les propietats de l'estronci eren intermèdies entre les del calci i les del bari. Per exemple la massa atòmica de l'estronci val 87,62, un valor quasi igual a la mitjana aritmètica de les masses atòmiques del calci i del bari, que és 88,7:
El mateix passava amb dues tríades de no metalls: sofre, seleni i tel·luri; i clor, brom i iode; i amb els metalls liti, sodi i potassi, a més dels esmentats. També descobrí tríades de metalls, com crom, manganès i ferro, que no són degudes a cap relació de periodicitat. És evident que Döbereiner descobrí la periodicitat dels elements químics però no elaborà cap taula periòdica, no aconseguí relacionar les tríades unes amb les altres, ni profunditzà més en aquesta recerca.[2]
El cargol tel·lúric de Béguyer de Chancourtois
[modifica]
El 1862 s'havien descobert 48 elements químics i el geòleg francès Alexander-Émile Béguyer de Chancourtois publicà[3] un sistema periòdic tridimensional que consistia en els elements ordenats segons les masses atòmiques creixents en una hèlix inscrita en un cilindre que feia una volta cada setze unitats de massa atòmica. L'anomenà vis tellurique (cargol tel·lúric) degut a que l'element tel·luri quedava situat just al mig i tel·luri significa terra.[4] D'aquesta manera, els elements que diferien en setze unitats de massa atòmica, o un múltiple sencer de 16, tenien propietats químiques i físiques semblants i quedaven situats damunt de verticals.
Malauradament, el treball de Béguyer de Chancourtois sortí publicat a la mateixa revista però separat en tres parts i l'editor dels Comptes Rendus oblidà posar els gràfics destruint tota força visual.[2] Posteriorment, el 1863, Béguyer de Chancourtois publicà novament aquest treball personalment,[5] però tingué poca difusió i no aconseguí el ressò suficient, en part perquè no es difongué entre els químics.[2]
Resulta evident que Béguyer de Chancourtois descobrí la periodicitat de les propietats dels elements químics en ordenar-los segons la seva massa atòmica, però no aconseguí donar-la a conèixer i abandonà el seu interès.[2] No fou fins al 1889 que es tingué notícia d'aquesta organització dels elements químics en la conferència Faraday a la Royal Institution de Mendeléiev a Londres, quan aquest la mencionà. Fou divulgat el mateix any gràcies a un article publicat a la revista Nature del químic britànic Philip J. Hartog després d'haver assistit a la conferència de Mendeléiev. Hartog traduí a l'anglès parts del treball de Béguyer de Chancourtois i escriví que les masses atòmiques dels elements semblants complien la relació , on era la massa atòmica d'un element i un nombre sencer.[6]
La llei de les octaves de Newlands
[modifica]
El químic anglès John A.R. Newlands publicà una sèrie de documents, els anys 1864 i 1865, on descrivia un intent de classificar primer 12 elements i després 33. No coneixia l'ordenació de Béguyer de Chancourtois perquè no s'havia difós. Newlands observà que si s'ordenava els elements químics segons la seva massa atòmica calculada per Stanislao Cannizzaro, hi havia propietats físiques i químiques similars que es repetien a intervals de cada vuit elements, que anomenà llei de les octaves per la seva semblança amb la repetició de les notes musicals.[7][8]
El 1866 aconseguí presentar aquest descobriment davant de la Chemical Society of London amb una taula on inclogué fins a 62 elements, ordenats en vuit columnes verticals de set elements i numerats de l'1 al 56 (hi havia 6 parelles que ocupaven el mateix lloc). Aquesta numeració pot considerar-se precursora del nombre atòmic. Però quan ho comparà amb les octaves de la música fou ridiculitzat per alguns dels assistents i després no es publicà la conferència. Newlands, pel seu compte, aconseguí publicar un resum pocs dies després al Chemical News.[9] Queda clar que Newlands descobrí la periodicitat però el seu ordenament contenia problemes que no pogué resoldre, com ara la posició de l'oxigen i del sofre juntament amb el ferro.[10]
La taula d'Odling
[modifica]
William Odling, químic anglès, publicà el 1864[11] una taula periòdica amb 57 elements ordenats segons l'ordre creixent de la massa atòmica. Eren els mateixos anys en què Newlands classificava només 12 elements. Odling havia assistit el 1860 al congrés de Karlsruhe i escoltà les explicacions de Stanislao Cannizzaro sobre les masses atòmiques i la nova manera de calcular-les, així com la definició de molècula.[2]
En aquesta taula, molt semblant a la primera taula que publicà Mendeléiev cinc anys després, Odling també invertí les posicions del tel·luri i del iode per situar-los a la mateixa fila que els elements semblants, deixant el criteri estricte d'ordre creixent de masses atòmiques i deixà buits, però sense indicar que eren llocs que ocuparien elements encara no descoberts. Aquesta taula no tengué ressò entre els químics i Odling no seguí explorant les seves possibilitats.[2]
La taula de Hinrichs
[modifica]Gustavus Hinrich un químic danès emigrat als Estats Units. Quan Bunsen i Kirchhoff publicaren les taules espectrals per a cada element, Hinrichs observà que les freqüències de les línies espectrals eren també múltiples sencers de la diferència més petita. El 1867 publicà[12] una taula periòdica on els elements químics s'ordenaven per ordre creixent de masses atòmiques i es disposaven damunt d'una espiral que creixia amb la massa atòmica. La disposició feia que els elements semblants quedassin alineats en direccions radials.[10]
La taula de Lothar Meyer
[modifica]
L'alemany Julius Lothar Meyer, que havia assistit al congrés de Karslruhe (1860) igual que Mendeléiev i Odling, publicà una primera taula periòdica el 1862 amb només 28 elements. El 1864 publicà el llibre de text Die Modernen Theorien der Chemie, que incloïa la taula periòdica actualitzada amb 50 elements i basada en la seva valència. El 1868, en la 2a edició publicà un taula millorada, deixant llocs buits per elements no descoberts. Tanmateix hi hagué un retard en la publicació i no sortí fins al 1871, quan Mendeléiev ja havia fet pública la seva.[13]
El 1870[14] il·lustrà la periodicitat de les propietats dels elements amb un gràfic on representava el volum atòmic respecte de la massa atòmica, però aquest gràfic no fou inclòs. El 1895, després de la mort de Meyer, es republicà l'article incloent el gràfic. La taula de Meyer sembla més coherent i més precisa que la de Mendeléiev, inclosa la correcta col·locació de mercuri i cadmi, estany i plom i tal·li i bor, cap dels quals Mendeléiev dugué a terme. Tanmateix Meyer no realitzà prediccions de nous elements ni suggerí correccions de masses atòmiques com les de Mendeléiev.[2][15]
La taula periòdica de Mendeléiev
[modifica]La taula periòdica de 1869
[modifica]
Després d'esdevenir professor de la Universitat Imperial de Sant Petersburg, Dmitri I. Mendeléiev necessitava un llibre de text per a les seves classes, que anomenà Principis de química. Quan havia de descriure els elements químics, intentà cercar un ordre amb una lògica i descobrí la llei periòdica.[16][17] Abans de la publicació, que fou entre 1868 i 1871, Mendeléiev escriví un breu resum de només una pàgina que duia per títol Assaig d'un sistema dels elements basat en les seves masses atòmiques i en les analogies químiques, que distribuí entre els químics russos a principis del 1869. El 6 de març de 1869, Mendeléiev en fe una presentació formal davant la Societat Química de Rússia, que duia per títol Sobre la correlació entre els elements i les seves masses atòmiques, on explicà la seva llei periòdica i que fou llegida pel químic Nikolai Menxutkin i publicada en rus en el primer número de la nova revista de la societat[18] (Jurnal Rússkogo Fíziko-Khimitxéskogo Obsxestva).[19] Amb l'objectiu de difondre-la entre els químics d'altres països, n'envià dos resums a les revistes alemanyes Journal für praktische Chemie i Zeitschrift für Chemie.[18] En la seva taula:

- Ordenà els elements segons les masses atòmiques creixents, iniciant noves columnes per fer coincidir elements amb propietats físiques i químiques semblants a les línies,[20] com ara els halògens F, Cl, Br i I, o els alcalins Li, Na, K, Rb i Cs. Per aconseguir-ho, hagué de posar un nombre diferent d'elements a cada fila.
- Observà que hi havia elements amb propietats semblants que tenien masses atòmiques similars. Així, descobrí tres grups de tres elements (platí, iridi i osmi; rodi, ruteni i pal·ladi; ferro, cobalt i níquel), cadascun amb propietats semblants i masses atòmiques iguals o quasi iguals:
- Pt (197,4), Ir (198) i Os (199)[20]
- Rh i Ru (104,4) i Pl, ara Pd (106,6)
- Fe (56), Co i Ni (59)
- Descobrí que hi havia altres grups d'elements de propietats semblants les masses atòmiques dels quals augmentaven amb regularitat. Per exemple, en els següents tres grups d'elements (potassi, rubidi i cesi; sofre, seleni i tel·luri; fòsfor, arsènic i antimoni), observà que la massa atòmica dels més pesats eren unes 46 unitats més grans que els immediatament inferiors:
- K (39), Rb (85,4 = 39 + 46,4), Cs (133 = 85,4 + 47)[20]
- S (32), Se (79,4 = 32 + 47,4), Te (128 = 79,4 + 48,6)
- P (31), As (75 = 31 + 44), Sb (122 = 75 + 47)
- Observà que els elements quedaven ordenats segons la seva valència superior i que els elements d'una mateixa fila tenien la mateixa valència. Per exemple, els elements consecutius liti, beril·li, alumini, silici, fòsfor, sofre i clor tenien les valències més altes, que creixien amb una unitat: Li (I), Be (II), Al (III), Si (IV), P (V), S (VI), Cl (VII);[20] o les més baixes, que augmentaven fins al Si per després disminuir d'unitat en unitat: Na (I), Mg (II), Al (III), Si (IV), P (III), S (II), Cl (I).
- S'adonà que els elements més abundants a la naturalesa eren els que tenien les masses atòmiques més baixes.[20]
- Indicà que les propietats dels elements venen determinades per la magnitud de la massa atòmica. Encara que el comportament químic dels elements semblants era similar, no era idèntic: hi havia diferències a causa de la divergència en la massa atòmica. Per exemple, el clor i el iode formaven compostos amb un àtom d'hidrogen: HCl i HI. Aquests eren similars i, per exemple, tots dos eren gasos corrosius i es dissolien fàcilment en aigua. Però es diferenciaven en el fet que l'HI tenia, per exemple, uns punts d'ebullició i de fusió més alts que l'HCl (típic dels compostos semblants amb més massa atòmica).[20]

Segell commemoratiu soviètic del centenari de la taula periòdica (1969) - Observà que perquè tots els elements quedassin ordenats calia deixar alguns buits, fet que suposà que eren llocs corresponents a elements químics encara no descoberts i als quals assignà una massa atòmica i en predigué les masses atòmiques. Els elements predits foren: eka-alumini (68), eka-silici (70), eka-bor (45) i 180.[20] Mendeléiev utilitzà el prefix eka, que en sànscrit significa 'un', en el sentit que l'element es troba una posició per sota del que s'anomena.[21] L'elecció d'aquest prefix, i també dvi i tri ('dos' i 'tres' en sànscrit) posteriorment per altres cinc elements, és degut a l'admiració que tenia Mendeléiev vers la gramàtica de Pànini, un gramàtic indi del segle v aC, en la qual hi ha una organització dels sons semblant a la seva taula periòdica.[22]
- Descobrí que hi havia masses atòmiques errades a causa de valències errònies. Per exemple, la massa atòmica del beril·li (Be) no podia ser 13,7, com es pensava, perquè hauria de ser un element semblant al nitrogen (N) i al fòsfor (P). Com que s'assemblava més al magnesi (Mg), la seva massa atòmica havia de ser 9,4, ja que el seu òxid seria BeO i no Be₂O3, com se suposava. Un altre exemple era la massa atòmica del tel·luri (Te), que havia de valer entre 123-126 i no pas 128, perquè les propietats indicaven que la seva massa atòmica havia de ser menor que la massa atòmica del iode (I).[20] En aquest cas no era un error perquè, com es demostrà posteriorment, l'ordenació no havia de ser segons l'ordre creixent de les masses atòmiques sinó del nombre atòmic , descobert el 1913 per Henry G. J. Moseley.[23]
- Amb l'ordenació dels elements químics indicà que es podien deduir semblances entre elements que no s'havien descobert experimentalment. Com a exemple, posà el cas de l'urani (Ur, ara U), que havia de tenir semblances amb el bor (B) i l'alumini (Al). Tanmateix l'U estava mal situat, ja que la seva massa atòmica estava mal calculada.[20]
La taula periòdica de 1871
[modifica]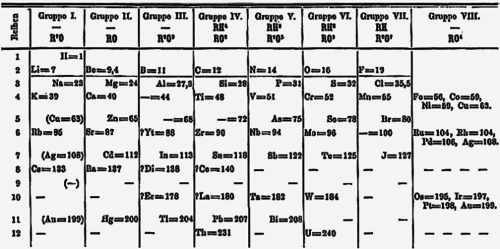
El 1871 publicà un article en rus amb una nova taula, article que traduí a l'alemany i fou publicat l'any següent.[24] En aquesta nova taula posà els períodes en files i els grups en columnes que anomena amb nombres romans de l'I al VIII. Encapçalà els grups amb la fórmula de l'òxid de més valència; i també amb la dels hidrurs a partir del grup IV. Dividí cada període (fila) en dos, de manera que quedassin dins del mateix grup elements que abans estaven separats però que fins feia pocs anys encara figuraven a la taula periòdica amb el mateix nom de grup. Per exemple, al grup I hi havia dos subgrups: liti (Li), potassi (K), rubidi (Rb) i cesi (Cs), per una part, i hidrogen (H), sodi (Na), coure (Cu), argent (Ag) i or (Au), per una altra. Passava igual amb tots els grups excepte el VIII.[25][24]
Corregí moltes masses atòmiques que estaven mal calculades perquè els elements tenien assignades valències incorrectes. Així, l'indi (In) se suposava divalent (amb valència II) i amb massa atòmica 75,5, però no hi havia lloc per posar-lo entre l'arsènic (As) i el seleni (Se); i és un metall. Mendeléiev pensà que seria trivalent, amb la qual cosa la massa atòmica seria 113 (valor actual, 115), i quedaria en la columna de l'alumini (Al) i de l'eka-alumini. Un altre cas era el de l'urani (U), que s'assembla al crom (Cr), al molibdè (Mo) i al tungstè (W), per això no podia ser divalent sinó que havia de ser tetravalent i li corresponia una massa atòmica de 240 (el valor actual és de 238). Altres masses atòmiques que corregí seguint aquests raonaments foren: erbi (Er) 56 → 178 (incorrecte); lantani (La) 94 → 180 (incorrecte); tori (Th) 118 → 231 (actual 232); ceri (Ce) 92 → 140 (actual); itri (Y) 60 → 88 (actual 88,9)...[26]
Per altra banda, suposà que hi havia masses atòmiques que s'havien determinat erròniament per manca de precisió experimental, com la de l'osmi (Os), 199; la de l'iridi (Ir), 198; la del platí (Pt), 197,4; i la de l'or (Au), 197. Els ordenà de forma inversa segons les propietats de cadascun. Noves dades confirmaren la seva teoria: Os (190), Ir (192), Pt (195) i Au (197).[26]
Dubtà de les posicions del coure (Cu), l'argent (Ag) i l'or (Au), que situà als grups I i VIII al mateix temps. El grup VIII estava format per subgrups de tres elements: Fe, Co i Ni; Ru, Rh i Pd; i Os, Ir i Pt.[26]
Identificà el lantani (La) amb l'element desconegut de massa atòmica 180 (actualment el hafni, Hf), per la qual cosa el situà erròniament. Al seu lloc hi posà l'element Di (didimi), que posteriorment es descobrí que era una mescla de praseodimi (Pr), neodimi (Nd) i samari (Sm). Tanmateix, sí que deixà lloc per a situar-hi els lantanoides o terres rares, que encara no s'havien descobert, però mal ubicats. També deixà cinc llocs per als elements transurànids no descoberts (Np, Pu, Am, Cm i Bk), amb massa atòmica superior a la de l'urani (U), i per a altres elements que es descobririen amb posterioritat: Tc, Re, Po, At, Fr, Ra, Ac i Pa, a més dels ja indicats a la taula periòdica del 1869: escandi (Sc), gal·li (Ga) i germani (Ge). En total, 31 llocs buits per a elements encara no descoberts el 1871.[26]
Nous grups d'elements
[modifica]El grup dels gasos nobles
[modifica]
El químic escocès William Ramsay i els seus col·laboradors descobriren els gasos nobles, que no havien sigut previstos per Mendeléiev, ja que no se n'havia descobert cap el 1869. L'heli el descobrí el 1894 amb l'ajuda de Per T. Cleve, l'argó juntament amb Lord Rayleigh el 1895, i els altres gasos inerts juntament amb Travers. Per ubicar-los amb la resta d'elements coneguts, Ramsay proposà la creació d'un nou grup en una nova columna, aleshores el grup zero.[27] La incorporació dels nous elements no fou fàcil i Mendeléiev no acceptà inicialment que els elements que no formaven compostos s'incloguessin a la seva taula periòdica. Bohuslav Brauner, professor de química inorgànica i química analítica a la Universitat de Praga i amic de Mendeléiev, publicà el 1902[28] una taula periòdica amb els gasos nobles i, finalment, la proposta de Ramsay fou acceptada per Mendeléiev que l'inclogué en les darreres versions que publicà de la seva taula.
La posició del lantanoides
[modifica]El descobriment dels elements anomenats lantanoides s'inicià el 1803 amb el descobriment del ceri i anà augmentant a finals del segle xix. Era un conjunt d'elements difícils d'encaixar en la taula periòdica perquè tots tenien propietats molt semblants a l'itri i al lantani. El químic txec Bohuslav Brauner, el 1882 ubicà els lantanoides juntament amb la resta d'elements aparellant-los com ho feia Mendeléiev.[29] El 1902 publicà una nova versió de la seva taula periòdica on separà de la resta d'elements als lantanoides, que els posà ocupant una única casella amb onze elements.[28]
El nombre atòmic
[modifica]Antonius Johannes van den Broek, advocat i físic aficionat holandès, el 1907 observà que el número d'ordre d'un element químic a la taula periòdica, ordenats per ordre creixent de masses atòmiques, és igual a la seva massa atòmica dividida per 2.[30] El 1911 Ernest Rutherford descobrí del nucli atòmic i, en una carta enviada a la revista Nature[31] poques setmanes després, van den Broek formulà la hipòtesi que el nombre de la posició d'un element a la taula periòdica es corresponia amb la càrrega elèctrica del seu nucli atòmic en unitats elementals de càrrega, i que la massa atòmica era propera al doble d'aquest nombre atòmic. Però Rutherford no li donà suport perquè no era un científic professional, ja que era advocat de professió. En veure l'oposició de Rutherford, van den Broek abandonà en una carta a Nature el 1913 la relació amb la massa atòmica i mantingué que el número d'ordre a la taula periòdica es corresponia amb el nombre de càrregues elementals del nucli atòmic.[32] Poques setmanes després el químic anglès Frederik Sodyy, que havia treballat amb Rutherford, publicà una carta a la mateixa revista indicant que les idees de van den Broek aclarien les lleis de desplaçament radioactiu (lleis de Soddy-Fajans)[33] i Rutherford canvià d'opinió i acceptà la hipòtesi de van den Broek.[34] El mateix 1913 el físic anglès Henry Moseley estudià l'espectre de raigs X dels àtoms i comprovà que hi havia una relació lineal entre el número d'ordre dels elements a la taula periòdica i l'arrel quadrada de la longitud d'ona d'aquests raigs, confirmant la hipòtesi de van den Broek i l'anomenà nombre atòmic.[23][35]
Evolució de la taula periòdica durant el segle XX
[modifica]Moltes versions de taules periòdiques es publicaren durant la primera meitat del segle xx. Algunes en forma de cercles, altres en forma d'espiral o de figures més complexes. De tots els formats el que fou més acceptat fou el de taula rectangular, seguint l'estil de Mendeléiev, però desdoblant les caselles que contenien dos elements.
La taula de Werner
[modifica]
El 1905 el químic suís Alfred Werner publicà una versió extrallarga de la taula periòdica amb 33 columnes i 8 files. En aquesta taula se separen les parelles d'elements que Mendeléiev posava en moltes de les seves caselles i també els lantanoides. És la primera taula periòdica on apareix el bloc d dels metalls de transició de l'actual taula periòdica.[36] Destaca, a més de la separació dels elements del bloc d dels del bloc s i p, de la representació del bloc f, amb els lantanoides coneguts i deixant una fila amb buits pels actinoides, dels quals encara només s'havien descobert l'actini, el tori i l'urani. També situà el grup dels gasos nobles en una columna a la dreta de la seva taula, tal com se situen en l'actualitat, segons la proposta feta el 1904 per Ramsay.[36][37]
Werner suposà erròniament que existien tres elements abans de l'hidrogen i un entre ell i l'heli; separà erròniament els elements beril·li i magnesi de la resta d'alcalinoterris, els quals formaven part dels metalls de transició i ubicà malament alguns elements (neodimi abans que praseodimi, urani sota l'europi, actini sota el tuli).[37]
La taula de Deming
[modifica]
El químic estatunidenc Horace G. Deming, en el seu llibre General Chemistry del 1923, emprà una taula periòdica llarga (de files amb un màxim de 18 caselles) amb una numeració que emprava números romans i designà els primers dos i els darrers cinc grups principals (actuals blocs s i p) amb la notació A (d'esquerra a dreta grups IA, IIA, IIIA, IVA, VA, VIA, VIIA i VIIIA) i els grups dels metalls de transició (actual bloc d) amb la notació B (d'esquerra a dreta IIIB, IVB, VB, VIB, VIIB, VIII, IB, IIB). Escollí la numeració dels grups de manera que els òxids característics dels grups B corresponien amb els dels grups A i, per aquesta raó, la numeració no va seguida d'esquerra a dreta. Els grups del ferro, cobalt i níquel no els designà ni A ni B, i els agrupà tots en el grup VIII. El grup dels gasos nobles els situà originàriament al costat esquerre de la taula periòdica, anomenant-lo grup 0, però posteriorment el passà a la dreta i l'etiquetà com Grup VlllA. per altra banda els lantanoides estan situats fora de la taula, indicant-se que haurien d'estar situats entre els grups IIIA i IVB.[37] Aquesta notació de grups es mantingué a la majoria de llibres de text i taules periòdiques publicades fins ben entrat el segle xxi quan es generalitzà la nova notació aprovada per la IUPAC el 1988.[38]
La taula de Janet
[modifica]
Charles Janet fou un enginyer francès afeccionat a la ciència que publicà diferents versions de taules periòdiques basades en la configuració electrònica dels àtoms segons l'establiment de la quantització de les òrbites electròniques establerta per Niels Bohr. La versió més clara és la tercera que publicà el 1929 i que deriva d'una ordenació helicoidal que desplegà i representà plana. L'anomenà "taula escalonada a l'esquerra". En ella apareixen clarament els quatre blocs actuals de la forma extrallarga, això és, amb els lantanoides i actinoides integrats i amb fileres de fins a 32 caselles. L'única diferència és que el bloc actual s el situà a la dreta[39]
La taula de Seaborg
[modifica]El 1934 Harvey Elliot White publicà una versió de taula periòdica al seu llibre Introduction to Atomic Spectra,[40] quasi igual a la taula periòdica actual excepte en la posició de l'heli, que el col·locà damunt del beril·li i no amb els gasos nobles, perquè comparteixen estructura electrònica. En un document intern, anomenat XBL 769-10601, del Laboratori Nacional Lawrence de Berkeley, datat el 1939, apareix una taula periòdica d'estructura quasi igual a la de White però incloent ja els elements transurànics recentment sintetitzats, situats amb la resta d'elements del bloc d al 7è període.[41] En la dècada dels 1940 Glenn T. Seaborg que havia sintetitzat bona part dels transurànics, proposà separar-los en una sèrie semblant a la dels lantanoides, la sèrie dels actinoides. Ambdues sèries les disposà en dues fileres sota de la taula periòdica amb els blocs s, d i p.[42][43]
La taula de la IUPAC
[modifica]
A finals del segle XX la IUPAC s'encarregà de publicar les versions oficials de la taula periòdica, així com donar nom als nous elements químics que s'anaven sintetitzant. Completada la sèrie dels actinoides els nous elements anaren situant-se al període setè, a la part inferior dels blocs d i p, en aquest ordre. La taula més habitual és la llarga, amb files d'un màxim de 18 caselles i el bloc f separat a la part inferior.[44]
El 1988 recomanà nomenar els grups d'elements (columnes) simplement amb els números de l'1 al 18, des de l'esquerra.[38] També la IUPAC considerà que s'havien d'abandonar els noms lantànids i actínids, que signifiquen "com el lantani" i "com l'actini" respectivament, i que no incloïen ni el lantani ni l'actini, pels noms lantanoides i actinoides, grups que contenen el lantani i l'actini. Queda oberta la qüestió de quins elements s'han de situar al grup 3: Sc, Y, Lu i Lr, o Sc, Y, La i Ac.[45]
Enllaços externs
[modifica]- The internet database of periodic tables
- Setting the Table. A brief visual history of the periodic table
Referències
[modifica]- ↑ Döbereiner, J.W. «Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie». Annalen Der Physik, 91, 2, 1829, pàg. 301-307.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Scerri, E.R. «El descubrimiento de la tabla periódica como un caso de descubrimiento simultáneo» (en castellà). Epistemología e Historia de la Ciencia, 1, 2, 26-06-2017, pàg. 82–97. ISSN: 2525-1198.
- ↑ Béguyer de Chancourtois, A.E. «Sur un classement naturel des corps simples ou radicaux appelé 'vis tellurique'». Compes Rendus de l'Académie des Sciences, 54, 1862, pàg. 757–761, 840–843, 967–971.
- ↑ Touret, Jacques «Dans l'ombre de ses maîtres: Alexandre-Eugène Béguyer de Chancourtois (1820-1886)». Travaux du Comité français d'Histoire de la Géologie, 3ème série, tome 20, 1-2006, pàg. 61–73.
- ↑ De Charcourtois, A.E.B.. Vis tellurique: Classement des Corps Simples ou Radicaux, Obtenu au Moyen d'un Système de Classification Hélicoïdal et Numérique (en francès). París: Mallet-Bachelier, 1863.
- ↑ Hartog, P. J. «A First Foreshadowing of the Periodic Law» (en anglès). Nature, 41, 1052, 01-12-1889, pàg. 186–188. DOI: 10.1038/041186a0. ISSN: 1476-4687.
- ↑ Newlands, John A. R. «On Relations Among the Equivalents». Chemical News, 10, 20-08-1864, pàg. 94–95.
- ↑ Newlands, John A. R. «On the Law of Octaves». Chemical News, 12, 18-08-1865, pàg. 83.
- ↑ Newlands, J.A.R. «Extract from the report of the meeting of the Chemical Society, March 1st, 1866». Chemical News, 13, 09-03-1866, pàg. 113.
- ↑ 10,0 10,1 Scerri, Eric R.. A tale of seven elements. Oxford University Press, 2013. ISBN 9780199875030.
- ↑ Odling, W «On the proportional numbers of the elements». Quarterly Journal of Science, 1, 1864, pàg. 642–648.
- ↑ Hinrichs, G.D. Programm der Atomechanik oder die Chemie eine Mechanic de Pantome. Iowa City: Augustus Hageboek, 1867.
- ↑ Ruipérez, León Garzón. De Mendeleiev a los superelementos: un estudio crítico de la ley periódica y una formulación de su estructura (en castellà). Universidad de Oviedo, 1988. ISBN 9788474681680.
- ↑ Meyer, J.L. «Die Natur der Chemischen Elemente als Function ihrer Atomgewichte». Justus Liebig's Annalen der Chemie, Supplementband 7, 1870, pàg. 354–364.
- ↑ van Spronsen, Johannes W. «The priority conflict between Mendeleev and Meyer» (en anglès). Journal of Chemical Education, 46, 3, 3-1969, pàg. 136. DOI: 10.1021/ed046p136. ISSN: 0021-9584.
- ↑ «A brief history of the development of the period table». Western Oregon University.
- ↑ «Mendeleev and the Periodic Table» (.doc). chemsheets.co.uk. Arxivat de l'original el 2023-10-31 [Consulta: 9 maig 2019].
- ↑ 18,0 18,1 Mendeléiev, D.I.. William B. Jensen. Mendeleev on the periodic law: selected writings, 1869-1905 (en anglès). Mineola, N.Y.: Dover Publications, 2005. ISBN 0486445712.
- ↑ Mendeléiev, D.I. «Соотношение свойств с атомным весом элементов (Sobre la Correlació entre les Propietats dels Elements i les seves Masses Atòmiques)» (en rus). Jurnal Rússkogo Fíziko-Khimitxéskogo Obsxestva, 1, 1869, pàg. 60-77.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 20,6 20,7 20,8 Mendeléiev, D.I. «Üeber die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente». Zeitschrift für Chemie, 12, 1869, pàg. 405-406.
- ↑ Stewart, Philip J. «Mendeleev’s predictions: success and failure» (en anglès). Foundations of Chemistry, 21, 1, 01-04-2019, pàg. 3–9. DOI: 10.1007/s10698-018-9312-0. ISSN: 1386-4238.
- ↑ Kak, S. «Mendeleev and the Periodic Table of Elements» (en anglès), 2004. [Consulta: 3 maig 2019].
- ↑ 23,0 23,1 Moseley, H.G.J. «XCIII. The high-frequency spectra of the elements» (en anglès). The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 26, 156, 12-1913, pàg. 1024–1034. DOI: 10.1080/14786441308635052. ISSN: 1941-5982.
- ↑ 24,0 24,1 Mendeléiev, D.I. «Die periodische Gesetzmässigkeit der chemischen Elemente». Annalen der Chemie und Pharmacie, Supplement 8, 1872, pàg. 133-229.
- ↑ Mendeléiev, D.I. Dmitrii Mendeleev, Zhurnal Russkoe Fiziko-Khimicheskoe Obshchestvo 3, 25 (1871), 3, 1871, pàg. 25.
- ↑ 26,0 26,1 26,2 26,3 «Mendeleev's First Periodic Table» (en anglès). Elements and Atoms. Giunta, C.. [Consulta: 5 abril 2019].
- ↑ Ramsay, William «An Undiscovered Gas». Science, 6, 144, 1897, pàg. 493–502. ISSN: 0036-8075.
- ↑ 28,0 28,1 Brauner, Bohuslav «Über die Stellung der Elemente der seltenen Erden im periodischen System von Mendelejeff» (en anglès). Zeitschrift für anorganische Chemie, 32, 1, 1902, pàg. 1–30. DOI: 10.1002/zaac.19020320102. ISSN: 1521-3749.
- ↑ Brauner, B. «XIII.—Contributions to the chemistry of rare earth-metals» (en anglès). Journal of the Chemical Society, Transactions, 41, 0, 01-01-1882, pàg. 68–79. DOI: 10.1039/CT8824100068. ISSN: 0368-1645.
- ↑ van den Broek, A.J. «Das α-Teilchen und das periodische System der Elemente». Annalen der Physik, 4, 23, 1907, pàg. 199–203.
- ↑ Van Den Broek, A. «The Number of Possible Elements and Mendeléff's “Cubic” Periodic System» (en anglès). Nature, 87, 2177, 7-1911, pàg. 78. DOI: 10.1038/087078b0. ISSN: 1476-4687.
- ↑ Van Der Broek, A. «Intra-atomic Charge» (en anglès). Nature, 92, 2300, 11-1913, pàg. 372–373. DOI: 10.1038/092372c0. ISSN: 1476-4687.
- ↑ Soddy, Frederick «The Structure of the Atom» (en anglès). Nature, 92, 2303, 12-1913, pàg. 452. DOI: 10.1038/092452c0. ISSN: 1476-4687.
- ↑ Kumar, Manjit.. Quántum : Einstein, Bohr y el gran debate sobre la naturaleza de la realidad. 2a ed. Barcelona: Editorial Kairos, 2012. ISBN 9788472459014.
- ↑ Moseley, H.G.J. «LXXX. The high-frequency spectra of the elements. Part II» (en anglès). The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 27, 160, 4-1914, pàg. 703–713. DOI: 10.1080/14786440408635141. ISSN: 1941-5982.
- ↑ 36,0 36,1 Constable, Edwin C. «Evolution and understanding of the d-block elements in the periodic table» (en anglès). Dalton Transactions, 08-03-2019. DOI: 10.1039/C9DT00765B. ISSN: 1477-9234.
- ↑ 37,0 37,1 37,2 «Periodic Table Database | Chemogenesis». [Consulta: 13 maig 2019].
- ↑ 38,0 38,1 Fluck, E. «New notations in the periodic table». Pure and Applied Chemistry, 60, 3, 01-01-1988, pàg. 431–436. DOI: 10.1351/pac198860030431. ISSN: 1365-3075.
- ↑ Janet, C. «The Helicoidal Classification of the Elements». Chemical News, 8, 1929, pàg. 388-393.
- ↑ White, Harvey Elliott. Introduction to Atomic Spectra (en anglès). Nova York and London: McGraw-Hill Book Company inc., 1934.
- ↑ «Periodic Table Database | Chemogenesis». [Consulta: 20 maig 2019].
- ↑ Seaborg, G. T. «The Transuranium Elements» (en anglès). Science, 104, 2704, 25-10-1946, pàg. 379–386. DOI: 10.1126/science.104.2704.379. ISSN: 0036-8075.
- ↑ Seaborg, G. T. «Place in periodic system and electronic structure of the heaviest elements». Nucleonics, 5, 5, 11-1949, pàg. 16–36. ISSN: 0096-6207. PMID: 15391285.
- ↑ «Periodic Table of Elements» (en anglès). IUPAC. [Consulta: 20 maig 2019].
- ↑ «Which Elements Belong in Group 3 of the Periodic Table?». Chemistry International, 38, 2, 01-01-2016. DOI: 10.1515/ci-2016-0213. ISSN: 1365-2192.









