Interleucina-6

La interleucina-6 (IL-6) és una glicoproteïna que actua com a citocina proinflamatòria i com a miocina antiinflamatòria, paper que està mediat pels seus efectes inhibidors sobre la TNF-alfa i la IL-1, i l'activació del IL-1ra i la IL-10. En els éssers humans, està codificat pel gen IL6 situat al braç curt del cromosoma 7 (8,9,17).
Té un paper important en diferents funcions biològiques com la inflamació, el metabolisme via patogènesis de malalties metabòliques i cardiovasculars, la immunoregulació i la hematopoiesis, pel que una disminució dels seus nivells es pot associar amb una defensa insuficient davant de diversos patògens. També es considera fonamental en el pas de la immunitat innata a l'adaptativa. Aquesta interleucina és secretada per diferents cèl·lules com són els limfòcits T i B per a que actuï com a mediador de la proliferació, diferenciació, activació i supervivència cel·lular, i per cèl·lules parenquimàtiques com les endotelials, els queratinocits, els adipòcits i les cèl·lules mesangials, com a resposta innata a través de receptors de reconeixement de patrons.[5] També és secretada pels monòcits, els fibroblasts on estimula la producció de col·lagen, els sinoviocits, algunes cèl·lules tumorals, els osteoblasts, per a estimular a formació i la diferenciació dels osteoclasts, i cèl·lules del múscul llis com a citocina proinflamatòria. A més, unes altres de les seves funcions són la modulació de la producció de proteïnes de fase aguda i l'activació de l'endoteli vascular. La seva producció pot ser desencadenada per diferents factors com són una infecció viral, algun traumatisme, o la presència d'altres citocines.
La IL-6 inicialment va ser identificada com un factor de diferenciació i maduració de limfòcits B però s'ha descobert que presenta funcions tant antiinflamatòries com proinflamatorias que es distingeixen per diferents cascades de transducció de senyalització anomenades senyalització clàssica i trans-senyalització. Per aquest motiu, té un paper bastant important en malalties de caràcter autoimmune i inflamatòries ja que una sobreproducció d'aquesta en pot ser la causant, per la qual cosa és necessari mantenir els seus nivells regulats. També, és un factor de creixement per a hibridomes i plasmocitomes.
Existeix alguna evidència preliminar que la IL-6 es pot usar com a marcador inflamatori per a la infecció greu per COVID-19 amb un pronòstic precari, en el context d'una pandèmia més àmplia de coronavirus.
Funció
[modifica]És un pirogen endogen que estimula la producció d'ACTH per part de la hipòfisi. Aquesta citosina exerceix diferents accions hematològiques (intervé en la producció d'immunoglobulines, en la diferenciació de limfòcits B, activa els limfòcits T citotòxics, cèl·lules plasmàtiques, modul·la l'hematopoesi, etc...), immunològiques, en el fetge (com la síntesi de proteïnes de fase aguda, especialment fibrinogen),[6] endocrinològiques i metabòliques. Encara que la interleucina-6 es considera principalment una citocina proinflamatoria, existeixen nombrosos exemples de funcions protectores i regeneratives d'aquesta citocina.[7]
Sistema immunitari
[modifica]La IL-6 és secretada per macròfags en resposta a molècules microbianes específiques, denominades patrons moleculars associats a patògens (PAMP). Aquests PAMP s'uneixen a un grup important de molècules de detecció del sistema immunològic innat, anomenats receptors de reconeixement de patrons (PRR), inclosos els receptors tipus Toll (TLR). Aquests estan presents en la superfície cel·lular i en els compartiments intracel·lulars i indueixen cascades de senyalització intracel·lular que donen lloc a la producció de citocines inflamatòries. La IL-6 és un mediador important de la febre i de la resposta de fase aguda.
La IL-6 és responsable d'estimular la síntesi de proteïnes de fase aguda, així com la producció de neutròfils en la medul·la òssia. Dona suport al creixement de les cèl·lules B i és antagonista de les cèl·lules T reguladores.
Metabolisme
[modifica]És capaç de creuar la barrera hematoencefàlica [8] i iniciar la síntesi de PGE2 en l'hipotàlem, canviant així el punt d'ajustament de la temperatura corporal. En el teixit muscular i gras, la IL-6 estimula la mobilització d'energia que condueix a un augment de la temperatura corporal. A 4 graus Cº, tant el consum d'oxigen com la temperatura central van ser menors en IL-6 - / - en comparació amb els ratolins de tipus salvatge, la qual cosa suggereix una menor termogénesis induïda per fred en ratolins IL-6-/- (Wernstedt I, Edgley A, Berndtsson A, Fäldt J, Bergström G, Wallenius V, Jansson JO. Reducció de l'augment de la despesa energètica induïda per l'estrès i el fred en ratolins amb deficiència d'interleucina-6).
La IL-6 també és produïda pels adipòcits i es creu que és una raó per la qual els individus obesos tenen nivells endògens més alts de PCR.[9] La IL-6 pot exercir una supressió tònica del greix corporal en ratolins madurs, atès que l'eliminació del gen de la IL-6 causa obesitat d'inici madur.[10][11][12] A més, la IL-6 pot suprimir la massa de greix corporal a través d'efectes a nivell del SNC.[10] L'efecte antiobesidad d'IL-6 en rosegadors s'exerceix a nivell del cervell, presumiblement l'hipotàlem i el romboencèfal.[13][14][15] D'altra banda, la trans-senyalització d'IL-6 central millorada pot millorar l'homeòstasi de l'energia i la glucosa en l'obesitat.[16] La senyalització trans implica que una forma soluble d'IL-6R (sIL-6R), que comprèn la porció extracel·lular del receptor, pot unir-se IL-6 amb una afinitat similar a la IL-6R unida a la membrana. El complex d'IL-6 i sIL-6R pot unir-se a gp130 en cèl·lules que no expressen IL-6R i que no responen a IL-6.[16]
Els estudis en animals d'experimentació indiquen que la IL-6 en el SNC regula en part la supressió de la ingesta d'aliments i el pes corporal exercit per l'estimulació del receptor del pèptid 1 similar al glucagó (GLP-1).[17]
Fora del SNC, sembla que la IL-6 estimula la producció de GLP-1 en el pàncrees endocrí i l'intestí.[18] La amilina és una altra substància que pot reduir el pes corporal i que pot interactuar amb la IL-6. La producció d'IL-6 induïda per amilina en l'hipotàlem ventromedial (VMH) és un possible mecanisme pel qual el tractament amb amilina podria interactuar amb la senyalització de leptina VMH per a augmentar el seu efecte sobre la pèrdua de pes.[19]
Sistema nerviós central
[modifica]En el sistema nerviós, la IL-6 és important en la fisiologia de la nocicepción i en la fisiopatologia del dolor perquè, sembla ser un dels estimulants més poderosos de l'eix hipotalàmic-hipofisiari-suprarenal dels éssers humans. La seva administració subcutània a voluntaris sans porta a una hipertròfia de les glàndules suprarenals mediada per l'augment en la producció d'hormona adrenocorticotropa (ACTH).[20] Per via intranasal millora la consolidació dels records emocionals associada al somni[21]
Hi ha indicis d'interaccions entre GLP-1 i IL-6 en diverses parts del cervell. Un exemple són els nuclis parabraquials de la protuberància, on el GLP-1 augmenta els nivells d'IL-6 [22][23] i on la IL-6 exerceix un marcat efecte contra l'obesitat.[24]
Estructura
[modifica]
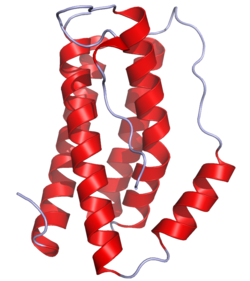
La interleucina-6 humana és una glicoproteïna petita que pertany a la classe de citocines de quatre hèlixs, amb un pes molecular que oscil·la entre 21 i 28 kilodalton, segons el grau de glicosilació, i té 184 aminoàcids.
Consisteix en un homodímer, i cada subunitat forma un domini globular amb quatre alfa-hèlixs, és a dir, un cabdell estabilitzat per ponts disulfur intramoleculars.
El receptor de la interleucina-6, situat en la membrana de la cèl·lula diana, forma un complex amb aquesta. Està format per una proteïna d'unió a citocines i una subunitat per a transducció de senyals, que és el receptor de senyalització glicoproteïna 130 kDa (gp130). Aquest es dimeriza i inicia la senyalització intracel·lular. Ambdues són de la família del receptor de citocines de tipus I. Aquest receptor exhibeix un patró d'expressió altament definit i en gran manera confinat a uns certs tipus cel·lulars com els monòcits/macròfags, alguns leucòcits i els hepatòcits.[25]
Senyalització
[modifica]
La interleucina-6 transmet senyals a partir de dos mecanismes diferents: la senyalització clàssica o en cis i la senyalització en trans. Això permet que la IL-6 interactui amb cèl·lules que expressen o no el receptor que s'uneix a la membrana de la IL-6.
La senyalització clàssica o en cis consisteix en el fet que la IL-6 s'uneix al receptor d'aquesta, és a dir, al IL-6R i, es forma un complex que s'uneix a la glicoproteïna gp130 i s'inicia la senyalització, que es relaciona amb els seus efectes antiinflamatoris [26]
No obstant això, en efectes inflamatoris podem trobar en la sang un augment del receptor soluble de IL-6 (sIL-6R),[27] que es pot unir a la IL-6 circulant i interaccionar amb aquest complex (Il-6+ sIL-6R) directament amb les gp130 activant senyalització en cèl·lules que poden no disposar del receptor d'IL-6 i que presentin gp130,[28] és a dir, de manera ubiqua per tot el cos. La senyalització que activen és la relacionada amb els efectes proinflamatorios de la Il-6 i és la que coneixem com a senyalització en trans. A més, existeix una forma soluble de gp130 (sgp130) que es pot unir al complex (IL-6+*sIL-6R) i impedeix que interaccionin amb gp130, inhibint així la capacitat proinflamatoria d'aquesta unió. El gp130 soluble no impedirà la unió d'IL-6 amb el receptor de membrana (IL-6R) però sí la interacció del complex (IL-6/*sIL-6R) amb gp130.
Aquests complexos activen el sistema Janus cinasa-transductor de senyal i activador de la transcripció (Janus kinase-*signal transducer and activator of transcription, JAK-*STAT) i la proteïna-cinasa activada per mitògens (mitogen-*activated protein kinase, MAPK), la qual cosa indueix a l'expressió de gens proinflamatorios, com la metaloproteinasa de la matriu (MPM) i el lligand de receptor activador per al factor nuclear kappa-*β (receptor activator of nuclear factor kappa-*β ligand, RANKL).[28]
Paper com a miocina
[modifica]La IL-6 també es considera una miocina, una citocina produïda pel múscul, que s'eleva en resposta a la contracció muscular.[29]
S'eleva significativament amb l'exercici i precedeix a l'aparició d'altres citocines en la circulació. Durant l'exercici, es creu que actua de manera similar a una hormona per a mobilitzar els substrats extracelul·lars i / o augmentar l'alliberament de substrats.[30]
Igual que en els éssers humans, sembla haver-hi un augment en l'expressió d'IL-6 en els músculs actius i en la concentració plasmàtica d'IL-6 durant l'exercici en rosegadors.[31][32] Els estudis en ratolins amb desactivació del gen IL-6 indiquen que la falta d'IL-6 en ratolins afecta la funció de l'exercici.[33]
S'ha demostrat que la reducció de l'obesitat abdominal mitjançant l'exercici en humans adults pot revertir-se mitjançant l'anticòs blocador del receptor d'IL-6, tocilizumab. Juntament amb les troballes que la IL-6 prevé l'obesitat, estimula la lipòlisi i s'allibera del múscul esquelètic durant l'exercici, la troballa de tocilizumab indica que la IL-6 és necessària perquè l'exercici redueixi la massa de teixit adipós visceral.[34] L'os pot ser un altre òrgan afectat per la IL-6 induïda per l'exercici, atès que s'ha informat que la interleucina-6 derivada dels músculs augmenta la capacitat d'exercici mitjançant la senyalització en els osteoblasts.
La IL-6 té àmplies funcions antiinflamatòries en el seu paper de miocina. La IL-6 va ser la primera miocina que es va secretar al torrent sanguini en resposta a les contraccions musculars.[35] L'exercici aeròbic provoca una resposta sistèmica de citocines, que inclou, per exemple, IL-6, antagonista del receptor d'IL-1 (IL-1ra) i IL-10. La IL-6 es va descobrir casualment com una miocina a causa de l'observació que augmentava de manera exponencial proporcional a la durada de l'exercici i la quantitat de massa muscular involucrada en l'exercici. S'ha demostrat consistentment que la concentració plasmàtica d'IL-6 augmenta durant l'exercici muscular. A aquest augment el segueix l'aparició d'IL-1ra i la citocina antiinflamatòria IL-10. En general, la resposta de les citocines a l'exercici i la sèpsia difereix respecte al TNF-α. Per tant, la resposta de les citocines a l'exercici no està precedida per un augment del TNF-α en plasma. Després de l'exercici, la concentració plasmàtica basal d'IL-6 pot augmentar fins a 100 vegades, però són més freqüents els augments menys dràstics. L'augment d'IL-6 en plasma induït per l'exercici es produeix de manera exponencial i el nivell màxim d'IL-6 s'aconsegueix al final de l'exercici o poc després. És la combinació de la manera, la intensitat i la durada de l'exercici el que determina la magnitud de l'augment d'IL-6 en plasma induït per l'exercici.[36]
La IL-6 s'havia classificat prèviament com una citocina proinflamatoria. Per tant, primer es va pensar que la resposta de la IL-6 induïda per l'exercici estava relacionada amb el mal muscular.[37] No obstant això, s'ha fet evident que l'exercici excèntric no està associat amb un augment major de la IL-6 plasmàtica que l'exercici que implica contraccions musculars concèntriques "no nocives". Aquesta troballa demostra clarament que no es requereix mal muscular per a provocar un augment d'IL-6 plasmàtica durant l'exercici. De fet, l'exercici excèntric pot resultar en un pic retardat i una disminució molt més lenta de la IL-6 plasmàtica durant la recuperació.[36]
Treballs recents han demostrat que les vies de senyalització tant aigües amunt com aigües avall per a IL-6 difereixen notablement entre miocits i macròfags. Sembla que, a diferència de la senyalització d'IL-6 en els macròfags, que depèn de l'activació de la via de senyalització de NFκB, l'expressió d'IL-6 intramuscular està regulada per una xarxa de cascades de senyalització, que inclouen les vies Ca2 + / NFAT i glucogen / p38 MAPK. Per tant, quan la IL-6 està enviant senyals en monòcits o macròfags, crea una resposta proinflamatoria, mentre que l'activació i senyalització d'IL-6 en el múscul és totalment independent d'una resposta prèvia de TNF o activació de NFκB, i és antiinflamatòria.
La IL-6, entre un número creixent d'unes altres mioquines identificades recentment, continua sent un tema important en la recerca de les mioquines. Apareix en el teixit muscular i en la circulació durant l'exercici a nivells fins a cent vegades superiors als índexs basals, com s'ha assenyalat prèviament, i es considera que té un impacte beneficiós en la salut i el funcionament corporal quan s'eleva en resposta a l'exercici físic.[38]
Receptor
[modifica]La IL-6 emet senyals a través d'un complex de receptor de citocina tipus I de superfície cel·lular que consta de la cadena d'IL-6Rα d'unió al lligand (CD126) i el component transductor de senyals gp130 (també anomenat CD130). El CD130 és el transductor de senyal comú per a diverses citocines, inclòs el factor inhibidor de la leucèmia (LIF), el factor neurotròfic ciliar, la oncostatina M, la IL-11 i la cardiotrofina-1, i s'expressa de forma gairebé ubiqua en la majoria dels teixits. Per contra, l'expressió de CD126 està restringida a uns certs teixits. A mesura que la IL-6 interactua amb el seu receptor, activa les proteïnes gp130 i IL-6R per a formar un complex, activant així el receptor. Aquests complexos uneixen les regions intracel·lulars de gp130 per a iniciar una cascada de transducció de senyals a través d'uns certs factors de transcripció, Janus kinase (JAK) i transductors de senyals i activadors de la transcripció (STAT).[39]
La IL-6 és probablement la millor estudiada de les citocines que usen gp130, també coneguda com a transductor de senyal d'IL-6 (IL6ST), en els seus complexos de senyalització. Altres citocines que envien senyals a través de receptors que contenen gp130 són la interleucina 11 (IL-11), la interleucina 27 (IL-27), el factor neurotrófico ciliar (CNTF), la cardiotrofina-1 (CT-1), la citocina similar a la cardiotrofina (CLC), la leucèmia. factor inhibidor (LIF), oncostatina M (OSM), proteïna similar a la interleucina 6 del herpesvirus associada al sarcoma de Kaposi (KSHV-IL6).[40] [36] Aquestes citocines es coneixen comunament com IL-6 o gp130 utilitzant citocines.[41]
A més del receptor unit a la membrana, s'ha purificat una forma soluble d'IL-6R (sIL-6R) a partir de sèrum i orina humans. Moltes cèl·lules neuronals no responen a l'estimulació per IL-6 sola, però la diferenciació i supervivència de les cèl·lules neuronals pot estar mediada per l'acció de sIL-6R. El complex sIL-6R / IL-6 pot estimular el creixement de neurites i promoure la supervivència de les neurones i, per tant, pot ser important en la regeneració nerviosa mitjançant remielinización.
Interaccions
[modifica]S'ha demostrat que la interleucina-6 interactua amb el receptor d'interleucina-6,[42][43][44] glicoproteïna 130,[45] i galectina-3.[46]
Existeix una considerable superposició funcional i interacció entre la Substància P (SP), el lligand natural del receptor de neuroquinina tipus 1 (NK1R, un mediador de l'activitat inmunomoduladora) i la IL-6.
Relació amb el càncer
[modifica]El càncer és una malaltia molt heterogènia on participen factors genètics, com ambientals. Mitjançant diferents estudis recents, s'ha pogut observar que la IL-6 té una important relació amb el càncer, concretament, que la IL-6 i / o STAT3 afavoreix el creixement de les cèl·lules tumorals. La IL-6 exerceix funcions en la regulació del microambient tumoral,[47] de la proliferació, apoptosi, angiogènesi i diferenciació de les cèl·lules tumorals de pròstata,[48] la producció de cèl·lules semblants a les cèl·lules mare del càncer de mama,[49] la metàstasi a través de la regulació a la baixa d'E-cadherina,[50] i l'alteració de la metilació de l'ADN en el càncer oral.[51]
Debido a esto, s'han proposat teràpies experimentals per a bloquejar la via de senyalització d'IL-6 / STAT3. S'ha demostrat que l'anticòs anti-IL-6 siltuximab (CNTO 328) inhibeix el creixement de tumors. La teràpia anti-IL-6 es va desenvolupar inicialment per al tractament de malalties autoimmunes, però a causa de la funció de la IL-6 en la inflamació crònica, el bloqueig d'IL-6 també es va avaluar per al tractament del càncer.[52][53] Els inhibidors endògens d'IL-6 són supressors de la senyalització de citoquines i inhibidors de proteïnes de STAT activat. Encara que inhibeixen la transducció de senyals a través de STAT3, també poden presentar efectes antiapoptòtics.[48] Els pacients amb càncer avançat/metastàsic tenen nivells més alts d'IL-6 en la sang.[54] Un exemple d'això és el càncer de pàncrees, amb una elevació notòria d'IL-6 present en pacients que es correlaciona amb taxes de supervivència baixes.[55]
Càncer de mama
[modifica]En estudis in vitro de cèl·lules de càncer de mama, la IL-6 pot estimular o inhibir el creixement cel·lular, depenent del tipus de càncer. En qualsevol cas la IL-6 acaba activant la ruta bioquímica de la Jak/Stat3. La IL-6 és el principal mecanisme d'activació de STAT3 en cèl·lules de càncer de mama, on té un paper essencial en la proliferació cel·lular, la migració cel·lular i la metàstasi.[56]
La resposta a la IL-6 per part de cèl·lules de càncer de mama ve augmentada per la presència de receptors de les hormones de progesterona i d'estrògens (PR+ i ER+ respectivament). Estudis clínics mostren que més d'un 50% dels tumors de càncer de mama mostren nivells elevats d'IL-6 en el mateix tumor, i la majoria de pacients amb càncer de mama mostren nivells més elevats que el normal d'IL-6 en el sèrum.
Les cèl·lules tumorals i els fibroblasts associats a tumors són les principals fonts de secreció d'IL-6 en el microambient tumoral. Diversos estudis han demostrat la funció inmunopatogénica d'IL-6 i la seva senyalització en el creixement tumoral, metàstasi i resistència terapèutica en el càncer de mama.[57]
Paper en les malalties
[modifica]La IL-6 estimula els processos inflamatoris i autoinmuness en moltes malalties com l'esclerosi múltiple,[58] el trastorn de l'espectre de neuromielitis òptica (NMOSD),[58] la diabetis,[59] l'ateroesclerosi, la depressió,[60] la malaltia d'Alzheimer,[61] el lupus eritematós sistèmic, el mieloma múltiple, el càncer de pròstata, la malaltia de Behçet, l'artritis reumatoide, i l'hemorràgia intracerebral.
Per tant, existeix interès a desenvolupar agents anti-IL-6 com a teràpia contra moltes d'aquestes malalties. El primer d'ells és tocilizumab, que ha estat aprovat per a l'artritis reumatoide,[62] la malaltia de Castleman i l'artritis idiopàtica juvenil sistèmica. [58] Uns altres estan en assajos clínics.
SARS-CoV-2 (COVID-19)
[modifica]Un nou coronavirus, anomenat SARS-CoV-2, va ser identificat a la Xina ,Wuhan al desembre de 2019.[63] La presència de COVID-19 es va manifestar per diversos símptomes, que van des de símptomes lleus / asimptomàtics fins a malaltia greu i mort. El SARS-CoV-2 es va propagar molt ràpidament, causant una pandèmia global, la malaltia del coronavirus 2019 (COVID-19). I es va observar que les persones d'edat més avançada tenen un pic més alt de càrrega viral i es veuen més afectades per la COVID-19, ja que la seva taxa de mortalitat relacionada amb la COVID-19 és més alta que en els adults més joves.[64]
Segons les dades actuals de l'OMS, el nombre de casos infectats i morts ha augmentat a 8.708.008 i 461.715, respectivament (desembre de 2019-juny de 2020), a causa de l'alta taxa de mortalitat i la gran afectació de forma negativa al sistema econòmic a diversos països fins avui, s'han de realitzar grans esforços per a produir biomarcadors i medicaments amb èxit per a la COVID-19.[64]
Durant la primera onada de contagis de la COVID-19, la identificació de la progressió de la COVID-19 va recaure principalment en la manifestació clínica. Tot i que encara no s'ha proposat un biomarcador eficaç. S'ha suggerit que el ràpid avenç de la malaltia és a causa d'una tempesta de citocines, també anomenades citoquines.[65][66] Nivells elevats d'interleucina 6 (IL-6) s'han associat a casos greus de la infecció del COVID-19.[65]
La hipercoagulabilitat, la tempesta inflamatòria i l'alliberament múltiple d'enzims són els indicadors que ens permeten monitorar canvis en la progressió i conèixer el pronòstic de la COVID-19. A més, la determinació de les citoquines en un moment concret d'un pacient es pot fer servir per saber la severitat de la malaltia.[66]
Es va dur a terme un estudi a 48 pacients admesos al General Hospital of Central Theater Command (Wuhan, Xina). Una de les troballes més importants d'aquest estudi ha sigut: que la detecció de RNA sèric del SARS-CoV-2 (RNAaemia) en pacients amb COVID-19 s'ha associat amb elevades concentracions d'IL-6 i mal pronòstic[65]
S'ha proposat la IL-6 com una potencial diana terapèutica per a pacients crítics amb una excessiva resposta inflamatòria, ja que la IL-6 elevada pot formar part d'una tempesta de citoquines més gran.[65][67]
A la ciutat xinesa de Wuhan també s'ha realitzat un altre estudi amb un total de 69 casos greus de COVID ‐ 19 que també va mostrar que la interleucina-6 (IL-6) inicial, que està correlacionada positivament amb la temperatura corporal màxima, va augmentar significativament durant l'hospitalització, al mateix temps, també va haver-hi augment en els nivells inicials de PCR, LDH, ferritina i dímer D.[68]
Es va trobar una disminució significativa de la IL-6 i una millor avaluació de la tomografia computada (TC) en els pacients durant la fase de recuperació, mentre que la IL-6 va augmentar encara més en els pacients amb presentació de la malaltia exacerbada i mostrant TC de tòrax amb clar empitjorament.[68]
No obstant això, la funció precisa de la IL-6 en COVID-19 encara no està ben estudiada. Una millor comprensió de la IL-6 en la patogènesi de COVID-19, especialment en els casos greus, pot ajudar-nos a controlar la malaltia.
Malaltia cardiovascular (MCV)
[modifica]Des del punt de vista dels cardiòlegs, aquesta citocina és un biomarcador de confiança de disfunció cardíaca, aparició de fibril·lació auricular, mixoma cardíac amb recurrència, metàstasi o embolització remota i processos ateroscleròtics. Mitjançant la realització de metanàlisi, s'observa que els nivells inicials d'IL-6 són significativament més alts en els casos de MCV que en els quals no pateixen MCV.
Enterovirus 71
[modifica]Els nivells alts d'IL-6 s'associen amb el desenvolupament d'encefalitis en nens i models de ratolí immunodeficients infectats amb Enterovirus 71; aquest virus altament contagiós normalment causa una malaltia més lleu anomenada malaltia de mans, peus i boca, però pot causar encefalitis potencialment mortal en alguns casos. Els pacients amb EV71 amb un cert polimorfisme genètic en IL-6 també semblen més susceptibles a desenvolupar encefalitis.
Artritis
[modifica]Artritis reumatoide
[modifica]La importància de la interleucina-6 en el tractament contra l'artritis reumatoide es basa en la capacitat d'aquesta citocina per a estimular la diferenciació dels osteoclasts, les cèl·lules que podrien ser responsables del deteriorament i la destrucció articular.[69] L'activitat d'aquesta malaltia es pot relacionar amb alts nivells d'aquesta interleucina en el líquid sinovial i el suero dels pacients malalts. Fins fa relativament poc, la majoria dels pacients d'AR eren tractats amb inhibidors de TNF-α, un tractament que ha resultat molt útil en pacients amb un estat de la malaltia avançat. No obstant, les millores més significatives només es presentaven en un terç dels pacients, però es va observar que la inhibició de la IL-6 si que era efectiva en els dos terços restants de pacients als que el tractament inicial no havia fet efecte.[70] Per aquest motiu, recentment en diferents països s'ha començat a utilitzar el primer tractament biològic anti-IL-6 contra l'artritis reumatoide aprovat per l'FDA. Està basat en un anticòs monoclonal humanitzat anomenat Tocilizumab i que actua com a inhibidor dels receptors de la IL-6 bloquejant la seva unió.
Artritis Juvenil Idiopàtica
[modifica]L'artritis juvenil idiopàtica és una malaltia que se sol presentar durant la infantesa i és caracteritzada per una inflamació crònica de les articulacions i múltiples òrgans.[71] Aquesta patogènesi és deguda a una irregularitat del sistema immunològic on les citocines estan involucrades de forma central en la reacció en cascada multifàsica causant de la malaltia i la seva alta complexitat. En aquesta patologia, la IL-6, té una concentració molt més elevada en el líquid sinovial que en sang, i es pot relacionar amb els nivells de ferro, hemoglobina, PCR (proteina C reactiva) i plaquetes, així com amb el nombre d'articulacions afectades i els grau de discapacitat del pacient.[72] Actualment es creu que un sistema d'IL-6 amplificat participa directament en la patogènesi d'aquesta malaltia així com també en l'Artritis reumatoide ja que en aquesta afecció, un circuit de retroalimentació positiva per mitjà de la via epirregulina-ErbB1 actua com a amplificador de la IL-6 i aquesta mateixa via es troba també en tots els tipus d'AJI.[73]
Actualment els estudis se centren en buscar un tractament per arribar a una cura, encara que no signifiqui tornar a l'estat inicial, la remissió o una caiguda en l'activitat de la malaltia. El focus principal està en reduir la inflamació i prevenir la comorbiditat.[74] Des que s'ha trobat que la IL-6 és un objectiu potencial en el desenvolupament d'aquesta malaltia, el tractament s'ha hagut d'adaptar i passar d'un inhibidor de TNF a un inhibidor d'IL-6. En aquest cas el que s'està empleant és el mateix que en l'artritis reumatoide, el Tocilizumab.
Modificacions epigenètiques
[modifica]S'ha demostrat que la IL-6 condueix a diverses malalties neurològiques a causa del seu impacte en la modificació epigenètica dins del cervell[75][76] La IL-6 activa la via de la fosfoinositol 3-cinasa (PI3K), i un objectiu d'aquesta via és la proteïna cinasa B (PKB) (Hodge et al., 2007). La PKB activada amb IL-6 pot fosforilar el senyal de localització nuclear en l'ADN metiltransferasa-1 (DNMT1).[77] Aquesta fosforilació provoca el moviment de DNMT1 cap al nucli, on es pot transcriure.[77] DNMT1 recluta a altres DNMT, inclosos DNMT3A i DNMT3B, que, com a complex, recluten HDAC1.[76] Aquest complex agrega grups metil a les CpG en els promotors de gens, reprimint l'estructura de la cromatina que envolta la seqüència d'ADN i inhibint que la maquinària transcripcional accedeixi al gen per a induir la transcripció.[76] L'augment d'IL-6, per tant, pot hipermetilar les seqüències d'ADN i posteriorment disminuir l'expressió gènica a través dels seus efectes sobre l'expressió de DNMT1.[78]
Esquizofrènia
[modifica]La inducció de la modificació epigenètica per IL-6 s'ha proposat com un mecanisme en la patologia de l'esquizofrènia a través de la hipermetilació i repressió del promotor GAD67.[76] Aquesta hipermetilació pot conduir potencialment a la disminució dels nivells de GAD67 que s'observen en el cervell de les persones amb esquizofrènia.[79] GAD67 pot estar involucrat en la patologia de l'esquizofrènia a través del seu efecte sobre els nivells de GABA i sobre les oscil·lacions neurals.[80] Les oscil·lacions neuronals ocorren quan les neurones inhibidores GABAèrgiques s'activen sincrònicament i causen la inhibició d'una multitud de neurones excitadores objectiu al mateix temps, la qual cosa porta a un cicle d'inhibició i desinhibició.[80] Aquestes oscil·lacions neuronals s'alteren en l'esquizofrènia i aquestes alteracions poden ser responsables dels símptomes tant positius com negatius de l'esquizofrènia.[81]
Depressió i trastorn depressiu major
[modifica]Els efectes epigenètics de la IL-6 també s'han implicat en la patologia de la depressió. Els efectes de la IL-6 sobre la depressió estan mediats per la repressió de l'expressió del factor neurotròfic derivat del cervell (BDNF) en el cervell; DNMT1 hipermetila el promotor BDNF i redueix els nivells de BDNF.[82] La funció alterada del BDNF s'ha relacionat amb la depressió,[83] que probablement es deu a la modificació epigenètica després de la regulació positiva d'IL-6.[82] El BDNF és un factor neutròfic implicat en la formació de la columna, la densitat i la morfologia de les neurones.[84] La regulació a la baixa de BDNF, per tant, pot causar una disminució de la connectivitat en el cervell. La depressió es caracteritza per una connectivitat alterada, en particular entre l'escorça *cingulada anterior i diverses altres àrees límbiques, com l'hipocamp.[85] L'escorça *cingulada anterior és responsable de detectar incongruències entre l'expectativa i l'experiència percebuda.[86] La connectivitat alterada de l'escorça *cingulada anterior en la depressió, per tant, pot causar emocions alterades després d'unes certes experiències, la qual cosa porta a reaccions depressives.[86] Aquesta connectivitat alterada està mediada per IL-6 i el seu efecte sobre la regulació epigenètica del BDNF.[82]
Les dades preclíniques i clíniques addicionals suggereixen que la substancia P [SP] i la IL-6 poden actuar en conjunt per a promoure la depressió major. SP, un neurotransmissor-citocina híbrid, es transmet conjuntament amb BDNF a través de circuits paleo-espinotalàmics des de la perifèria cap a àrees clau del sistema límbic.
No obstant això, tant IL6 com SP mitiguen l'expressió de BDNF en regions del cervell associades amb l'afecte negatiu i la memòria. Tant la SP com la IL6 relaxen les unions estretes de la barrera hematoencefàlica, de manera que els efectes observats en els experiments de ressonància magnètica funcional amb aquestes molècules poden ser una mescla bidireccional d'efectes neuronals, glials, capil·lars, sinàptics, paracrins o de tipus endocrí. A nivell cel·lular, s'observa que la SP augmenta l'expressió de la interleucina-6 (IL-6) a través de les rutes de la cinasa MAP de PI-3K, p42 / 44 i p38. Les dades suggereixen que la translocació nuclear de NF-κB regula la sobreexpressió d'IL-6 en cèl·lules estimulades per SP.[87] Això és d'interès clau ja que:
1) Una metanàlisi indica una associació de trastorn depressiu major, proteïna C reactiva i concentracions plasmàtiques d'IL6.[88]
2) Antagonistes de NK1R [cinc molècules] estudiats per 3 grups independents en més de 2000 pacients de 1998 a 2013 validen el mecanisme com a antidepressiu totalment eficaç, relacionat amb la dosi, amb un perfil de seguretat únic.[89][90]
3) L'observació preliminar que les concentracions plasmàtiques d'IL6 estan elevades en pacients deprimits amb càncer,
4) NK1RAs selectius poden eliminar l'augment endogen de secreció d'IL-6 induït per estrès SP -clínicament.[91]
Aquests i molts altres informes suggereixen que és probable que es justifiqui un estudi clínic d'un antagonista biològic o farmacològic neutralitzador d'IL-6 en pacients amb trastorn depressiu major, amb o sense malalties de base inflamatòria crònica comòrbides; que la combinació de NK1RA i blocadors d'IL6 pot representar un nou enfocament potencialment biomarcable per a la depressió major i possiblement el trastorn bipolar.
El sirukumab, anticòs IL-6, es troba actualment en assajos clínics contra el trastorn depressiu major.
Ateroesclerosi en insfuciència renal crònica
[modifica]L'ateroesclerosi és un trastorn en què s'engruixeix la paret de l'artèria, formant plaques d'ateroma en el seu interior.
La insuficiència renal crònica (IRC) és una síndrome caracteritzada per una pèrdua progressiva del filtrat glomerular i que acostuma a tenir un curs irreversible. El nombre de nefrones disminueix a poc a poc i la funció dels ronyons es deteriora gradualment.
La inflamació és un factor de risc important per a ateroesclerosi.[92] El polimorfisme genètic (–174G/C) dins els gen de la interleucina 6 al cromosoma 7 ha estat associat amb l'ateroesclerosi i el risc de patir malalties cardiovasculars (MCV).[93]
Els nivells citoquines inflamatòries són notablement elevats en pacients amb insuficiència renal crónica (IRC).[92] Les concentracions sèriques d'IL-6 han estat relacionades amb un augment del risc de patir ateroesclerosi i MCV en pacients amb IRC.[93]
Hi ha tres polimorfismes possibles: GC, GG i CC. Els dos primers s'han descrit com a productors alts d'IL-6. El genotip CC s'ha descrit com a productor baix d'IL-6.[94]
Existeixen tres genotips: G/G, G/C i C/C i, segons diferents investigacions, afecten a la transcripció de la citocina. Aquests polimorfismes són deguts a un canvi d'una base nitrogenada guanina (G) per una citosina (C) a la posició 174.[94]
S'ha demostrat que pacients amb IRC i genotips GG i GC (alts productors d'IL-6) tenen nivells en sèrum d'IL6 més alts que els genotips CC. Hi ha una associació significativa entre el polimorfisme i l'augment del risc d'ateroesclerosi.[92]
Asma
[modifica]L'obesitat és un factor de risc conegut en el desenvolupament d'asma greu. Les dades recents suggereixen que la inflamació associada amb l'obesitat, potencialment mediada per IL-6, té un paper a causar una funció pulmonar deficient i un major risc de desenvolupar exacerbacions de l'asma.[95]
Superfamília de proteïnes
[modifica]La interleucina és el membre principal de la superfamília d' IL-6 (Pfam PF00489), que també inclou G-CSF, IL23A i CLCF1. Una versió viral d'IL6 es troba en el virus de l'herpes associat al sarcoma de Kaposi.[96]
Sèpsies
[modifica]Els pacients amb SIRS-sèpsies que van morir van presentar xifres d'IL-6 més elevades que els que van sobreviure. La IL-6 va ser un marcador pronòstic precoç de mortalitat intra-UC.[97]
Sèpsia en pacients crítics
[modifica]La interleucina-6 ha estat proposada com un nou biomarcador per al diagnòstic de sèpsia. Aquesta condició, definida per la OMS com una disfunció d'òrgans potencialment mortal causada per una resposta desregulada de l'hoste a una infecció,[98] és reconeguda per aquesta mateixa organització com una prioritat sanitària ja que és una de les principals causes de mortalitat en pacients crítics. Determinar la concentració d'IL-6 al plasma amb precisió pot servir per a proporcionar un tractament mèdic adequat i eficaç als pacients més crítics i així reduir el risc de mort en els pacients que pateixen aquesta condició.
No obstant, aquest mètode diagnòstic presenta certes limitacions.[99]
Sèpsia neonatal
[modifica]La sèpsia neonatal és una malaltia bastant comuna i perillosa que se sol associar amb una alta taxa de mortalitat en els nounats i especialment en prematurs. Això en part és a causa de l'absència de símptomes en molts casos i la manca d'un test diagnòstic definitiu. No obstant, alguns estudis i meta-anàlisis realitzats en nounats mostren l'eficàcia de la mesura de la interleucina-6 per al diagnòstic d'aquesta malaltia amb resultats d'una sensibilitat de fins al 85% i una especificitat del 80%.[100] Pel que fa als nounats amb PROM (ruptura de membranes prematura abans de l'aparició de contraccions uterines), estudis recents mostren que la IL-6 és un marcador diagnòstic sensible i específic per a diagnosticar precoçment la sèpsia en nounats amb aquesta condició. La seva precisió es manté independentment del tipus de sèpsia neonatal però per a que el diagnòstic sigui òptim s'hauria de detectar la sèpsia primerenca i tardía per separat.[101] A més d'indicar la sèpsia, els alts nivells d'IL-6, sobretot en el plasma del cordó umbilical són també indicadors de PVL (leucomalàsia preventricular) i NEC (enterocolitis necrosant) en infants nascuts abans de les 32 setmanes de gestació.[102]
Diabetis
[modifica]La IL-6 es considera que està implicada decisivament en el desenvolupament de la resistència a la insulina i la fisiopatologia de la diabetis mellitus de tipus 2 (T2D). Els alts nivells en sang d'aquesta citocina estan implicats en la generació d'inflamacions, per mitjà del control sobre mecanismes cel·lulars com la migració, l’apoptosi, i també la disfunció de les cèl·lules β del pàncrees encarregades de la producció d'aquesta proteïna.[103] La seva producció irregular i en un període prolongat de temps indueix l'aparició d'una inflamació que podria comportar una resistència a la insulina i per consegüent diabetis de tipus 2. La relació entre la IL-6 i la resistència a la insulina ve donada per la deterioració que aquesta interleucina provoca sobre la fosforilació del receptor d'insulina i del substrat-1 del receptor d'insulina induint l'expressió d'un inhibidor de la senyalització d'aquesta hormona anomenat SOCS-3.[104] Per aquest motiu, es considera que el bloqueig de la senyalització de la IL-6 podria ser un potencial tractament eficaç contra la resistència a la insulina i la T2D.
Per altra banda, recentment s'ha descobert que la IL-6 podria tenir un paper important en la millora del metabolisme de la glucosa gràcies als seu paper antiinflamatori.
Malalties en animals
[modifica]Els cavalls i els humans comparteixen una inclinació natural pel rendiment atlètic. En aquest sentit, els cavalls es poden considerar una espècie de referència en estudis dissenyats per optimitzar l'entrenament físic i la prevenció de malalties. En ambdues espècies, la interleucina-6 té un paper important en la regulació del procés inflamatori induït durant l'exercici com a part d'una xarxa reguladora metabòlica integrada.[105]
L'ascens de placentitis és la principal causa d'avortament en els cavalls. La interleucina (IL) ‐6 es considera com la predictiva d'infecció placentària en altres espècies, però se sap poc sobre el paper que destaca en l'ascens de la placentitis.[106]
Per saber el paper que porta en els cavalls, a través d'un mètode d'estudi basat en la inoculació transcervical de S. zooepidemicus, es va descobrir que la IL-6 té un paper crucial en la resposta placentària a la inducció de placentitis equina subaguda, i això podria observar-se en el líquid amniòtic, el líquid al·lantoidal i el sèrum matern. A més, la IL-6 actua com a antiinflamatori en aquesta malaltia, alterant potencialment la progressió de la malaltia, impedint els senyals d'avortament i ajudant amb la producció d'un nounat viable.[106]
Referències
[modifica]- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000136244 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000025746 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Akioka, Shinji «Interleukin-6 in juvenile idiopathic arthritis» (en anglès). Modern Rheumatology, 29, 2, 04-03-2019, pàg. 275–286. DOI: 10.1080/14397595.2019.1574697. ISSN: 1439-7595.
- ↑ Universidad de Córdoba. «09 Citocinas y quimiocinas». Arxivat de l'original el 2007-07-15. [Consulta: 28 setembre 2007].
- ↑ Rose-John, Stefan «Interleukin-6 signalling in health and disease» (en anglès). F1000Research, 9, 20-08-2020, pàg. 1013. DOI: 10.12688/f1000research.26058.1. ISSN: 2046-1402.
- ↑ Banks, W. A.; Kastin, A. J.; Gutierrez, E. G. «Penetration of interleukin-6 across the murine blood-brain barrier». Neuroscience Letters, 179, 1-2, 26-09-1994, pàg. 53–56. DOI: 10.1016/0304-3940(94)90933-4. ISSN: 0304-3940. PMID: 7845624.
- ↑ Bastard, J. P.; Jardel, C.; Delattre, J.; Hainque, B.; Bruckert, E. «Evidence for a link between adipose tissue interleukin-6 content and serum C-reactive protein concentrations in obese subjects». Circulation, 99, 16, 27-04-1999, pàg. 2221–2222. ISSN: 1524-4539. PMID: 10217702.
- ↑ 10,0 10,1 Wallenius, Ville; Wallenius, Kristina; Ahrén, Bo; Rudling, Mats; Carlsten, Hans «Interleukin-6-deficient mice develop mature-onset obesity». Nature Medicine, 8, 1, 1-2002, pàg. 75–79. DOI: 10.1038/nm0102-75. ISSN: 1078-8956. PMID: 11786910.
- ↑ Matthews, V. B.; Allen, T. L.; Risis, S.; Chan, M. H. S.; Henstridge, D. C. «Interleukin-6-deficient mice develop hepatic inflammation and systemic insulin resistance». Diabetologia, 53, 11, 11-2010, pàg. 2431–2441. DOI: 10.1007/s00125-010-1865-y. ISSN: 1432-0428. PMID: 20697689.
- ↑ Di Gregorio, Gina B.; Hensley, Lori; Lu, Tong; Ranganathan, Gouri; Kern, Philip A. «Lipid and carbohydrate metabolism in mice with a targeted mutation in the IL-6 gene: absence of development of age-related obesity». American Journal of Physiology. Endocrinology and Metabolism, 287, 1, 7-2004, pàg. E182–187. DOI: 10.1152/ajpendo.00189.2003. ISSN: 0193-1849. PMID: 15191885.
- ↑ Wallenius, Kristina; Wallenius, Ville; Sunter, David; Dickson, Suzanne L.; Jansson, John-Olov «Intracerebroventricular interleukin-6 treatment decreases body fat in rats». Biochemical and Biophysical Research Communications, 293, 1, 26-04-2002, pàg. 560–565. DOI: 10.1016/S0006-291X(02)00230-9. ISSN: 0006-291X. PMID: 12054638.
- ↑ Sadagurski, M.; Norquay, L.; Farhang, J.; D'Aquino, K.; Copps, K. «Human IL6 enhances leptin action in mice». Diabetologia, 53, 3, 3-2010, pàg. 525–535. DOI: 10.1007/s00125-009-1580-8. ISSN: 0012-186X. PMC: 2815798. PMID: 19902173.
- ↑ Campbell, Iain L.; Erta, Maria; Lim, Sue Ling; Frausto, Ricardo; May, Ulrike «Trans-signaling is a dominant mechanism for the pathogenic actions of interleukin-6 in the brain». The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 34, 7, 12-02-2014, pàg. 2503–2513. DOI: 10.1523/JNEUROSCI.2830-13.2014. ISSN: 1529-2401. PMC: 6802757. PMID: 24523541.
- ↑ 16,0 16,1 Rose-John, Stefan «IL-6 trans-signaling via the soluble IL-6 receptor: importance for the pro-inflammatory activities of IL-6». International Journal of Biological Sciences, 8, 9, 2012, pàg. 1237–1247. DOI: 10.7150/ijbs.4989. ISSN: 1449-2288. PMC: 3491447. PMID: 23136552.
- ↑ Shirazi, Rozita; Palsdottir, Vilborg; Collander, Jim; Anesten, Fredrik; Vogel, Heike «Glucagon-like peptide 1 receptor induced suppression of food intake, and body weight is mediated by central IL-1 and IL-6». Proceedings of the National Academy of Sciences of the United States of America, 110, 40, 01-10-2013, pàg. 16199–16204. DOI: 10.1073/pnas.1306799110. ISSN: 1091-6490. PMC: 3791711. PMID: 24048027.
- ↑ Ellingsgaard, Helga; Hauselmann, Irina; Schuler, Beat; Habib, Abdella M.; Baggio, Laurie L. «Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells». Nature Medicine, 17, 11, 30-10-2011, pàg. 1481–1489. DOI: 10.1038/nm.2513. ISSN: 1546-170X. PMC: 4286294. PMID: 22037645.
- ↑ Le Foll, Christelle; Johnson, Miranda D.; Dunn-Meynell, Ambrose A.; Boyle, Christina N.; Lutz, Thomas A. «Amylin-induced central IL-6 production enhances ventromedial hypothalamic leptin signaling». Diabetes, 64, 5, 5-2015, pàg. 1621–1631. DOI: 10.2337/db14-0645. ISSN: 1939-327X. PMC: 4407855. PMID: 25409701.
- ↑ De Jongh RF, Vissers KC, Meert TF, Booij LHDJ, De Dey- ne CS, Heylen RJ. The role of interleukin-6 in noci- ception and pain. Anesth Analg. 2003 Apr;96(4):1096- 103, table of contents.
- ↑ Benedict, Christian; Scheller, Jürgen; Rose-John, Stefan; Born, Jan; Marshall, Lisa «Enhancing influence of intranasal interleukin-6 on slow-wave activity and memory consolidation during sleep». FASEB journal: official publication of the Federation of American Societies for Experimental Biology, 23, 10, 10-2009, pàg. 3629–3636. DOI: 10.1096/fj.08-122853. ISSN: 1530-6860. PMID: 19546306.
- ↑ Richard, Jennifer E.; Farkas, Imre; Anesten, Fredrik; Anderberg, Rozita H.; Dickson, Suzanne L. «GLP-1 receptor stimulation of the lateral parabrachial nucleus reduces food intake: neuroanatomical, electrophysiological, and behavioral evidence». Endocrinology, 155, 11, 11-2014, pàg. 4356–4367. DOI: 10.1210/en.2014-1248. ISSN: 1945-7170. PMC: 4256827. PMID: 25116706.
- ↑ Anesten, Fredrik; Mishra, Devesh; Dalmau Gasull, Adrià; Engström-Ruud, Linda; Bellman, Jakob «Glucagon-Like Peptide-1-, but not Growth and Differentiation Factor 15-, Receptor Activation Increases the Number of Interleukin-6-Expressing Cells in the External Lateral Parabrachial Nucleus». Neuroendocrinology, 109, 4, 2019, pàg. 310–321. DOI: 10.1159/000499693. ISSN: 1423-0194. PMID: 30889580.
- ↑ Mishra, Devesh; Richard, Jennifer E.; Maric, Ivana; Porteiro, Begona; Häring, Martin «Parabrachial Interleukin-6 Reduces Body Weight and Food Intake and Increases Thermogenesis to Regulate Energy Metabolism». Cell Reports, 26, 11, 03-12-2019, pàg. 3011–3026.e5. DOI: 10.1016/j.celrep.2019.02.044. ISSN: 2211-1247. PMC: 6418345. PMID: 30865890.
- ↑ Simpson, R. J.; Hammacher, A.; Smith, D. K.; Matthews, J. M.; Ward, L. D. «Interleukin-6: structure-function relationships». Protein Science: A Publication of the Protein Society, 6, 5, 5-1997, pàg. 929–955. DOI: 10.1002/pro.5560060501. ISSN: 0961-8368. PMC: 2143693. PMID: 9144766.
- ↑ Schaper, Fred; Rose-John, Stefan «Interleukin-6: Biology, signaling and strategies of blockade». Cytokine & Growth Factor Reviews, 26, 5, 10-2015, pàg. 475–487. DOI: 10.1016/j.cytogfr.2015.07.004. ISSN: 1879-0305. PMID: 26189695.
- ↑ Dayer JM, Choy E. Therapeutic targets in rheumatoid arthritis: the interleukin-6 receptor. Rheumatology (Oxford). 2010;49(1):15-24.
- ↑ 28,0 28,1 McInnes IB. Cytokines. In: Firestein GS, Budd RC, Gabriel SE, McInnes IB, O’Dell JR, eds. Kelley’s Textbook of Rheumatology. Vol 1. 9th ed. Philadelphia, PA: Elsevier/Saunders; 2013:369-381.
- ↑ Febbraio, Mark A.; Pedersen, Bente K. «Contraction-Induced Myokine Production and Release: Is Skeletal Muscle an Endocrine Organ?:» (en anglès). Exercise and Sport Sciences Reviews, 33, 3, 7-2005, pàg. 114–119. DOI: 10.1097/00003677-200507000-00003. ISSN: 0091-6331.
- ↑ Petersen, Anne Marie W.; Pedersen, Bente Klarlund «The anti-inflammatory effect of exercise». Journal of Applied Physiology, 98, 4, 4-2005, pàg. 1154–1162. DOI: 10.1152/japplphysiol.00164.2004. ISSN: 8750-7587.
- ↑ Colbert, L. H.; Davis, J. M.; Essig, D. A.; Ghaffar, A.; Mayer, E.-P. «Tissue Expression and Plasma Concentrations of TNFα, IL-1β, and IL-6 Following Treadmill Exercise in Mice». International Journal of Sports Medicine, 22, 4, 5-2001, pàg. 261–267. DOI: 10.1055/s-2001-13818. ISSN: 0172-4622.
- ↑ Jonsdottir, I. H.; Schjerling, P.; Ostrowski, K.; Asp, S.; Richter, E. A. «Muscle contractions induce interleukin‐6 mRNA production in rat skeletal muscles». The Journal of Physiology, 528, 1, 10-2000, pàg. 157–163. DOI: 10.1111/j.1469-7793.2000.00157.x. ISSN: 0022-3751.
- ↑ Fäldt, Jenny; Wernstedt, Ingrid; Fitzgerald, Sharyn M.; Wallenius, Kristina; Bergström, Göran «Reduced Exercise Endurance in Interleukin-6-Deficient Mice». Endocrinology, 145, 6, 01-06-2004, pàg. 2680–2686. DOI: 10.1210/en.2003-1319. ISSN: 0013-7227.
- ↑ AS, Wedell-Neergaard; L, Lang Lehrskov; RH, Christensen; GE, Legaard; E, Dorph «Exercise-induced changes in visceral adipose tissue mass are regulated by IL-6 signaling: A randomized controlled trial». Yearbook of Paediatric Endocrinology, 12-09-2019. DOI: 10.1530/ey.16.11.9. ISSN: 1662-4009.
- ↑ Pedersen, Bente K.; Febbraio, Mark A. «Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6». Physiological Reviews, 88, 4, 10-2008, pàg. 1379–1406. DOI: 10.1152/physrev.90100.2007. ISSN: 0031-9333.
- ↑ 36,0 36,1 Pedersen, Bente K. Muscle as a Secretory Organ (en anglès). American Cancer Society, 2013, p. 1337–1362. DOI 10.1002/cphy.c120033. ISBN 978-0-470-65071-4.
- ↑ Bruunsgaard, H; Galbo, H; Halkjaer-Kristensen, J; Johansen, T L; MacLean, D A «Exercise-induced increase in serum interleukin-6 in humans is related to muscle damage.». The Journal of Physiology, 499, 3, 15-03-1997, pàg. 833–841. DOI: 10.1113/jphysiol.1997.sp021972. ISSN: 0022-3751.
- ↑ Muñoz‐Cánoves, Pura; Scheele, Camilla; Pedersen, Bente K.; Serrano, Antonio L. «Interleukin‐6 myokine signaling in skeletal muscle: a double‐edged sword?». The FEBS Journal, 280, 17, 18-06-2013, pàg. 4131–4148. DOI: 10.1111/febs.12338. ISSN: 1742-464X.
- ↑ Heinrich PC, Behrmann I, Müller-Newen G, Schaper F, Graeve L. Interleukin-6-type cytokine signalling through the gp130/Jak/STAT pathway. Biochem J. 1998 Sep 1;334 (Pt 2)(Pt 2):297-314. doi: 10.1042/bj3340297. PMID: 9716487; PMCID: PMC1219691.
- ↑ Kishimoto, T; Akira, S; Narazaki, M; Taga/blood.V86.4.1243.bloodjournal8641243, T «Interleukin-6 family of cytokines and gp130» (en anglès). Blood, 86, 4, 15-08-1995, pàg. 1243–1254. DOI: 10.1182. ISSN: 0006-4971.
- ↑ Heinrich, Peter C.; Behrmann, Iris; Haan, Serge; Hermanns, Heike M.; Müller-Newen, Gerhard «Principles of interleukin (IL)-6-type cytokine signalling and its regulation» (en anglès). Biochemical Journal, 374, 1, 15-08-2003, pàg. 1–20. DOI: 10.1042/bj20030407. ISSN: 0264-6021.
- ↑ Schwantner, Andreas; Dingley, Andrew J.; Özbek, Suat; Rose-John, Stefan; Grötzinger, Joachim «Direct Determination of the Interleukin-6 Binding Epitope of the Interleukin-6 Receptor by NMR Spectroscopy» (en anglès). Journal of Biological Chemistry, 279, 1, 02-01-2004, pàg. 571–576. DOI: 10.1074/jbc.M311019200. ISSN: 0021-9258.
- ↑ Schuster, Björn; Kovaleva, Marina; Sun, Yi; Regenhard, Petra; Matthews, Vance «Signaling of Human Ciliary Neurotrophic Factor (CNTF) Revisited: THE INTERLEUKIN-6 RECEPTOR CAN SERVE AS AN α-RECEPTOR FOR CNTF» (en anglès). Journal of Biological Chemistry, 278, 11, 14-03-2003, pàg. 9528–9535. DOI: 10.1074/jbc.M210044200. ISSN: 0021-9258.
- ↑ Taga, Tetsuya; Hibi, Masahiko; Hirata, Yuuichi; Yamasaki, Katsuhiko; Yasukawa, Kiyoshi «Interleukin-6 triggers the association of its receptor with a possible signal transducer, gp130» (en anglès). Cell, 58, 3, 8-1989, pàg. 573–581. DOI: 10.1016/0092-8674(89)90438-8.
- ↑ Kallen, Kari-Josef; zum Büschenfelde, Karl-Hermann Meyer; Rose-John, Stefan «The therapeutic potential of interleukin-6 hyperagonists and antagonists» (en anglès). Expert Opinion on Investigational Drugs, 6, 3, 3-1997, pàg. 237–266. DOI: 10.1517/13543784.6.3.237. ISSN: 1354-3784.
- ↑ Gordon-Alonso, Monica; Bruger, Annika M.; van der Bruggen, Pierre «Extracellular galectins as controllers of cytokines in hematological cancer» (en anglès). Blood, 132, 5, 02-08-2018, pàg. 484–491. DOI: 10.1182/blood-2018-04-846014. ISSN: 0006-4971.
- ↑ Li, Jiang; Mo, Hao-Yuan; Xiong, Geng; Zhang, Lin; He, Jia «Tumor microenvironment macrophage inhibitory factor directs the accumulation of interleukin-17-producing tumor-infiltrating lymphocytes and predicts favorable survival in nasopharyngeal carcinoma patients». The Journal of Biological Chemistry, 287, 42, 12-10-2012, pàg. 35484–35495. DOI: 10.1074/jbc.M112.367532. ISSN: 1083-351X. PMC: 3471767. PMID: 22893706.
- ↑ 48,0 48,1 Zoran Culig, Martin Puhr. Interleukin-6 and prostate cancer: Current developments and unsolved questions. Molecular and Cellular Endocrinology. Volume 462, Part A. 2018. Pages 25-30. ISSN 0303-7207
- ↑ Xie, Guozhu; Yao, Qiwei; Liu, Ying; Du, Shasha; Liu, Aihua «IL-6-induced epithelial-mesenchymal transition promotes the generation of breast cancer stem-like cells analogous to mammosphere cultures». International Journal of Oncology, 40, 4, 4-2012, pàg. 1171–1179. DOI: 10.3892/ijo.2011.1275. ISSN: 1791-2423. PMC: 3584811. PMID: 22134360.
- ↑ Miao, Jin-Wei; Liu, Li-Jiang; Huang, Jie «Interleukin-6-induced epithelial-mesenchymal transition through signal transducer and activator of transcription 3 in human cervical carcinoma». International Journal of Oncology, 45, 1, 7-2014, pàg. 165–176. DOI: 10.3892/ijo.2014.2422. ISSN: 1791-2423. PMID: 24806843.
- ↑ Gasche, Jacqueline A.; Hoffmann, Jürgen; Boland, C. Richard; Goel, Ajay «Interleukin-6 promotes tumorigenesis by altering DNA methylation in oral cancer cells». International Journal of Cancer, 129, 5, 01-09-2011, pàg. 1053–1063. DOI: 10.1002/ijc.25764. ISSN: 1097-0215. PMC: 3110561. PMID: 21710491.
- ↑ Korneev, Kirill V.; Atretkhany, Kamar-Sulu N.; Drutskaya, Marina S.; Grivennikov, Sergei I.; Kuprash, Dmitry V. «TLR-signaling and proinflammatory cytokines as drivers of tumorigenesis». Cytokine, 89, 1-2017, pàg. 127–135. DOI: 10.1016/j.cyto.2016.01.021. ISSN: 1096-0023. PMID: 26854213.
- ↑ Anestakis, Doxakis; Petanidis, Savvas; Kalyvas, Spyridon; Nday, Christiane M.; Tsave, Olga «Mechanisms and Αpplications of Ιnterleukins in Cancer Immunotherapy». International Journal of Molecular Sciences, 16, 1, 13-01-2015, pàg. 1691–1710. DOI: 10.3390/ijms16011691. ISSN: 1422-0067. PMC: 4307328. PMID: 25590298.
- ↑ "Los pacientes con cáncer suelen tener niveles aumentados de interleucina-6" . Reunión anual de 2006 de la Sociedad Americana de Oncología Clínica, Resúmenes 8632 y 8633. Medscape.com. 2006-06-26.
- ↑ Bellone, Graziella; Smirne, Carlo; Mauri, Francesco Angelo; Tonel, Elena; Carbone, Anna «Cytokine expression profile in human pancreatic carcinoma cells and in surgical specimens: implications for survival». Cancer immunology, immunotherapy: CII, 55, 6, 6-2006, pàg. 684–698. DOI: 10.1007/s00262-005-0047-0. ISSN: 0340-7004. PMID: 16094523.
- ↑ Dethlefsen, Christine «The role of intratumoral and systemic IL-6 in breast cancer». Breast Cancer Res Treat (2013) 138, pàg. 657–664.
- ↑ Ali Masjedi, Vida Hashemi, Mohammad Hojjat-Farsangi, Ghasem Ghalamfarsa, Gholamreza Azizi, Mehdi Yousefi, Farhad Jadidi-Niaragh. The significant role of interleukin-6 and its signaling pathway in the immunopathogenesis and treatment of breast cancer. Biomedicine & Pharmacotherapy. Volume 108. 2018. Pages 1415-1424. ISSN 0753-3322.
- ↑ 58,0 58,1 Kong, Byung Soo; Kim, Yeseul; Kim, Ga Young; Hyun, Jae-Won; Kim, Su-Hyun «Increased frequency of IL-6-producing non-classical monocytes in neuromyelitis optica spectrum disorder» (en anglès). Journal of Neuroinflammation, 14, 1, 12-2017, pàg. 191. DOI: 10.1186/s12974-017-0961-z. ISSN: 1742-2094.
- ↑ Kristiansen, O. P.; Mandrup-Poulsen, T. «Interleukin-6 and Diabetes: The Good, the Bad, or the Indifferent?» (en anglès). Diabetes, 54, Supplement 2, 01-12-2005, pàg. S114–S124. DOI: 10.2337/diabetes.54.suppl_2.S114. ISSN: 0012-1797.
- ↑ Dowlati, Yekta; Herrmann, Nathan; Swardfager, Walter; Liu, Helena; Sham, Lauren «A Meta-Analysis of Cytokines in Major Depression» (en anglès). Biological Psychiatry, 67, 5, 3-2010, pàg. 446–457. DOI: 10.1016/j.biopsych.2009.09.033.
- ↑ Swardfager, Walter; Lanctôt, Krista; Rothenburg, Lana; Wong, Amy; Cappell, Jaclyn «A Meta-Analysis of Cytokines in Alzheimer's Disease» (en anglès). Biological Psychiatry, 68, 10, 11-2010, pàg. 930–941. DOI: 10.1016/j.biopsych.2010.06.012.
- ↑ Emery, P.; Keystone, E.; Tony, H. P.; Cantagrel, A.; van Vollenhoven, R. «IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial» (en anglès). Annals of the Rheumatic Diseases, 67, 11, 01-11-2008, pàg. 1516–1523. DOI: 10.1136/ard.2008.092932. ISSN: 0003-4967.
- ↑ Kannan, S.; Shaik Syed Ali, P.; Sheeza, A.; Hemalatha, K. «COVID-19 (Novel Coronavirus 2019) – recent trends». European Review for Medical and Pharmacological Sciences, 24, 4, 2-2020, pàg. 2006–2011. DOI: 10.26355/eurrev_202002_20378. ISSN: 1128-3602.
- ↑ 64,0 64,1 Esakandari, Hanie; Nabi-Afjadi, Mohsen; Fakkari-Afjadi, Javad; Farahmandian, Navid; Miresmaeili, Seyed-Mohsen «A comprehensive review of COVID-19 characteristics» (en anglès). Biological Procedures Online, 22, 1, 12-2020, pàg. 19. DOI: 10.1186/s12575-020-00128-2. ISSN: 1480-9222.
- ↑ 65,0 65,1 65,2 65,3 Chen, Xiaohua; Zhao, Binghong; Qu, Yueming; Chen, Yurou; Xiong, Jie «Detectable serum SARS-CoV-2 viral load (RNAaemia) is closely correlated with drastically elevated interleukin 6 (IL-6) level in critically ill COVID-19 patients». Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 17-04-2020. DOI: 10.1093/cid/ciaa449. ISSN: 1058-4838. PMC: 7184354. PMID: 32301997.
- ↑ 66,0 66,1 Wang, Haijun; Luo, Shanshan; Shen, Yin; Li, Mingyue; Zhang, Zili «Multiple Enzyme Release, Inflammation Storm and Hypercoagulability Are Prominent Indicators For Disease Progression In COVID-19: A Multi-Centered, Correlation Study with CT Imaging Score» (en anglès). SSRN Electronic Journal, 2020. DOI: 10.2139/ssrn.3544837. ISSN: 1556-5068.
- ↑ Ulhaq, Zulvikar Syambani; Soraya, Gita Vita «Interleukin-6 as a potential biomarker of COVID-19 progression». Médecine et Maladies Infectieuses, 50, 4, 6-2020, pàg. 382–383. DOI: 10.1016/j.medmal.2020.04.002. ISSN: 0399-077X.
- ↑ 68,0 68,1 «EMBO Mol Med (2020) 12: e12421». .
- ↑ Pandolfi, Franco; Franza, Laura; Carusi, Valentina; Altamura, Simona; Andriollo, Gloria «Interleukin-6 in Rheumatoid Arthritis» (en anglès). International Journal of Molecular Sciences, 21, 15, 23-07-2020, pàg. 5238. DOI: 10.3390/ijms21155238. ISSN: 1422-0067. PMC: PMC7432115. PMID: 32718086.
- ↑ Kim, Go Woon; Lee, Na Ra; Pi, Ryo Han; Lim, Yee Seul; Lee, Yu Mi «IL-6 inhibitors for treatment of rheumatoid arthritis: past, present, and future» (en anglès). Archives of Pharmacal Research, 38, 5, 5-2015, pàg. 575–584. DOI: 10.1007/s12272-015-0569-8. ISSN: 0253-6269.
- ↑ Petty, Ross E.; Laxer, Ronald M.; Wedderburn, Lucy R. Juvenile Idiopathic Arthritis. Elsevier, 2016, p. 188–204.e6. ISBN 978-0-323-24145-8.
- ↑ de Benedetti, Fabrizio; Massa, Margherita; Robbioni, Piera; Ravelli, Angelo; Burgio, Giuseppe R. «Correlation of Serum Interleukin-6 Levels with Joint Involvement and Thrombocytosis in Systemic Juvenile Rheumatoid Arthritis». Arthritis & Rheumatism, 34, 9, 07-10-1991, pàg. 1158–1163. DOI: 10.1002/art.1780340912. ISSN: 0004-3591.
- ↑ Tu, Zhi-qiang; Xue, Hai-yan; Chen, Wei; Cao, Lan-fang; Zhang, Wei-qi «Identification of potential peripheral blood diagnostic biomarkers for patients with juvenile idiopathic arthritis by bioinformatics analysis». Rheumatology International, 37, 3, 19-11-2016, pàg. 423–434. DOI: 10.1007/s00296-016-3607-z. ISSN: 0172-8172.
- ↑ Ravelli, Angelo; Consolaro, Alessandro; Horneff, Gerd; Laxer, Ronald M; Lovell, Daniel J «Treating juvenile idiopathic arthritis to target: recommendations of an international task force». Annals of the Rheumatic Diseases, 11-04-2018, pàg. annrheumdis–2018-213030. DOI: 10.1136/annrheumdis-2018-213030. ISSN: 0003-4967.
- ↑ Smith, S. E. P.; Li, J.; Garbett, K.; Mirnics, K.; Patterson, P. H. «Maternal Immune Activation Alters Fetal Brain Development through Interleukin-6». Journal of Neuroscience, 27, 40, 03-10-2007, pàg. 10695–10702. DOI: 10.1523/jneurosci.2178-07.2007. ISSN: 0270-6474.
- ↑ 76,0 76,1 76,2 76,3 Kundakovic, Marija; Chen, Ying; Guidotti, Alessandro; Grayson, Dennis R. «The Reelin and GAD67 Promoters Are Activated by Epigenetic Drugs That Facilitate the Disruption of Local Repressor Complexes». Molecular Pharmacology, 75, 2, 24-11-2008, pàg. 342–354. DOI: 10.1124/mol.108.051763. ISSN: 0026-895X.
- ↑ 77,0 77,1 «Methyltransferase, DNA (dnmt1, dnmt1-b, 19p13.3-p13.2)». Encyclopedic Dictionary of Genetics, Genomics and Proteomics. John Wiley & Sons, Inc. [Hoboken, NJ, USA], 15-07-2004.
- ↑ Foran, E.; Garrity-Park, M. M.; Mureau, C.; Newell, J.; Smyrk, T. C. «Upregulation of DNA Methyltransferase-Mediated Gene Silencing, Anchorage-Independent Growth, and Migration of Colon Cancer Cells by Interleukin-6» (en anglès). Molecular Cancer Research, 8, 4, 01-04-2010, pàg. 471–481. DOI: 10.1158/1541-7786.MCR-09-0496. ISSN: 1541-7786.
- ↑ Guidotti, Alessandro; Auta, James; Davis, John M.; Gerevini, Valeria DiGiorgi; Dwivedi, Yogesh «Decrease in Reelin and Glutamic Acid Decarboxylase67 (GAD67) Expression in Schizophrenia and Bipolar Disorder: A Postmortem Brain Study» (en anglès). Archives of General Psychiatry, 57, 11, 01-11-2000, pàg. 1061. DOI: 10.1001/archpsyc.57.11.1061. ISSN: 0003-990X.
- ↑ 80,0 80,1 Gandal, M J; Sisti, J; Klook, K; Ortinski, P I; Leitman, V «GABAB-mediated rescue of altered excitatory–inhibitory balance, gamma synchrony and behavioral deficits following constitutive NMDAR-hypofunction» (en anglès). Translational Psychiatry, 2, 7, 7-2012, pàg. e142–e142. DOI: 10.1038/tp.2012.69. ISSN: 2158-3188. PMC: PMC3410621. PMID: 22806213.
- ↑ Uhlhaas, Peter J.; Singer, Wolf «Abnormal neural oscillations and synchrony in schizophrenia» (en anglès). Nature Reviews Neuroscience, 11, 2, 2-2010, pàg. 100–113. DOI: 10.1038/nrn2774. ISSN: 1471-0048.
- ↑ 82,0 82,1 82,2 Sharma, Rajiv P.; Tun, Nguwah; Grayson, Dennis R. «Depolarization induces downregulation of DNMT1 and DNMT3a in primary cortical cultures». Epigenetics, 3, 2, 3-2008, pàg. 74–80. DOI: 10.4161/epi.3.2.6103. ISSN: 1559-2308. PMID: 18536530.
- ↑ Hwang, Jen-Ping; Tsai, Shih-Jen; Hong, Chen-Jee; Yang, Chen-Hong; Lirng, Jiing-Feng «The Val66Met polymorphism of the brain-derived neurotrophic-factor gene is associated with geriatric depression». Neurobiology of Aging, 27, 12, 12-2006, pàg. 1834–1837. DOI: 10.1016/j.neurobiolaging.2005.10.013. ISSN: 1558-1497. PMID: 16343697.
- ↑ Ethell, Iryna M.; Pasquale, Elena B. «Molecular mechanisms of dendritic spine development and remodeling». Progress in Neurobiology, 75, 3, 2-2005, pàg. 161–205. DOI: 10.1016/j.pneurobio.2005.02.003. ISSN: 0301-0082. PMID: 15882774.
- ↑ Greicius, Michael D.; Flores, Benjamin H.; Menon, Vinod; Glover, Gary H.; Solvason, Hugh B. «Resting-state functional connectivity in major depression: abnormally increased contributions from subgenual cingulate cortex and thalamus». Biological Psychiatry, 62, 5, 01-09-2007, pàg. 429–437. DOI: 10.1016/j.biopsych.2006.09.020. ISSN: 0006-3223. PMC: 2001244. PMID: 17210143.
- ↑ 86,0 86,1 Somerville, Leah H.; Heatherton, Todd F.; Kelley, William M. «Anterior cingulate cortex responds differentially to expectancy violation and social rejection». Nature Neuroscience, 9, 8, 8-2006, pàg. 1007–1008. DOI: 10.1038/nn1728. ISSN: 1097-6256. PMID: 16819523.
- ↑ Azzolina, Antonina; Bongiovanni, Antonella; Lampiasi, Nadia «Substance P induces TNF-α and IL-6 production through NFκB in peritoneal mast cells» (en anglès). Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, 1643, 1-3, 12-2003, pàg. 75–83. DOI: 10.1016/j.bbamcr.2003.09.003.
- ↑ Haapakoski, Rita; Mathieu, Julia; Ebmeier, Klaus P.; Alenius, Harri; Kivimäki, Mika «Cumulative meta-analysis of interleukins 6 and 1β, tumour necrosis factor α and C-reactive protein in patients with major depressive disorder» (en anglès). Brain, Behavior, and Immunity, 49, 10-2015, pàg. 206–215. DOI: 10.1016/j.bbi.2015.06.001.
- ↑ Ratti, Emiliangelo; Bettica, Paolo; Alexander, Robert; Archer, Graeme; Carpenter, David «Full central neurokinin-1 receptor blockade is required for efficacy in depression: evidence from orvepitant clinical studies» (en anglès). Journal of Psychopharmacology, 27, 5, 5-2013, pàg. 424–434. DOI: 10.1177/0269881113480990. ISSN: 0269-8811.
- ↑ Kramer, M. S. «Distinct Mechanism for Antidepressant Activity by Blockade of Central Substance P Receptors». Science, 281, 5383, 11-09-1998, pàg. 1640–1645. DOI: 10.1126/science.281.5383.1640.
- ↑ Zhu, Goafa F.; Chancellor-Freeland, Cheryl; Berman, Ari S.; Kage, Reinhard; Leeman, Susan E. «Endogenous Substance P Mediates Cold Water Stress-Induced Increase in Interleukin-6 Secretion from Peritoneal Macrophages» (en anglès). The Journal of Neuroscience, 16, 11, 01-06-1996, pàg. 3745–3752. DOI: 10.1523/JNEUROSCI.16-11-03745.1996. ISSN: 0270-6474.
- ↑ 92,0 92,1 92,2 Yeun, Jane Y.; Levine, Richard A.; Mantadilok, Viput; Kaysen, George A. «C-reactive protein predicts all-cause and cardiovascular mortality in hemodialysis patients». American Journal of Kidney Diseases, 35, 3, 3-2000, pàg. 469–476. DOI: 10.1016/s0272-6386(00)70200-9. ISSN: 0272-6386.
- ↑ 93,0 93,1 Liu, Yongmei; Berthier-Schaad, Yvette; Fallin, Margaret D.; Fink, Nancy E.; Tracy, Russell P. «IL-6 Haplotypes, Inflammation, and Risk for Cardiovascular Disease in a Multiethnic Dialysis Cohort». Journal of the American Society of Nephrology, 17, 3, 08-02-2006, pàg. 863–870. DOI: 10.1681/asn.2005050465. ISSN: 1046-6673.
- ↑ 94,0 94,1 Fragoso-Bargas, Nicolas. ASOCIACIÓN DEL POLIMORFISMO IL6 -174 G/C CON LA DIABETES MELLITUS TIPO 2 EN UNA POBLACIÓN YUCATECA (ASSOCIATION OF THE IL6 -174G/C POLYMORPHISM WITH TYPE 2 DIABETES MELLITUS IN A YUCATECAN POPULATION) (tesi) (en castellà). México: Universidad autónoma de Yucatán, 3 maig 2016, p. 15-17.
- ↑ Peters, Michael C; McGrath, Kelly Wong; Hawkins, Gregory A; Hastie, Annette T; Levy, Bruce D «Plasma interleukin-6 concentrations, metabolic dysfunction, and asthma severity: a cross-sectional analysis of two cohorts». The Lancet Respiratory Medicine, 4, 7, 7-2016, pàg. 574–584. DOI: 10.1016/s2213-2600(16)30048-0. ISSN: 2213-2600.
- ↑ Suthaus, Jan; Stuhlmann-Laeisz, Christiane; Tompkins, Van S.; Rosean, Timothy R.; Klapper, Wolfram «HHV-8-encoded viral IL-6 collaborates with mouse IL-6 in the development of multicentric Castleman disease in mice». Blood, 119, 22, 31-05-2012, pàg. 5173–5181. DOI: 10.1182/blood-2011-09-377705. ISSN: 1528-0020. PMC: 3370672. PMID: 22490805.
- ↑ Pallás Beneyto, Luis Alberto; Rodríguez Luis, Olga; Saiz Sánchez, Carmen; Cotell Simón, Oscar; Bautista Rentero, Daniel «Valor pronóstico de la interleucina 6 en la mortalidad de pacientes con sepsis» (en castellà). Medicina Clínica, 147, 7, 10-2016, pàg. 281–286. DOI: 10.1016/j.medcli.2016.06.001.
- ↑ «Sepsis» (en anglès). [Consulta: 8 novembre 2020].
- ↑ Molano Franco, Daniel; Arevalo-Rodriguez, Ingrid; Roqué i Figuls, Marta; Montero Oleas, Nadia G; Nuvials, Xavier «Plasma interleukin-6 concentration for the diagnosis of sepsis in critically ill adults» (en anglès). Cochrane Database of Systematic Reviews, 30-04-2019. DOI: 10.1002/14651858.CD011811.pub2. PMC: PMC6490303. PMID: 31038735.
- ↑ Boskabadi, Hassan; Zakerihamidi, Maryam «Evaluate the diagnosis of neonatal sepsis by measuring interleukins: A systematic review» (en anglès). Pediatrics & Neonatology, 59, 4, 8-2018, pàg. 329–338. DOI: 10.1016/j.pedneo.2017.10.004.
- ↑ Qiu, Xia; Zhang, Li; Tong, Yu; Qu, Yi; Wang, Huiqing «Interleukin-6 for early diagnosis of neonatal sepsis with premature rupture of the membranes: A meta-analysis» (en anglès). Medicine, 97, 47, 11-2018, pàg. e13146. DOI: 10.1097/MD.0000000000013146. ISSN: 0025-7974. PMC: PMC6392693. PMID: 30461611.
- ↑ Goepfert, Alice R.; Andrews, William W.; Carlo, Waldemar; Ramsey, Patrick S.; Cliver, Suzanne P. «Umbilical cord plasma interleukin-6 concentrations in preterm infants and risk of neonatal morbidity» (en anglès). American Journal of Obstetrics and Gynecology, 191, 4, 10-2004, pàg. 1375–1381. DOI: 10.1016/j.ajog.2004.06.086.
- ↑ Akbari, Mohamad; Hassan-Zadeh, Vahideh «IL-6 signalling pathways and the development of type 2 diabetes» (en anglès). Inflammopharmacology, 26, 3, 6-2018, pàg. 685–698. DOI: 10.1007/s10787-018-0458-0. ISSN: 0925-4692.
- ↑ Rehman, Kanwal; Akash, Muhammad Sajid Hamid; Liaqat, Aamira; Kamal, Shagufta; Qadir, Muhammad Imran «Role of Interleukin-6 in Development of Insulin Resistance and Type 2 Diabetes Mellitus» (en anglès). Critical Reviews in Eukaryotic Gene Expression, 27, 3, 2017, pàg. 229–236. DOI: 10.1615/CritRevEukaryotGeneExpr.2017019712. ISSN: 1045-4403.
- ↑ Capomaccio, Stefano; Cappelli, Katia; Spinsanti, Giacomo; Mencarelli, Marzia; Muscettola, Michela «Athletic humans and horses: Comparative analysis of interleukin-6 (IL-6) and IL-6 receptor (IL-6R) expression in peripheral blood mononuclear cells in trained and untrained subjects at rest» (en anglès). BMC Physiology, 11, 1, 2011, pàg. 3. DOI: 10.1186/1472-6793-11-3. ISSN: 1472-6793. PMC: PMC3036646. PMID: 21255427.
- ↑ 106,0 106,1 Fedorka, Carleigh E.; Scoggin, Kirsten E; El‐Sheikh Ali, Hossam; Loux, Shavahn; Dini, Pouya «Interleukin‐6 pathobiology in equine placental infection» (en anglès). American Journal of Reproductive Immunology, 24-10-2020. DOI: 10.1111/aji.13363. ISSN: 1046-7408.