Manganès
| Manganès | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
25Mn
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||
Metàl·lic platejat Manganès sòlid  Línies espectrals del manganès | ||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Manganès, Mn, 25 | |||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 7, 4, d | |||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 54,938045(5) | |||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 3d5 2, 8, 13, 2 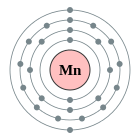
| |||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
7,21 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
5,95 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.519 K, 1.246 °C | |||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 2.334 K, 2.061 °C | |||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 12,91 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 221 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 26,32 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 7, 6, 5, 4, 3, 2, 1, -1, -2, -3 (òxid àcid, bàsic o amfòter, depenent de l'estat d'oxidació) | |||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,55 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 717,3 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| 2a: 1.509,0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| 3a: 3.248 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 127 pm | |||||||||||||||||||||||||||||||||||||||
| Radi covalent | 139±5 (espín baix), 161±8 (espín alt) pm | |||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 1,44 µΩ·m | |||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 7,81 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 21,7 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 5.150 m·s−1 | |||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 198 GPa | |||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 120 GPa | |||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 6,0 | |||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 196 MPa | |||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7439-96-5 | |||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del manganès | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
El manganès[nota 1] o manganés[nota 2] és un element químic de nombre atòmic 25 situat en el grup 7 de la taula periòdica dels elements i se simbolitza com Mn. És un metall dur, trencadís i platejat, que sovint es troba en minerals en combinació amb ferro. El manganès és un metall de transició amb una varietat polifacètica d'usos d'aliatge industrial, especialment en acers inoxidables. Millora la resistència, la treballabilitat i la resistència al desgast. L'òxid de manganès s'utilitza com a agent oxidant; com a additiu de cautxú; i en la fabricació de vidre, adobs i ceràmica. El sulfat de manganès es pot fer servir com a fungicida.
El manganès també és un element dietètic humà essencial, important en el metabolisme dels macronutrients, la formació òssia i els sistemes de defensa dels radicals químics. És un component crític en desenes de proteïnes i enzims.[1] Es troba principalment als ossos, però també al fetge, als ronyons i al cervell.[2] Al cervell humà, el manganès està unit a les metal·loproteïnes de manganès, sobretot la glutamina sintetasa en els astròcits.
El manganès es va aïllar per primera vegada el 1774. És habitual al laboratori en forma de permanganat de potassi de sal violeta. Es produeix a les zones actives d'alguns enzims.[3] De particular interès és l'ús d'un clúster Mn-O, el complex que evoluciona l'oxigen, en la producció d'oxigen per part de les plantes.
Història
[modifica]

Diversos òxids de manganès de colors vius, com la pirolusita, es poden trobar a la natura i s'han utilitzat com a pigments des de l'edat de pedra. Les pintures rupestres de la cova d'Altamira, Cantàbria, que tenen entre 36 500 i 12 000 anys d'antiguitat, són exemples de pintures amb pigments de manganès. Els compostos de manganès foren usats pels fabricants de vidre egipcis i romans, fos per afegir o treure el color del vidre. El «sabó de vidrier» s'emprà sense interrupció des de l'edat mitjana fins als temps moderns i es fa evident en el vidre del segle xiv de Venècia. Ja que es feia servir en la fabricació de vidre, la pirolusita estava disponible per a experiments dels alquimistes. L'alquimista austríac Ignatius Gottfried Kaim (1746-1778) el 1770 i l'alquimista i químic alemany-holandès Johann Rudolf Glauber (1604-1670) observaren que el diòxid de manganès podia ser convertit en permanganat, un reactiu de laboratori útil. A mitjan segle xviii, el químic farmacèutic suec-pomerani i alemany Carl Wilhelm Scheele (1742-1786) utilitzà el diòxid de manganès per produir clor. Scheele i altres químics eren conscients que el diòxid de manganès contenia un nou element, però no aconseguiren aïllar-lo. El químic i metal·lurgista suec Johan Gottlieb Gahn (1745-818) fou el primer a produir una mostra impura de metall de manganès el 1774, reduint el diòxid de manganès amb carboni.[4]
Etimològicament el mot «manganès» prové del francès manganèse, probablement d’una pronúncia defectuosa de mangnesia, grafia medieval freqüent de magnesia, amb què es coneixia el mineral pirolusita semblant a la pedra d’imant de Magnèsia, població de l'Àsia Menor, el tetraòxid de triferro o òxid de ferro(II,III) .[5]
La fabricació de clor i agents blanquejadors d'hipoclorit fou un gran consumidor de minerals de manganès. A l'inici del segle xix, el manganès es començà a fer ús en la producció d'acer i es van concedir diverses patents. El 1816 es reconegué que el ferro aliat amb manganès era més dur però no més fràgil.[4]
Estat natural i obtenció
[modifica]
El manganès és el dotzè element químic més abundant en l'escorça terrestre, essent present aproximadament en un 0,1 %, per darrere del ferro, i està àmpliament distribuït. Els sols contenen entre 7 i 9 000 ppm de manganès, amb una mitjana de 400 ppm.[4]
S'han descrit 748 minerals que contenen manganès. Els cinc que en presenten més són: manganosita , 77,45 %; mavlyanovita , 76,53 %; hausmannita , 72,03 %; brownleeïta , 66,17 % i takanelita , 64, 21 %.[6] Només una dotzena dels minerals de manganès té interès industrial. Destaquen: pirolusita , psilomelana , manganita , braunita , rodonita , rodocrosita , hübnerita , etc. També s'ha trobat en nòduls marins, on el contingut en manganès oscil·la entre un 15 i un 30 %, i d'on seria possible extraure'l. S'ha calculat que n'hi pot haver fins a 1012 t.[7]

El principal productor de manganès el 2022 fou Sud-àfrica amb 7 200 t, seguida del Gabon amb 4 600 t i Austràlia amb 3 300 t. La producció mundial fou de 20 000 t. Les reserves mundials es calculen en 1 700 000 t, que es troben majoritàriament a Sud-àfrica (640 000 t), la Xina (280 000 t) i Austràlia i el Brasil (270 000 t cadascun).[8]
Per a la producció de ferromanganès, el mineral de manganès es mescla amb mineral de ferro i carboni i posteriorment es redueix sigui en un alt forn o en un forn d'arc elèctric. El ferromanganès resultant té un contingut de manganès del 30 % al 80 %. El manganès pur utilitzat per produir aliatges lliures de ferro s'obté per lixiviació del mineral de manganès amb àcid sulfúric seguida d'un procés d'electroobtenció.[4]

Un procés d'extracció més avançat consisteix en la reducció directa del mineral de manganès en una pila de lixiviació. Això es fa percolant gas natural per la part inferior de la pila; el gas natural proporciona la calor (ha de ser com a mínim 850 °C) i l'agent reductor (monòxid de carboni). Això redueix tot el mineral de manganès a òxid de manganès(II) , que és una forma lixiviable. El mineral passa després a través d'un circuit de molta per reduir la grandària de partícula del mineral fins a estar entre 150 i 250 μm, augmentant l'àrea superficial per millorar l'eficiència de lixiviació. El mineral de grans dimensions s'afegeix posteriorment a un dipòsit de lixiviació d'àcid sulfúric i cations ferro(2+) en una proporció de 1,6:1. El ferro reacciona amb el diòxid de manganès per formar hidròxid de ferro i manganès elemental. Aquest procés dona com a resultat una recuperació d'aproximadament el 92 % del manganès. Per a una posterior purificació, el manganès pot ser enviat a una instal·lació d'electroobtenció.[4]
Propietats
[modifica]Propietats físiques
[modifica]El manganès és un metall de transició blanc grisenc, semblant al ferro. És un metall dur i molt fràgil, refractari i fàcilment oxidable. El manganès metall pot ser ferromagnètic, però només després de patir un tractament especial.
Propietats químiques
[modifica]Els seus estats d'oxidació més comuns són +2, +3, +4, +6 i +7, encara que s'han trobat des de +1 a +7; els compostos en els que el manganès presenta estat d'oxidació +7 són agents oxidants molt enèrgics. Dins dels sistemes biològics, el catió Mn+2 competix sovint amb el Mg+2. S'empra sobretot aliat amb ferro en acers i en altres aliatges.
El permanganat de potassi, KMnO₄, és un reactiu de laboratori molt comú a causa de les seues propietats oxidants.
El diòxid de manganès, MnO₂ s'empra com a despolaritzador en piles seques. També es pot usar per a decolorar vidre que presenta color verd a causa de la presència de traces de ferro. Aquest òxid també s'empra per a donar color ametista al vidre, i és responsable del color de l'ametista (una varietat del quars). A més, s'utilitza en la producció de clor i oxigen.
Isòtops
[modifica]El manganès natural conté només 1 isòtop; Mn-55. 18 radioisòtops han estat caracteritzats, sent el Mn-53 el més estable amb un període de semidesintegració de 3.7 milions d'anys, Mn-54 amb un període de 312.3 dies, i Mn-52 de 5.591 dies. La resta d'isòtops radioactius, tenen períodes inferiors a les 3 hores i la majoria d'aquests inferiors a 1 minut. Aquest element també té 3 metaestats.
El manganès està inclòs dins el grup d'elements del ferro, que es creu que són sintetitzats dins de gran estrelles poc abans de la seva explosió en forma de supernoves. El Manganès-53 es desintegra en 53Cr amb un període de semidesintegració de 3.7 milions d'anys. A causa d'aquest període relativament curt, 53Mn és un radionúclid extingit. El contingut isotòpic del manganès es combina típicament amb contingut isotòpic del crom, i ha trobat aplicació en la geologia d'isòtops. Variacions en la proporció 53Cr/52Cr i Mn/Cr des d'uns quants meteorits indiquen una proporció de 53Mn/55Mn inicial, que suggereix que la relació isotòpica de Mn-Cr hagi resultat de la desintegració in situ del 53Mn en cossos planetaris diferenciats. Per això el 53Mn proporciona evidències addicionals per als processos nucleosintètics immediatament abans de la coalescència del sistema solar.
El pes atòmic dels isòtops de manganès varia des de les 46 uma (Mn-46) a 65 uma (Mn-65). El principal mode de desintegració dels isòtops fins a l'isòtop estable més abundant, Mn-55, és la captura electrònica i el mode principal dels isòtops més grans és la desintegració beta.
Aplicacions
[modifica]
- És important per a la fabricació d'acers. El manganès reacciona amb el sofre present formant sulfur de manganès (MnS), evitant que el sofre reaccioni amb el ferro (augmentant la fragilitat i sent més difícil de forjar); també l'excés pot reaccionar amb el carboni donant carburs de manganès, millorant les propietats mecàniques de l'acer. A més, el manganès té propietats desoxidants i evita la formació de bombolles.
- La major part del manganès s'empra per a obtenir ferromanganès (conté un 80% en Mn). Aquest aliatge de manganès i ferro s'obté per reducció del triòxid de diferro (Fe₂O₃), i el diòxid de manganès (MnO₂).
- També s'empra en el silicomanganès, un aliatge amb un 60-70% en manganès i un 15-30% en silici.
- Pot estar present en altres aliatges, per exemple amb alumini.
- El diòxid de manganès, MnO₂, s'utilitza com a despolaritzador en piles seques, anomenades també piles tipus Leclanché o de zinc/carboni (Zn/C). També es troba en les piles alcalines o de zinc/diòxid de manganès (Zn/MnO₂).
- El MnO₂ també s'empra en l'obtenció de pintures i en la descoloració del vidre.
Rol biològic
[modifica]El manganès és un oligoelement; és considerat un element químic essencial per a totes les formes de vida.
S'ha comprovat que el manganès té un paper tant estructural com enzimàtic. Està present en diferents enzims, destacant la superòxid dismutasa de manganès (Mn-SOD), que catalitza la dismutació de superòxids, O₂-; la Mn-catalasa, que catalitza la dismutació de peròxid, H₂O₂; així com en la concavanila A (de la família de les lecitines), on el manganès té un paper estructural.
En humans, el manganès s'absorbeix en l'intestí prim i la major part acaba al fetge, d'on es reparteix a diferents parts de l'organisme.
Precaucions
[modifica]Els compostos de manganès són menys tòxics que els d'altres metalls generalitzats, com el níquel i el coure.[9] Tanmateix, l'exposició a pols i fums de manganès no ha de superar el valor màxim de 5 mg/m ³ fins i tot durant períodes curts a causa del seu nivell de toxicitat.[10] La intoxicació per manganès s'ha relacionat amb habilitats motrius deteriorades i trastorns cognitius.[11]
El permanganat presenta una toxicitat més alta que els compostos de manganès (II). La dosi mortal és d'uns 10 g, i s'han produït diverses intoxicacions mortals. El fort efecte oxidatiu condueix a la necrosi de la membrana mucosa. Per exemple, l'esòfag es veu afectat si s'empassa el permanganat. Només una quantitat limitada és absorbida pels intestins, però aquesta petita quantitat mostra efectes greus sobre els ronyons i el fetge.[12][13]
L'exposició al manganès als Estats Units està regulada per l'Administració de seguretat i salut laboral (OSHA).[14] Les persones poden estar exposades al manganès al lloc de treball respirant-lo o empassant-se'l. OSHA ha establert el límit legal (límit d'exposició admissible) per a l'exposició al manganès en el lloc de treball en 5 mg/m³ durant una jornada laboral de 8 hores. L'Institut Nacional de Seguretat i Salut Laboral (NIOSH) ha establert un límit d'exposició recomanat (REL) d'1 mg/m³ durant una jornada laboral de 8 hores i un límit a curt termini de 3 mg/m³. A nivells de 500 mg/m³, el manganès és immediatament perillós per a la vida i la salut.[15]
En general, l'exposició a concentracions d'aire ambiental de Mn superiors a 5 μg Mn/m3 pot provocar símptomes induïts per Mn. L'augment de l'expressió de la proteïna ferroportina a les cèl·lules del ronyó embrionari humà (HEK293) s'associa amb una disminució de la concentració intracel·lular de Mn i una citotoxicitat atenuada, caracteritzada per la inversió de la captació de glutamat reduïda amb Mn i una disminució de la fuita de lactat deshidrogenasa.[16]
Notes
[modifica]- ↑ En els parlars orientals.
- ↑ En els parlars occidentals.
Referències
[modifica]- ↑ Erikson, Keith M. «Chapter 10. Manganese: Its Role in Disease and Health». A: Sigel. Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. 19. Berlín: de Gruyter GmbH, 2019, p. 253–266. DOI 10.1515/9783110527872-016. ISBN 978-3-11-052691-2.
- ↑ Emsley, John. «Manganese». A: Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, UK: Oxford University Press, 2001, p. 249–253. ISBN 978-0-19-850340-8.
- ↑ Roth, Jerome. «Chapter 6 Manganese Homeostasis and Transport». A: Banci. Metallomics and the Cell. 12. Springer, 2013, p. 169–201 (Metal Ions in Life Sciences). DOI 10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4.
- ↑ 4,0 4,1 4,2 4,3 4,4 Kloprogge, J. Theo. The periodic table : nature's building blocks : an introduction to the naturally occurring elements, their origins and their uses. Amsterdam: Elsevier, 2021. ISBN 978-0-12-821538-8.
- ↑ «manganès». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Barthelmy, David. «Mineral Species sorted by the element Mn Manganese». Mineralogy Database, 1997-2014. [Consulta: 4 maig 2023].
- ↑ Emsley, John. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ «Manganese Statistics and Information» (en anglès). U.S. Geological Survey, 01-01-2023. [Consulta: 4 maig 2023].
- ↑ Hasan, Heather. Manganese. The Rosen Publishing Group, 2008, p. 31. ISBN 978-1-4042-1408-8.
- ↑ «Manganese Chemical Background». Metcalf Institute for Marine and Environmental Reporting University of Rhode Island, 01-04-2006. Arxivat de l'original el 28 agost 2006. [Consulta: 30 abril 2008].
- ↑ «Risk Assessment Information System Toxicity Summary for Manganese». Oak Ridge National Laboratory. [Consulta: 23 abril 2008].
- ↑ Ong, K. L.; Tan, T. H.; Cheung, W. L. Emergency Medicine Journal, 14, 1, 1997, pàg. 43–45. DOI: 10.1136/emj.14.1.43. PMC: 1342846. PMID: 9023625.
- ↑ Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P. Human & Experimental Toxicology, 15, 3, 1996, pàg. 259–61. DOI: 10.1177/096032719601500313. PMID: 8839216.
- ↑ «Safety and Health Topics: Manganese Compounds (as Mn)». U.S. Occupational Safety and Health Administration. Arxivat de l'original el 2017-08-01. [Consulta: 15 maig 2023].
- ↑ «NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)». Centers for Disease Control. [Consulta: 19 novembre 2015].
- ↑ Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M. Journal of Neurochemistry, 112, 5, 2010, pàg. 1190–8. DOI: 10.1111/j.1471-4159.2009.06534.x. PMC: 2819584. PMID: 20002294.
Vegeu també
[modifica]| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||














