Tioredoxina
Les tioredoxines (Trx) són una família de proteïnes petites (12 kDa) trobades en un gran nombre d'espècies, tant en procariotes com d'eucariotes. Laurest T.C. el 1963, va obtenir la primera Trx en extreure-la de E. Coli, però va ser Moore E.C., el 1967, qui va descriure primer la Trx de mamífer al purificar-la d'un hepatoma de Novijoff. Més tard, altres investigadors les han reportat amb diferents noms com: interleucina-1 (IL-1), citosina produïda pel virus d'Epstein-Barr, factor derivat de la leucèmia de cèl·lules T adultes; això no obstant, totes aquestes proteïnes presenten la mateixa seqüència d'aminoàcids, per la qual cosa totes són tioredoxines.
La Trx està implicada en un gran nombre de funcions cel·lulars en els mamífers. Dins de la cèl·lula, la seva activitat es pot analitzar depenent de la seva localització; així, en el citoplasma actua com a antioxidant i cofactor; en el nucli modula la regulació de l'activitat dels factors de transcripció, i en el mitocondri té una funció important en la supervivència cel·lular durant el desenvolupament embriogènic. La Trx també pot exercir la seva activitat fora de la cèl·lula en estimular el creixement cel·lular i la quimiotaxis.
Les proteïnes de la família de les Trx presenten un lloc catalític conservat, en el qual dos cisteïnes, la 32 i la 35 es troben en forma de ditiol (-SH)2 en l'enzim reduït (Trx-[SH]2). Aquestes cisteïnes són les encarregades d'experimentar el procés d'oxidació reversible a disulfat de cisteïna mitjançant la transferència d'equivalents reductors, i generar l'espècie oxidada de l'enzim (Trx-S2).
La reacció per regenerar la Trx reduïda (Trx-[SH]2) és catalitzada per l'enzim Trx reductasa (Trx-R), que és una flavoproteïna dependent de NADPH+H.
El mecanisme d'acció de l'enzim Trx és el següent: la proteïna substrat (X-S2) que s'ha de reduir, s'uneix a la superfície hidròfoba de la Trx-[SH]2; en aquest lloc, on hi ha un ambient hidròfob, el grup tiol de la Cis32 actua com un nucleòfil, ja que es combina amb el X-S2 de forma covalent (Trx-Cis32-S-S-X). Posteriorment, la Cis35 dona el seu protó i reacciona amb la Cis32-S-S-X, alliberant la proteïna substrat reduïda (X-[SH]2), i formant a la Trx oxidada (Trx-[S]2), la qual és llavors reduïda per la Trx-R, dependent de NADPH. El NADPH+H s'oxida a NADP+ al cedir els protons a la Trx-[S]2 per poder-se regenerar a la forma Trx-[SH]2.
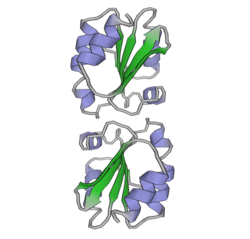
Estructura de la Trx
[modifica]Hi ha diversos membres de la família de les Trx en els mamífers i en altres espècies, se sap que la Trx és una proteïna globular compacte amb cinc cadenes β plegades que tenen un centre hidrofòbic envoltat per quatre hèlix α sobre la superfície externa. Els residus aminoacídics del centre actiu són molt conservats: -Trp-Cis32-Gli-Pro-Cis35-Lis-. S'ha vist que serveix per unir la segona cadena β plegada a la segona hèlix α i formar la primera volta de la segona hèlix. Aquesta estructura terciària és molt estable i es coneix com la "Trx plegada".[6]
Trx-1
[modifica]S'ha colonat la Trx-1 humana, així com la del pollastre, ratolí, rata i boví, i es va trobar que és una proteïna de 104 aminoàcids amb un pes molecular de 12 kDa. Una característica és que algunes d'elles presenten la metionina en l'extrem N-terminal. La Trx-1 humana i d'altres mamífers contenen, a més dels dos residus de Cis en el centre catalític, altres tres residus de cisteïna, la Cis62, Cis69 i Cis73, les quals poden conferir propietats biològiques úniques a la Trx-1 de mamífers.
El gen per la Trx-1 humana es localitza sobre les bandes 9q32 en el cromosoma 9, mentre que el gen de la Trx-1 de ratolí es troba en el segon quart proximal del Cr 4, que és homòleg a la localització 9q32 del cromosoma humà.
L'estructura cristal·lina de la Trx-1 humana ha revelat una conformació dimèrica en la qual els monòmers estan units a través d'un pont disulfur entre les Cis73 de cada subunitat, mentre que els residus del centre actiu estan reduïts. El dímer conté una interfase hidrofòbica gran (100Ǻ), amb cinc ponts d'hidrogen a més de l'enllaç disulfur. En la interfase dimèrica es localitzen 12 aminoàcids de cada monòmer, 10 dels quals no varien en animals superiors, incloent Cis73. L'aparent constant de dissociació per la formació de dímers no covalents sota condicions de reducció varia entre 6 i 166μM a pH de 3.8 i 8, respectivament.
Es desconeix si la formació del dímer passa sota condicions fisiològiques pel fet que l'associació és relativament feble, i no està clar el paper del dímer de Trx-1, ja que el centre actiu, en romandre tancat, no és un substrat de la reducció per la Trx-R i no estimula el creixement cel·lular. D'altra banda, encara no s'ha aconseguit determinar la concentració local de Trx-1 humana en teixits, però es creu que els valors són aproximadament de 2 a 12μM.
Trx-2
[modifica]Es va identificar una segona Trx una mica més llarga en els mitocondris del cor de porc, i se li va denominar Trx-2. Aquest enzim té 166 aminoàcids, i pesa 18 kDa. Presenta un centre catalític conservat, però sense els tres residus extres de Cis trobats a la Trx-1 de mamífers. L'extensió N-terminal de 60 aminoàcids de la Trx-2 exhibeix característiques consistents amb el senyal de translocació mitocondrial. Pel que sembla, té un lloc de probable ruptura, el que donaria dos fragments: una proteïna d'uns 12.2 kDa, i un altre fragment que contindria el centre catalític. S'ha demostrat que aquest fragment petit té activitat catalítica i redueix la insulina, i és reduït al seu torn per la Trx-R i NADPH+H.
p32TrxL
[modifica]Un tercer tipus de tioredoxina és la p32TrxL, formada per una Trx a la qual uneix una proteïna citosòlica de 32 kDa, aquesta Trx va ser clonada d'una biblioteca de cDNA de testicle humà. La proteïna té una seqüència de 289 aminoàcids, amb un domini Trx N-Terminal de 105 aminoàcids, un centre actiu Trx conservat (-Cis-Gli-Pro-Cis-) i un alt grau d'homologia amb la Trx-1 humana. La seqüència del romanent és de 184 aiminoàcids en l'extrem C-terminal, i aquest no presenta homologia a altres proteïnes consultades en una base de dades. La proteïna p32TrxL s'expressa en tots els teixits humans, amb concentracions més altes en l'estómac, testicle i medul·la òssia. Això no obstant, ni la longitud completa de p32TrxL ni el fragment N-terminal de 105 o 107 aminoàcids són reduïts per la Trx-R i NADPH+H, el que suggereix que no està involucrada en processos antioxidants.
Localització subcel·lular de les Trx
[modifica]La Trx-1 és predominantment una proteïna citosòlica, i encara que no tingui una seqüència de localització nuclear, s'ha detectat en el nucli de les cèl·lules de l'estroma de l'endometri normal, en les cèl·lules tumorals i en tumors sòlids primaris. El tractament de les cèl·lules amb H2O2, PMA (parametoxianfetamina), radiacions UV, hipòxia i l'anticancerigen cisplatí, causen la translocació de la Trx-1 des del citoplasma cap al nucli. El mecanisme d'aquesta translocació no és ben conegut, però pot ser una conseqüència que la Trx-1 sigui portada i enllaçada a altres proteïnes amb una seqüència nuclear. La Trx-1 també s'associa a membranes cel·lulars o plasmàtiques presumiblement al costat de la superfície externa. La Trx-2 es troba preferentment en els mitocondris, mentre que la p32TrxL és una proteïna citosòlica.
Estabilitat de la Trx
[modifica]Els estudis estructurals de la forma oxidada i reduïda d'E.coli i humanes mostres que les Trx presenten una estructura global molt similar, amb algunes diferències conformacionals en regions properes al centre actiu i del centre actiu en si.
Quan la E.coli redueix la Trx, la temperatura tèrmica de desnaturalització es troba prop dels 12 °C. Estudis de desnaturalització amb guanidina i urea han demostrat que la reducció de ponts disulfurs en el centre actiu redueix l'estabilitat de la Trx natives al voltant de 10-12.5 kJ/mol a pH neutre. Aquests canvis de la Trx de la E.coli són massa bruscos en relació amb el petits canvis estructurals que pateix la proteïna. El comportament d'una altra Trx quan s'oxida o es redueix, sembla molt similar. Una possible explicació es troba en els canvis significatius de les propietats dinàmiques després de la reducció i les diferències de comportament en l'intercanvi d'hidrogen i del volum específic parcial. A partir de dades experimentals, al disminuir la temperatura de desnaturalització tèrmica de la proteïna indica una disminució de l'estabilitat en la reducció, possiblement causada per la disminució en el nombre de donadors d'hidrògens que normalment augmenten les barreres energètiques en l'intercanvi de protons. Com que les estructures de l'oxidació i reducció de la Trx de la E.coli s'ha comprovat que són molt similars, és possible que alteracions en la capa de solvatació de la superfície de la proteïna tinguin un paper molt important en la producció dels canvis de volum específic (aparent i compressiu) de la Trx. Aquest fet suggereix la importància que té aquesta capa situada al voltant de la proteïna en conferir-li estabilitat. El paper de l'energia de solvatació en el plegament i unió de les proteïnes són temes interessants en la recerca d'avui dia, raó per la qual les Trx són bons models per les investigacions.[7]
Senyal d'oxidació (en estudi)
[modifica]L'alta concentració d'espècies reactives de l'oxigen (ROS) en cèl·lules impliquen l'activació dels diferents sistemes antioxidants per restablir l'estat redox que contribueix a unes millors condicions fisiològiques. D'altra banda, s'ha comprovat que en certs nivells, les ROS actuen com a segons missatgers en la cascada de transducció de senyal en alguns processos de les cèl·lules de les plantes. A la llum d'aquest esdeveniment, s'ha proposat la reavaluació del concepte d'estrès oxidatiu cap ha "senyal d'oxidació". Aquest concepte implica tots els mecanismes cel·lulars que permeten que les cèl·lules actuïn a la vegada amb les condicions ambientals. Diversos sistemes cel·lulars estan implicats en aquest paper, i s'ha demostrat que les Trx estan implicades en nombroses vies metabòliques relacionades en la regulació de l'equilibri redox. Per aquest motiu s'ha realitzat estudis on s'han descrit dos Trx de pèsols del grup H-clusters, PsTrxH1 i PsTrxH2, que són antagònics i participen en el control de la reacció redox a través de la seva interacció amb les proteïnes diana. Considerant les dades obtingudes en l'estudi, les conclusions que es van treure sobre el comportament de les dos Trx es deu a la seva interacció amb diferents proteïnes diana com les peroxiredoxines (Prx): quan els nivells de ROS augmenten de manera dràstica, les cèl·lules experimenten grans desequilibris redox o fins i tot poden arribar a patir un estrès oxidatiu. En aquesta situació, tots els mecanismes antioxidants han de ser activats, incloent-hi l'augment d'expressió de PsTrxH1 i quantitats de proteïna, donant lloc a una desintoxicació cel·lular eficient. En condicions d'equilibri redox, PsTrxH2 podria actuar interaccionant amb alguns punts de les proteïnes. No obstant això, l'objectiu fisiològic de les PsTrxH2 no està descrit ni estudiat.
Els resultats de l'estudi suggereixen que el seu paper en el control redox és mitjançant la producció de la sensibilitat cap a agents oxidants, permeten uns certs nivells fisiològics de les ROS en les cèl·lules.[8]
Tioredoxina reductases
[modifica]
Les tioredoxines reductases (Trx-R) són els únics enzims coneguts capaços de reduir el centre actiu de les Trx. Les Trx-R de mamífers són proteïnes homodímeres de 316 residus que contenen dinucleòtid de flavina i adenina amb un residu de seleni-cisteïna en el penúltim C-terminal, un centre actiu –Cis-Val-Asn-Val-Gli-Cis-, i experimenten reaccions d'oxidoreducció. La selenicisteïna és essencial per l'activitat de la Trx-R en mamífers, encara que la Trx humana pot ser relativament reduïda per la Trx-R bacteriana que no conté selenicisteïna.
Dues Trx-R humanes s'han clonat en tota la seva longitud: la Trx-R-1 de 54.4 kDa, la qual és predominantment citosòlica, i la Trx-R-2 de 56.2 kDa, amb una extensió de 33 aminoàcids en l'extrem N-terminal identificada amb una important seqüència mitocondrial.
Les tioredoxines evolucionen com proteïnes xaperones, ja que la seva funció està implicada en el manteniment de l'estructura dels grups ditiol/disulfit de les proteïnes. Com ja hem esmentat anteriorment, la seqüència d'aminoàcids altament conservada conté 2 cisteïnes al centre actiu. Aquestes cisteïnes, són oxidades cap a un grup disulfur duran la transferència de dos equivalents que es redueixen des de Trx fins a una proteïna objectiu que conté un grup disulfur. Els disulfurs dels centres actius que resulten de Trx-1 i Trx-2 són reduïts per TR1 i TR2 que, respectivament utilitza electrons des de NADPH. Tanmateix, Trx-1 té tres residus de cisteïna addicionals a més dels dos que té situats en el centre actiu, mentre que la Trx-2 no en té.
Els residus de cisteïna addicionals en Trx-1 estan situats en un bucle en proximitat al centre actiu, es poden oxidar conduint a la formació de dímers i una subsegüent pèrdua d'activitat catalítica. La major resistència a l'oxidació que presenta la Trx-2 respecte a la Trx-1 pot ser resultat de l'absència d'aquests residus de cisteïna addicionals, encara que no està demostrat per a totes les substàncies oxidants. Aquesta diferència en la resistència d'inactivació de l'oxidació també es pot explicar per la gran expressió que té tal Trx-2 en teixits amb alta activitat metabòlica, i pot conferir funcions reguladores i/o protectores importants.[9]
A més de les Trx, s'ha demostrat que també són substrats de la Trx-R els següents: àcid lipoic, hidroperòxids lipídics, pèptids citotòxics, Lisina-NK, vitamina K3, àcid deshidroasòrbic, radical ascorbil i la proteïna supressora de tumors p53. Això no obstant, el paper fisiològic que desenvolupa la Trx-R en la reducció de la major part d'aquests substrats encara no es coneix. Algunes de les funcions de la Trx-R antioxidant, síntesi de DNA i transcripció de gens.
Com que l'activitat d'aquest enzim és essencial pel creixement cel·lular i la supervivència, és un blanc per a la investigació de teràpies antitumorals. Per altra banda, l'enzim és regulat positivament en diferents tipus de càncer, inclòs el mesotelioma maligne. Per exemple, el motexafin gadolinio (MGD) és un nou agent quimioterapèutic que selectivament té com a blanc cèl·lules tumorals, que condueixen a la mort cel·lular i a l'apoptosi a través de la inhibició de la tiorredoxina reductasa i la ribonucelòtid reductasa.
Tioredoxina peroxidases
[modifica]
Les tioredoxina peroxidases (Trx-P) pertanyen a una família de proteïnes conservades que tenen funcions antioxidants a les que se les denomina peroxiredoxines (Prx).
Les Prx es troben distribuïdes per tot l'organisme de tots els regnes, i formen part de 0.1 a 0,8% del total de les proteïnes solubles. Existeixen com homodímers i contenen un residu Cis conservat en l'extrem N-terminal, que és el primer lloc d'oxidació pel H2O2. En el seu mecanisme d'acció, les Prx utilitzen equivalents de reducció que són subministrats per les proteïnes que contenen grups tiol. Fins ara, s'han identificat sis isoformes de Prx en els mamífers, i s'han classificat en tres subgrups de proteïnes: 2-Cis (Prx I, II, III i IV), 2-Cis atípics (Prx V) i 1-Cis (Prx VI). Pel que fa al subgrup de 2-Cis, es coneix que la I i la II es localitzen en el citosol, la III en el mitocondri i la IV en el reticle endoplasmàtic i l'espai extracel·lular.
La primera Prx a ser identificada va ser la proteïna antioxidant específica de grups tiol (TSA, per les sigles en anglès) en llevats i mamífers, la qual protegeix l'activitat de la glutamina sintetasa i la integritat del DNA. En 1994, la Trx va ser reconeguda com a donador d'electrons per la TSA, i va ser redenominada com a tioredoxina peroxidasa, la qual pertany al grup 2-Cis.
Activitats biològiques de les Trx
[modifica]Activitat antioxidant
[modifica]La principal activitat de la Trx és la capacitat d'actuar com agent antioxidant pel fet que pot funcionar com a cofactor mantenint diverses Trx-P en una forma reduïda. Una altra propietat de la Trx resulta de reducció de la glutatió peroxidasa (GPx), la inducció de la superòxid dismutasa de manganès (MnSOD) i d'alguna manera, de la reducció directa del H2O2. La S-nitrosilació de la Cis69 de la Trx és una important modificació postraduccional, la qual cosa incrementa la seva activitat antioxidant.
A més d'eliminar el H2O2 en forma directa, la Trx-1 pot donar electrons a la GPx del plasma humà, on la concentració de Trx-1 és propera a 6nM. Però, no s'ha d'oblidar que el plasma conté nivells de l'ordre d'1 μM de glutatió reduït (GSH) i de proteïnes reduïdes que proveeixen una capacitat amortidora addicional als grups tiol, de manera que la Trx-1 en el plasma contribueix en menor escala a l'activitat antioxidant.
La forma reduïda de la Trx (Trx-[SH]2) actua sobre espècies oxidants com el H2O2 i els peròxids alquílics, i durant el procés es formen homodímers o heterodímers amb altres membres de la família a través d'enllaços disulfur entre els residus de cisteïna conservats. Posteriorment, la Trx-P transforma la Trx oxidada a una forma monomèrica. Es tenen registres que cèl·lules endotelials humanes transfectades amb Trx-1 presenten una protecció contra la citotoxicitat induïda pel H2O2 i l'adhesió de monòcits ocasionada per la inflamació.
S'ha pensat que la Trx-1 exerceix la major part de les seves propietats antioxidants en les cèl·lules a través de la Trx-P. S'han trobat Trx-P com a protectors antioxidant en eritròcits de sang humana. Així mateix, la transfecció de cèl·lules leucèmiques Molt-4 amb la Trx-P-2 les protegeix de l'apoptosi induïda per privació de sèrum, ceramida i etopòsid, i inhibeix l'alliberació del citocrom c des del mitocondri durant l'apoptosi.
Un altre mecanisme per eliminar H2O2 de cèl·lules és a través del glutati peroxidasa (GPx) que conté selenicisteïna, la qual utilitza GSH amb fonts equivalents reductores. Pel que se sap, el sistema redox de GSH i la Trx no estan acoblats dins de la cèl·lula, però el seleni té diferents efectes sobre els sistemes de la Trx i la GPx. El Se incrementa l'activitat de la GPx, però no del glutatió reductasa (GR). Així, en presència excessiva de peròxids, un increment en la disponibilitat del seleni pot predir elevats nivells de Trx reduïda relativa a GSH.
Factor de creixement
[modifica]La Trx-1 actua com un factor de creixement, i és produïda per una varietat de cèl·lules, incloent les cèl·lules B transformades-EBV, hibridoma de cèl·lules T MP6 i cèl·lules de hepatoma. La Trx-1 és secretada per limfòcits, hepatòcits, fibroblasts i una varietat de cèl·lules canceroses. Com la Trx-1 no té una seqüència guia, el mecanisme pel qual la secreció passa sembla implicar un camí independent del realitzat a través del reticle endoplasmàtic-Golgi. Però, tot i que la Trx-1 estimula el creixement de limfòcits, fibroblasts normals i una varietat de línies cel·lulars tumorals, sembla que el mecanisme d'estimulació és diferent al d'un factor de creixement convencional, ja que no s'han trobat receptors de Trx-1. Per altra banda, la Trx-1 també sembla sensibilitzar les cèl·lules cap a alguns factors de creixement produïts per la mateixa cèl·lula. Per exemple, en les cèl·lules de càncer de mama MCF-7, la Trx-1 evita que proliferin quan s'administra insulina 1 i el factor de creixement epidèmic, mentre que amb la IL-2 la proliferació augmenta 1000 vegades i amb el factor de creixement de fibroblasts bàsics, 100 vegades.
La Trx-1 també incrementa l'expressió cel·lular a les interleucines: IL-1, IL-2, IL-6, IL-8 i al factor de necrosis tumoral α (TNF- α).
Cofactor
[modifica]En els bacteris, la Trx actua com a cofactor de diversos enzims, ja que intervé en la reducció d'equivalents per la ribonucleòtid reductasa, enzim encarregat de catalitzar la conversió dels nucleòtids en desoxinucleòtids requerits per la síntesi de DNA. En el cas de la ribonucleòtid reductasa de les eucariotes, es coneix poc respecte al paper de la Trx-1 en la reducció d'equivalents, ja que pot haver altres fonts per a això.
Regulador de factors de transcripció
[modifica]S'ha pogut comprovar que la Trx-1 és capaç de promoure la unió d'alguns factors de transcripció al DNA. Entre aquests factors s'ha determinat el factor nuclear қB (NF- қB), el qual és un factor important en la resposta cel·lular a l'estrès oxidatiu, a l'apoptosi i als processos de tumorigenicitat.
Un altre dels factors de transcripció més estudiats és la proteïna activadora 1 (AP-1), que en activar-se incrementa el creixement cel·lular. Aquesta activació es dona mitjançant la reducció d'un residu Cis, i encara que la Trx-1 no la redueix directament, sinó a través d'una altra proteïna nuclear (Ref-1), s'ha comprovat que les cèl·lules que sobreexpressen la Trx-1 incrementen l'activació d'AP-1. Altres factors en els quals s'ha determinat que la Trx-1 augmenta la seva unió al DNA són AP-2, proteïna p53, receptors d'estrogens, receptors de glucocorticoides i factors de transcripció PEBP2/CBF.
Proteïna d'enllaç
[modifica]La Trx-1 s'enllaça a una varietat de proteïnes cel·lulars (ref-1, ASK1, PKC α, β, ε i ζ, NF-қB, receptors de glucocorticoides, p40 phox, lipocalina). L'enllaç es dona amb la Trx reduïda, però no amb l'oxidada; el mecanisme no es coneix del tot, però implica la formació de ponts disulfur entre les cisteïnes del centre catalític de la TRx i de les altres proteïnes.
Inhibició de l'apoptosi
[modifica]S'ha trobat que en afegir a la Trx-1 al medi de cèl·lules limfoides en cultiu es prevé l'apoptosi induïda per L-cisteïna i el consum de GSH. També s'ha comprovat que la Trx-1 protegeix a les cèl·lules de leucèmia limfocitica crònica tipus B, contra l'apoptosi associada amb un increment en la secreció del factor de necrosi tumoral α (TNF-α), el qual és un factor de creixement autocri per aquestes cèl·lules. A més, en les cèl·lules limfoides WEHI7.2 de ratolí que sobreexpressen Trx-1 humana es va inhibir l'apoptosi induïda per agents com: dexametasona, taurosporina, tapsigargina o etopósid.[10] La inhibició de l'apoptosi ocasionada per la transfecció amb Trx-1 és similar a l'ocasionada per la transfecció de l'oncogèn antiapoptópic bcl-2; però, es desconeix com es dona el mecanisme i només s'ha establert que la Trx-1 interacciona amb ASK1 i el NF- қB.
Funció de la Trx en les malalties humanes
[modifica]Trx i càncer
[modifica]Estudis recents han demostrat una sobreexpressió de la Trx en alguns tumors cancerosos, en comparació amb els teixits normals. Pel que sembla, en etapes primerenques del desenvolupament del càncer, la Trx fa una acció benèfica, ja que neutralitza l'estrés oxidatiu, el qual s'associa amb els diferents agents que promou el càncer. No obstant això, en estats avançats d'aquesta malaltia, la Trx promou el creixement cel·lular dels tumors, anul·lant així i fins i tot sobrepassant, l'efecte benèfic que va exercir en un principi.
A més, atès que els diversos agents anticancerosos actuen induint l'apoptosi en les cèl·lules neoplàsiques, els efectes antiapoptótics que fa la Trx redueixen l'efectivitat de les estratègies de la quimioteràpia. De fet, actualment diferents agents quimioterapèutics tenen com a blanc alguns dels components del sistema de les Trx, i es troben sota estudi altres agents anticancerosos amb activitat inhibitòria sobre les Trx.
Trx en malalties virals
[modifica]La participació de les Trx en les malalties d'origen viral, i en particular en la del virus de la immunodeficiència humana (VIH), és complexa. Igual que en el desenvolupament del càncer, la Trx es presenta com un agent que pot exercir tant efectes protectors com efectes que poden arribar a ser deleteris.
Els individus infectats per VIH pateixen serioses alteracions en l'equilibri redox i en conseqüència, els nivells d'estrés oxidatiu són alts. Una de les primeres observacions en relació amb els nivells de la Trx en pacients amb VIH va ser que disminuïen de manera ràpida amb una infecció aguda. Una possible explicació d'aquest fet és que els virus evadeixen les defenses immunes de l'hoste i escapen de l'eliminació pels macròfags, provocant una pèrdua massiva de sulfur, el qual altera la síntesi de les proteïnes que continguin cisteïna. Precisament, com és el cas de la Trx i de la Trx-R; però, i de manera contrastant, en estats avançats de la infecció per VIH, la concentració de la Trx en plasma s'incrementa, ja que el virus indueix l'expressió de la Trx. S'ha comprovat que prop del 25% dels pacients amb VIH presenten nivells incrementats de Trx-1, en comparació amb els trobats en el plasma dels pacients control. Les concentracions elevades de la Trx podrien inhibir la replicació viral, en part pels canvis en l'estat redox i en els enllaços bisulfit de CD4, un membre de la superfamília de les immunoglobulines que a més és un receptor primari pel VIH-1. Però, les altes concentracions de la Trx en pacients immunocompromesos poden resultar perjudicials, atès que impedeixen la funció dels neutròfils, disminuint la resistència a la infecció.
Trx en malalties cardíaques
[modifica]Existeixen diferents estudis respecte a la funció de la Trx en diferents patologies cardíaques, com: miocarditis, hipertròfia cardíaca i infart de miocardi; però existeix un consens sobre el paper de la Trx en aquestes patologies, ja que la seva funció pot variar. Així, la dicotomia o l'efecte dual de la Trx es posa de manifest en el cas de la hipertròfia cardíaca. L'activitat antioxidant de la Trx protegeix al cor de l'estrés oxidatiu. Això no obstant, la Trx també és un mediador essencial en el creixement dels cardiomiòcits, contribuint d'aquesta manera a la hipertròfia del cor.
Kishimoto et al. (2001), van comprovar que les concentracions de la Trx en el sèrum es troben incrementades en els pacients amb síndromes coronaris aguts, i això correlaciona de manera positiva amb la severitat de la malaltia segons la classificació de l'associació per a malalties cardíaques: New York Herat Association. Aquests resultats suggereixen una possible associació entre la secreció de la Trx i la severitat del dany en el cor.
Trx i envelliment
[modifica]L'estrés oxidatiu es troba lligat al procés de l'envelliment; en conseqüència, els efectes antioxidants de les Trx, juntament amb els factors antiapoptòtics, així com l'acció de les Trx en la promoció del creixement, semblen exercir protecció contra canvis cel·lulars que tenen un paper clau en el manteniment de la metionina, la qual és activa en la seva forma reduïda.[10] La pèrdua d'aquest procés natural de reducció està associada al desenvolupament de malalties neurològiques com la de l'Alzheimer.
Trx i sistema nerviós
[modifica]S'ha demostrat que la Trx exerceix un efecte citoprotector en el sistema nerviós per un increment en l'acció del factor de creixement neuronal (NGF) regulat per la regulació anti-apoptòtica, així com per l'activitat antioxidant. El NGF té profunds efectes en les neurones, inclosa la promoció de la via de senyalització de supervivència i diferenciació. La Trx sembla se un cofactor neurotròfic que incrementa l'efecte del NGF en la regeneració i en la diferenciació neuronal.
Els individus amb la malaltia de l'Alzheimer presenten una disminució en les concentracions de Trx-1, particularment en l'amígdala i en l'hipocamp, i al mateix temps, la Trx-R s'incrementa. S'ha suggerit que aquests canvis poden contribuir en l'augment de l'estrés oxidatiu i en conseqüència, a la neurodegeneració observada en aquesta malaltia.
Referències
[modifica]- ↑ «Fàrmacs amb els quals interactuen físicament amb Tioredoxina, vegeu/editeu les referències a wikidata».
- ↑ 2,0 2,1 2,2 GRCh38: Ensembl release 89: ENSG00000136810 - Ensembl, May 2017
- ↑ 3,0 3,1 3,2 GRCm38: Ensembl release 89: ENSMUSG00000028367 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «The origami of thioredoxin-like folds». Protein Sci, 15, 10, 2008, p. 12217-27.
- ↑ Stefanková P, Kollárová M, Barák I. Thioredoxin - structural and functional complexity= Gen Physiol Biophys. 24, 2005, p. 3-11.
- ↑ Traverso JA, Vignols F, Chueca A. Thioredoxin and Redox Control within the New Concept of Oxidative Signaling.= Plant Signal Behav. 2, 2007, p. 426-7.
- ↑ Mustacich D, Powis G. Thioredoxin reductase= Biochem J. 15, 2000, p. 1-8.
- ↑ 10,0 10,1 Watson WH, Yang X, Choi YE, Jones DP, Kehrer JP. Thioredoxin and its role in toxicology= Toxicol Sc. 78, 2004, p. 3-14.
Bibliografia
[modifica]- Mina K. Fainstein: Radicales libres y estrés oxidativo. Aplicaciones médicas. Manual Moderno, 2008, ISBN 978-970-729-321-2