Diòxid de carboni
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 43,99 Da |
| Descobridor o inventor | Jan van Helmont, Joseph Black i Joseph Priestley |
| Trobat en el tàxon | |
| Rol | vasodilatador, conservant, agent fermentant, fluid refrigerant, gas hivernacle i metabòlit primari |
| Estructura química | |
| Fórmula química | CO₂ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 1,9768 g/m³ (a 0 ℃, gas) 925 g/m³ (a 0 ℃, líquid) 1.560 g/m³ (a −78,5 ℃, sòlid) |
| Velocitat del so | 259 m/s (0 ℃, gas) |
| Solubilitat | 0,2 g/100 g (aigua, 25 ℃) |
| Moment dipolar elèctric | 0 D |
| Temperatura de sublimació | −78,5 ℃, −78 ℃ i −78,4 ℃ |
| Entropia molar estàndard | 213,7 J/(mol K) |
| Moment dipolar elèctric | 0 D |
| Entalpia estàndard de formació | 394 kJ/mol |
| Entalpia de vaporització | 16,7 kJ/mol |
| Pressió de vapor | 56,5 atm (a 20 ℃) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 9.000 mg/m³ (10 h, Estats Units d'Amèrica) |
| Límit d'exposició a curt termini | 54.000 mg/m³ (cap valor) |
| IDLH | 72.000 mg/m³ |
| Potencial d'escalfament global | 1 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El diòxid de carboni (antigament anomenat biòxid de carboni i anhídrid carbònic) és una substància molecular constituïda per carboni i oxigen de fórmula química . A temperatura ambient es presenta en forma de gas incolor, inodor i insípid. És present a l'atmosfera de la Terra en baixa concentració i en les aigües dissolt en forma d'àcid carbònic, . En concentracions altes pot provocar intoxicació per diòxid de carboni.[1] És indispensable per a la vida; els vegetals i les algues mitjançant la fotosíntesi el redueixen per l'acció combinada la clorofil·la i la llum, i produeixen composts orgànics i oxigen. És un dels productes de la combustió dels materials orgànics i de la respiració, tant dels animals com dels vegetals. Per altra banda, és un dels gasos de l'atmosfera que manté la temperatura de la Terra gràcies a l'efecte d'hivernacle, essent el segon gas amb efecte d'hivernacle més important, després del vapor d'aigua. L'augment actual de la seva concentració atmosfèrica, deguda a l'ús de combustibles fòssils (carbó, petroli i gas natural) i la desforestació, està produint l'escalfament global del planeta. S'han establert normatives internacionals i grups de treball, com el Protocol de Kyoto, la Convenció Marc sobre el Canvi Climàtic o el Grup Intergovernamental sobre el Canvi Climàtic, per a intentar reduir aquest augment.
Història
[modifica]
Cap al 1630, el científic flamenc Jan Baptist van Helmont (1580-1644) descobrí que certs vapors es diferenciaven de l'aire, que en aquell moment es pensava que eren una sola substància o element químic. Van Helmont encunyà el terme gas (alteració del mot llatí chaos, 'caos') per descriure aquests vapors i recollí el que es produïa cremant llenya, anomenant-lo spiritus sylvestrus, per la qual cosa Van Helmont és reconegut com el descobridor del diòxid de carboni. Observà, també, que es produïa en la fermentació del vi i d'altres processos naturals. Poc temps després, altres científics detectaren similituds entre els processos de respiració i combustió. Així descobriren que la flama de les espelmes s’extingirà quan es tanca en una gerra amb un subministrament limitat d’aire, o que en les mateixes condicions moria un ocell o animal petit.[2]
El 1756, el químic escocès Joseph Black (1728-1799) anomenà el diòxid de carboni aire fix, perquè és absorbit per una dissolució d'hidròxid de calci donant carbonat de calci segons l'equació:
El 1764 demostrà que es produïa per la respiració. Black pujà al sostre d’una església de Glasgow, que havia sigut ocupada durant unes deu hores de devoció religiosa per una congregació de 1500 persones, i mesurà l'àcid fix que havia exhalat la diligent i adormida congregació. Però fou el químic francès Antoine-Laurent Lavoisier (1743-1794) qui establí definitivament l'excreció de diòxid de carboni després de la seva formació en el metabolisme, tot i que pensà erròniament que es formava als pulmons.[3] Black descobrí, també, que està present a l’atmosfera, determinà que era un gas més pesant que l’aire i caracteritzà el seu comportament químic com el d’un àcid feble. Els pioners treballs de van Helmont i Black motivaren altres científics en l'estudi dels gasos, com ara el químic i físic anglès Henry Cavendish (1731-1810), el químic suec Carl Wilhelm Scheele (1742-1786)) i altres químics.[2]

El primer ús pràctic del diòxid de carboni fou inventat pel químic anglès Joseph Priestley (1733-1804) a mitjans dels anys 1700. Priestley havia repetit els experiments de Black mitjançant el gas produït per la fermentació de gra i demostrà que tenia les mateixes propietats que l'aire fix. Quan Priestley dissolgué el gas en l'aigua, trobà que creava una beguda refrescant amb un sabor lleugerament agre. Fou la primera aigua artificialment carbonatada, coneguda com a aigua gasosa o seltzer.[2]
El 1783, el científic francès, Pierre Simon de Laplace (1749-1827) utilitzà un conill de rata per demostrar quantitativament que l’oxigen de l’aire s’utilitza per cremar carboni emmagatzemat al cos i produeix diòxid de carboni en l’alè exhalat. A la dècada de 1770, el fisiòleg holandès Jan Ingen-Housz (1730-1799) establí els principis de la fotosíntesi que ajudaren a explicar la superstició antiga que les plantes purifiquen l’aire durant el dia i l'enverinen durant la nit.[2]
El químic anglès John Dalton (1766-1844) determinà el 1803 que la molècula de diòxid de carboni conté un àtom de carboni i dos àtoms d’oxigen.[2] El 1834 el francès Charles Thilorier (1797-1852) obtingué per primera vegada diòxid de carboni sòlid. El seu ús comercial s'inicià en la dècada del 1920. El 1924 l'empresa estatunidenca Prest Air Devices of Long Island encunyà el terme gel sec per referir-se al diòxid de carboni sòlid.[4]
Estat natural
[modifica]Atmosfera
[modifica]
El diòxid de carboni és un dels gasos presents a l'atmosfera de la Terra. L'agost del 2019 la proporció de a l'atmosfera de la Terra estava al voltant d'un 0,0410 % en volum (exactament 409,95 µL/L o ppmv)[5] o un 0,0620 % en pes de . Com que la massa de l'atmosfera és de 5,14×1018 kg[6] això representa aproximadament 3,2×1012 tones de en el conjunt de l'atmosfera. A causa de l'àrea més gran de terra a l'hemisferi nord i, per tant, a una major superfície vegetal en comparació amb l'hemisferi sud, hi ha una fluctuació anual d'uns 5 µL/L, culminant el maig i arribant a un mínim l'octubre al final de l'estació de creixement de l'hemisferi nord, quan la quantitat de biomassa al planeta és més gran. Malgrat la seva petita concentració, el és un component molt important de l'atmosfera de Terra, perquè absorbeix la radiació infraroja a les longituds d'ona de 4,26 µm i 14,99 µm i realça per tant l'efecte d'hivernacle.
El diòxid de carboni atmosfèric prové de diferents fonts. Els volcans i guèisers llancen diòxid de carboni a l'atmosfera de manera natural mesclat amb altres substàncies, les combustions de masses vegetals són també una font natural del diòxid de carboni atmosfèric, així com la respiració d'animals i plantes. per altra banda, des de la revolució industrial hi ha una aportació antropogènica de diòxid de carboni que prové del consum de combustibles fòssils (carbó, petroli i gas natural) així com un augment de la combustió natural de vegetals.
Oceans
[modifica]Els oceans de la Terra contenen una quantitat enorme de diòxid de carboni en forma d'ions hidrogencarbonat i carbonat , molt més que la quantitat existent en l'atmosfera. L'hidrogencarbonat es produeix en reaccions químiques entre les roques, l'aigua, i el diòxid de carboni. Un exemple és la dissolució de carbonat de calci:
Aquestes reaccions tendeixen a amortir els canvis en el atmosfèric. Les reaccions entre diòxid de carboni i roques no-carbonatades com els silicats també afegeixen hidrogencarbonat als mars:
que poden més tard sofrir l'invers de la reacció citada per formar roques de carbonat, però alliberant només la meitat del , consumida en la primera reacció. En el transcurs de centenars de milions d'anys això ha produït quantitats enormes de roques de carbonat, i ha enretirat la major part del diòxid de carboni de l'atmosfera. Si totes les roques de carbonat a l'escorça terrestre es convertissin de nou en diòxid de carboni, el diòxid de carboni resultant pesaria 40 vegades tant com la resta de l'atmosfera actual i l'atmosfera de la Terra seria semblant a la del planeta Venus.
Altres planetes
[modifica]
En els planetes Venus i Mart del sistema solar s'ha detectat la presència abundant de diòxid de carboni a les seves atmosferes. Venus conté una densa atmosfera, composta en la seva major part per diòxid de carboni (96,5 %) i una petita quantitat de nitrogen (3,5 %). La pressió al nivell de la superfície és 90 vegades superior a la pressió atmosfèrica en la superfície terrestre (una pressió equivalent a una profunditat d'un quilòmetre sota el nivell del mar a la Terra). L'enorme quantitat de de l'atmosfera provoca un fort efecte d'hivernacle que eleva la temperatura de la superfície del planeta fins a prop de 460 °C a les regions menys elevades prop de l'equador. Això fa que Venus sigui més calent que Mercuri, malgrat trobar-se a més del doble de la distància del Sol que aquest i de rebre només el 25% de la seva radiació solar.[7]
L'atmosfera de Mart està constituïda en un 95,32 % per diòxid de carboni, però és molt tènue, amb una pressió superficial de només 7 a 9 mil·libars enfront dels 1 033 mbars de l'atmosfera terrestre. Això significa que és només una centèsima part de la terrestre. Els casquets polars de Mart són formats per una capa molt prima de gel de i, especialment el casquet sud, per una altra capa més ampla de gel d'aigua. En l'estiu austral, el diòxid de carboni se sublima per complet, deixant una capa residual de gel d'aigua. En cent anys d'observació, el casquet polar sud ha desaparegut dues vegades per complet, mentre el nord no ho ha fet mai.[8]
També s'ha descobert en algunes atmosferes d'exoplanetes, com ara en la del HD 189733b, un Júpiter ardent en la qual atmosfera fou descobert el 2008 per primera vegada fora del sistema solar.[9]
Estructura de la molècula i del gel sec
[modifica]
L'estructura química de la molècula de diòxid de carboni consta d'un àtom central de carboni unit amb dos dobles enllaços covalents als dos àtoms d'oxigen, els tres alineats en línia recta (angle entre enllaços 180°) segons el model . Segons la teoria d'enllaç de valència el carboni presenta dos orbitals atòmics híbrids que formen els dos enllaços σ amb els dos oxígens, amb orbitals híbrids . El carboni té també dos orbitals p no hibridats, cadascun forma un enllaç π amb un orbital p d'un dels oxígens. Cada enllaç C=O té una longitud de 116,3 pm i una energia de 750 kJ·mol−1, considerablement alta si la comparam amb els enllaços C=C, C–O i C–H.[10] La longitud total de la molècula és de 0,24 nm.[11]
L'electronegativitat de l'oxigen és 3,5 i la del carboni 2,5, aquesta diferència fa que els electrons dels enllaços estiguin desplaçats cap a l'oxigen, l'element més electronegatiu, donant lloc a un enllaç polaritzat. Malgrat que els enllaços presenten polaritat, no presenta dipol elèctric a causa de la seva simetria que anul·la els dos moments dipolars oposats dels dos enllaços.[12]

En estat sòlid se'l pot trobar formant diferents estructures o fases en les quals les molècules apolars de es troben unides mitjançant les febles forces de dispersió de London (dipol instantani - dipol induït), per la qual cosa la seva temperatura de fusió és molt baixa (–78,5 °C). L'estructura de la fase I és la del gel sec. La seva cel·la elemental és cúbica (grup espacial ) amb arestes iguals de longitud aproximada 0,55 nm que conté 4 molècules de . En ella els enllaços covalents C=O tenen una longitud de 116,8 pm, molt semblant a la longitud d'enllaç de la molècula lliure.[13]
Les fases d’alta pressió i temperatura són especialment importants per comprendre els interiors dels planetes i la formació d’estrelles. Fins al moment se n'han identificat 7 de diferents. Les fases I, III i VII són sòlids moleculars típics, mentre que les fases V i VI són fases esteses similars a les del diòxid de silici . La fase II és una fase intermediària mal entesa i la fase IV encara no està ben estudiada.[14][15]
Propietats químiques i físiques
[modifica]
A temperatura ambient és un gas incolor, inodor i insípid la qual densitat a 25 °C és d'1,98 kg/m³, al voltant d'1,65 vegades la de l'aire, la qual cosa fa que aquest gas tingui tendència a acumular-se en les parts fondes. A temperatures per sota –78 °C el diòxid de carboni es troba en forma d'un sòlid blanc anomenat gel sec. El diòxid de carboni líquid es forma només a pressions superiors a 5,1 atm; a pressió atmosfèrica, passa directament de la fase sòlida a la fase gasosa en un procés anomenat sublimació.[4]
Com que ja està completament oxidat (nombre d'oxidació IV pel carboni), no és gaire reactiu i, en particular, no és inflamable. Inhalat a altes concentracions produeix un gust àcid a la boca i una sensació picant al nas i la gola. Aquests efectes són produïts pel gas que es dissol en les membranes mucoses i a la saliva, formant una solució feble d'àcid carbònic, . La molècula de diòxid de carboni és apolar i sembla que hauria de ser poc soluble en aigua, però també és un àcid de Lewis, la qual cosa li permet acceptar una parella d'electrons de l'oxigen de l'aigua donant àcid carbònic incrementant la seva solubilitat. La reacció es pot representar per:[4]

L'àcid carbònic en dissolució experimenta dues dissociacions que donen lloc als equilibris químics:[4]
Les concentracions relatives de cada espècie química depenen del pH. En aigua neutra o una mica alcalina (pH > 6,5), la forma hidrogencarbonat predomina, mentre que en aigua molt alcalina l'anió predominant és el carbonat . L'hidrogencarbonat i el carbonat són molt solubles en aigua, de tal manera que l'aigua de l'oceà en equilibri amb l'aire (lleugerament alcalina amb un pH típic 8,2-8,5) conté al voltant de 120 mg d'hidrogencarbonat per litre, equivalent al contingut en 130 litres d'aire. L'aigua de pluja també duu dissolt diòxid de carboni, la qual cosa fa que tengui un pH àcid, al voltant d'un valor de 5,6. Aquesta acidesa produeix la dissolució de les roques calcàries i dona lloc al modelatge càrstic.[16]
La valorització del com a reactiu químic rep actualment una atenció considerable i creixent per part de la comunitat científica. No obstant això, l'ús del encara és problemàtic pel fet de ser la forma més oxidada del carboni, i perquè és termodinàmicament estable i/o cinèticament inert en les transformacions desitjades. En conseqüència, la majoria dels estudis coneguts utilitzen substrats altament reactius i/o condicions de reacció severes per activar el , limitant la seva aplicació. En particular, l’acoblament catalític de amb substrats rics en energia, com ara epòxids i aziridines, per generar policarbonats/policarbamats i/o carbonats/carbamats cíclics ha despertat una atenció important durant les últimes dècades. Per crear enllaços C-C amb , l'ús de nucleòfils de carboni es limita específicament a organolits nucleòfils forts i reactius Grignard, així com a fenolats. Juntament amb el ràpid desenvolupament de la química i catàlisi organometàl·lica, s'han descobert diversos tipus de transformacions de eficients en síntesi orgànica durant les últimes dècades, millorant molt la seva eficàcia i aplicabilitat.[17]
Obtenció
[modifica]Diferents mètodes s'empren per obtenir diòxid de carboni en quantitats industrials. Obtenir-lo directament de l'atmosfera no és viable degut a la seva baixa concentració.
1) Combustió del carbó de coc o d'altres composts de carboni. En aquest procés cal concentrar el diòxid de carboni i separar-lo d'altres gasos que també es produeixen mitjançant reaccions paral·leles d'impureses del carbó o si el reactiu no és carbó. L'equació és:

2) Descomposició tèrmica de carbonats, com ara el carbonat de calci que s'escalfen a temperatures entre 500 °C i 900 °C. També s'obté òxid de calci :
3) La fermentació de glúcids com la glucosa per obtenir etanol dona com a producte secundari diòxid de carboni:
Finalment, hi ha d'altres processos que obtenen diòxid de carboni com a subproducte, com ara el procés Haber-Bosch de síntesi d'amoníac.[4]
Fotosíntesi
[modifica]
La fotosíntesi és un conjunt de reaccions bioquímiques que realitzen diversos procariotes (cianofícies i alguns bacteris) i totes les plantes verdes per tal de sintetitzar composts orgànics, mitjançant l'energia lumínica, a partir del diòxid de carboni i d’una substància (generalment l’aigua) capaç de cedir hidrogen.[18] És un procés fonamental per a la vida en la Terra. L'equació química global pot representar-se com:
Tanmateix, té lloc mitjançant un cert nombre d'etapes complexes. En la fase fosca de la fotosíntesi l'enzim RuBisCO captura el de l'atmosfera terrestre i mitjançant el cicle de Calvin-Benson es converteix en molècules orgàniques de 3 àtoms de carboni, que seran després transformades en glucosa . La fixació de carboni produeix un producte intermediari, que és convertit en els glúcids d'hexosa finals. Aquests glúcids són utilitzats per a formar altres productes orgànics, com la cel·lulosa, els precursors de la biosíntesi dels lípids i dels aminoàcids o combustible en la respiració cel·lular.[18]
Usos
[modifica]Indústria alimentària
[modifica]
El diòxid de carboni en estat líquid i sòlid (gel sec) s'empra majoritàriament com a refrigerant, especialment en el sector alimentari, durant el transport i emmagatzematge de gelats i altres aliments congelats. El diòxid de carboni s'utilitza també per produir begudes carbonatades bombollejant dins l'aigua, des de la dècada dels 1790, en què fou comercialitzada la primera beguda d'aquest tipus per l'industrial alemany Johann Jacob Schweppe (1740-1821).[4] El caramel anomenat Peta Zetas es pressuritza amb gas de diòxid de carboni a aproximadament 40 atm. Quan posem el caramel a la boca, es dissol (just com qualsevol altre caramel dur) i allibera les bombolles de gas amb un "pop" audible. La gasificació de la cervesa i el cava es produeix durant fermentació natural, però alguns fabricants carbonaten aquestes begudes artificialment, però el producte és d'inferior qualitat.
El diòxid de carboni també s'empra per fer més esponjoses de pans, coques i pastissos. S'empren llevats de dos tipus: els formats per microorganismes, com el llevat de forner que produeixen el diòxid de carboni per fermentació dels glúcids presents a la massa:
i els químics, que produeixen el diòxid de carboni per la descomposició d'hidrogencarbonat de sodi, a causa de l'escalfor o a l'exposició a àcids.
Indústria química
[modifica]
Un dels usos més importants del diòxid de carboni és la producció de carbonat de sodi monohidrat (sosa) . S'empra el procés Solvay que permet produir el carbonat de sodi mitjançant una sèrie de reaccions a partir de carbonat de calci i clorur de sodi intervenint el diòxid de carboni en dues etapes. Del carbonat de sodi es pot obtenir l'hidrogencarbonat de sodi a partir de la reacció:[4]
S'empra la reacció de Sabatier per obtenir gas metà a partir del diòxid de carboni i hidrogen a temperatures entre 300 °C i 400 °C en presència d'un catalitzador de níquel, ruteni, rodi o d'òxid d'alumini. És una reacció que també s'empra a l'Estació Espacial Internacional per eliminar el i recuperar aigua.[19]
El diòxid de carboni ha començat a atreure atenció en les indústries de processament químiques farmacèutiques i altres com a alternativa menys tòxica als dissolvents organoclorats. En estat supercrític és un bon dissolvent per a molts composts orgànics, i s'utilitza àmpliament per extreure la cafeïna del cafè i obtenir cafè descafeïnat; per a la desnicotinatzió del tabac; per a la desodorització d’olis i greixos; per a l'extracció d'olis vegetals, espècies, fragàncies naturals, colorants naturals, etc.[20]
Gas inert
[modifica]
El diòxid de carboni s'utilitza sovint com un gas pressuritzat barat, no inflamable. Les armilles salvavides i els bots salvavides, sovint contenen bombones pressuritzades de diòxid de carboni per al seu inflament ràpid,[21] també les rampes d'evacuació dels avions,[22] en pistoles i rifles de gas comprimit[23] i per a inflar pneumàtics de bicicletes.[24] Com que no és inflamable extingeix flames, s'empren extintors dissenyats per a focs elèctrics, ja que tampoc és conductor del corrent elèctric, que contenen diòxid de carboni líquid a pressió.[25]
La soldadura MAG (Metal Active Gaswelding) és un tipus de soldadura que utilitza un gas protector químicament actiu (diòxid de carboni, argó més diòxid de carboni o argó més oxigen). El material d'aportació té forma de tija molt llarga i és subministrat contínuament i de manera automàtica per l'equip de soldadura. S'utilitza bàsicament per a acers no aliats o de baix aliatge. No es pot usar per a soldar acers inoxidables ni alumini o aliatges d'alumini.[26]
El diòxid de carboni s'injecta comunament a pous de petroli. Serveix com a agent que pressuritza i, quan és dissolt al cru subterrani, redueix significativament la seva viscositat, permetent al petroli fluir més ràpidament a través de la terra fins al pou d'extracció. En jaciments petrolífers madurs, s'utilitzen extenses xarxes de canonades per portar el diòxid de carboni als punts d'injecció.[27]
El ha sigut utilitzat com a gas refrigerant des del 1866, essent durant les dècades de 1920 i 1930 quan fou més utilitzat. A partir de la dècada de 1930 disminuí el seu ús degut a la introducció del freó-12. Després del 1996, quan el protocol de Montreal prohibí l'ús de CFCs com a refrigerants degut a l'efecte de destrucció de la capa d'ozó, el fou recuperat com a gas refrigerant especialment en sistemes de refrigeració industrial. En aquest camp se'l coneix com gas R-744.[28]
Agricultura
[modifica]Les plantes precisen de diòxid de carboni per realitzar la fotosíntesi, i els hivernacles poden enriquir les seves atmosferes amb addicional per tal d'estimular el creixement de les plantes. A més els nivells alts de diòxid de carboni en l'atmosfera permeten exterminar eficaçment moltes plagues, per aquest motiu els hivernacles augmenten el nivell de a 10 000 ppm (un 1%) durant unes quantes hores per eliminar plagues com la mosca blanca, àcars i altres. S'ha proposat emprar el diòxid de carboni que actualment s'emet en les centrals elèctriques és borbollejat a basses per cultivar algues que es podrien llavors convertir en biocombustible dièsel.[29]
Làser de CO₂
[modifica]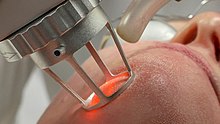
El làser de diòxid de carboni és un tipus de làser de gas destacable per la seva gran potència. Fou un dels primers làsers de gas que es desenvoluparen i segueix sent un dels làsers més utilitzats ja que ofereixen la potència més alta en funcionament continu (no polsat). També és un dels làsers més eficients, amb una eficiència de fins al 20%. Emet en l'infraroig amb dues bandes principals a unes longituds d'ona de 9,4 μmi 10,6 μm. S'utilitzen àmpliament en aplicacions industrials de tall i soldadura, com ara a la indústria automobilística, i en procediments quirúrgics, ja que l'aigua dels teixits biològics absorbeix molt bé les freqüències infraroges del làser de diòxid de carboni.[30]
El problema de l'increment del CO2 a l'atmosfera
[modifica]
L'agost del 2019 la proporció de a l'atmosfera de la Terra estava al voltant d'un 0,0410 % en volum (exactament 409,95 µL/L o ppmv)[5] o un 0,0620 % en pes de . Com que la massa de l'atmosfera és de 5,14×1018 kg[6] això representa aproximadament 3,2×1012 tones de en el conjunt de l'atmosfera. A causa de l'àrea més gran de terra a l'hemisferi nord, i per tant a una major superfície vegetal en comparació amb l'hemisferi sud, hi ha una fluctuació anual d'uns 5 µL/L, culminant el maig i arribant a un mínim l'octubre al final de l'estació de creixement de l'hemisferi nord, quan la quantitat de biomassa al planeta és més gran. Malgrat la seva petita concentració, el és un component molt important de l'atmosfera de Terra, perquè absorbeix la radiació infraroja a les longituds d'ona de 4,26 µm i 14,99 µm i realça per tant l'efecte d'hivernacle.


El diòxid de carboni té un potencial d'escalfament global (PEG) igual a 1, ja que aquest potencial és definit com l'escalfament produït per un kilogram d'un gas en 100 anys agafant com a unitat l'escalfament produït pel . És el gas d'efecte d'hivernacle amb menor poder d'escalfament (21 pel metà, 310 per l'òxid de dinitrogen o 23 900 per l'hexafluorur de sofre), però la seva alta concentració respecte a les d'aquests altres gasos fa que el sigui el responsable del 63,5 % de l'efecte d'hivernacle.[31]
Les emissions antropogèniques són actualment de 28 mil milions de tones, això representa només un 5% del flux de total a l'atmosfera, però és suficient per a crear una acumulació d'aquest gas, ja que no existeixen embornals suficients per a ell. Des del començament de la revolució industrial, la concentració de atmosfèric ha augmentat en aproximadament 110 µL/L o aproximadament un 40%, la majoria d'aquest augment s'ha produït des de 1945. Les mesures mensuals preses a Mauna Loa[32] des de 1958 mostren un augment de 316 ppmv en aquell any a 410 ppmv el 2019, un augment global de 94 µL/L durant la història de 61 anys de les mesures. La crema de combustibles fòssils (carbó, petroli i gas natural) és la causa principal de l'augment del antropogènic; la desforestació és la segona causa essencial, especialment la produïda en països tropicals per a l'expansió de l'explotació forestal, l'agricultura, la ramaderia i en menor mesura la mineria. Per exemple els incendis forestals a Indonèsia de l'any 1997 poden haver alliberat per si sols una proporció del 13% al 40% de l'emissió de feta pels combustibles fòssils aquell any.
No tot el emès roman en l'atmosfera; una part se n'absorbeix als oceans, a la biosfera i en les roques. La raó entre el emès i l'augment de atmosfèric es coneix com la fracció aerotransportada; aquesta varia en períodes curts de temps però és típicament d'un 57% en un període de 5 anys.
Captura de
[modifica]Per intentar frenar l'acumulació de a l'atmosfera i evitar el canvi climàtic s'han proposat diverses tècniques per captar i emmagatzemar diòxid de carboni evitar emetre'l a l'atmosfera i retenir-lo en embornals de diòxid de carboni. Actualment hi ha tres mètodes de captura del :
Postcombustió
[modifica]L'objectiu de la postcombustió és separar el dels gasos produïts en la combustió d'un combustible fòssil (carbó, petroli o gas natural). Es duu a terme mitjançant la reacció amb aminoalcohols que, en reaccionar amb el , donen lloc a carbamats. Els aminoalcohols emprats són l'etanolamina o 2-aminoetan-1-ol , la dietanolamina i la diisopropanolamina. Amb la primera la reacció és:
Precombustió
[modifica]La captura de en el procés de precombustió està basada en una reacció en la qual intervenen un combustible fòssil i oxigen (o aire). La tècnica de precombustió té per objectiu descarbonitzar el combustible, i separar el i l'hidrogen , fent que aquest després pugui ser utilitzat com a combustible, com per exemple, en turbines de gas, piles de combustible, etc. En aquesta mena de mètodes de captura de diòxid de carboni s'obté un gas de síntesi, també anomenat syngas, que està compost per hidrogen i monòxid de carboni . Aquest syngas es pot obtenir mitjançant diferents processos (reformat amb vapor d'aigua, oxidació parcial i reformat autotèrmic).[33] La reacció a partir de metà per reformat en vapor d'aigua és:
Durant la combustió
[modifica]En aquest cas, la reacció de combustió es duu a terme amb oxigen pur en lloc d'utilitzar aire, eliminant així la presència de nitrogen i provocant que els productes de la combustió siguin exclusivament i . És important tenir en compte que el fet d'usar oxigen pur provoca que la temperatura de la flama sigui molt alta. Aquesta elevada temperatura pot reduir-se recirculant qualsevol dels dos productes de la reacció. L'oxigen utilitzat en aquest tipus de processos sol produir en processos de baixa temperatura separant l'aire. Això implica un cost elevat referenciat als equips utilitzats i també a l'energia necessària per separar l'oxigen de l'aire.[33]
Emmagatzematge de
[modifica]
Per transportar el diòxid de carboni des del punt de captura fins al d'emmagatzematge es poden emprar gasoductes si la distància és curta o vaixells cisterna quan la distància sigui gran. Quant a l'emmagatzemament n'hi ha de tres tipus:
Emmagatzematge geològic
[modifica]Es pot emmagatzemar el en tres formacions geològiques diferents: jaciments de petroli i gas, formacions salines profundes i capes de carbó inexplorades. En cada cas, l'emmagatzematge geològic de s'aconsegueix mitjançant la seva injecció en forma condensada en una formació rocosa subterrània. Les formacions rocoses poroses que retenen o han retingut fluids anteriorment són candidats potencials per a l'emmagatzematge de . Les formacions aptes per a l'emmagatzematge poden aparèixer en conques sedimentàries terrestres i marítimes. Les capes de carbó també poden utilitzar-se per a l'emmagatzematge de quan sigui poc probable que el carbó sigui explotat posteriorment i sempre que la permeabilitat sigui suficient.[34]
Emmagatzematge oceànic
[modifica]El diòxid de carboni captat es pot injectar directament en els fons marins (més de mil metres de profunditat). Això s'aconsegueix mitjançant el transport de per gasoductes o vaixells a un lloc d'emmagatzematge oceànic, on s'injecta i la columna d'aigua de l'oceà o en els fons marins. Posteriorment, el dissolt i dispers es convertirà en part del cicle global del carboni. L'emmagatzematge oceànic segueix en fase d'investigació; no obstant això, s'han realitzat experiments a petita escala, així com estudis teòrics i de laboratori.[34]
Carbonatació mineral
[modifica]La carbonatació mineral fa referència a la fixació del diòxid de carboni mitjançant l'ús d'òxids alcalins i alcalinoterris, com ara l'òxid de magnesi i l'òxid de calci , que estan presents en les roques de silicats de formació natural. Les reaccions químiques que es produeixen entre aquests materials i el produeixen compostos com el carbonat de magnesi i el carbonat de calci. Així doncs, la carbonatació produeix, entre altres, carbonats que es mantenen estables durant llargs períodes i impedeixen que el sigui alliberat a l'atmosfera.[34] La reacció amb òxid de calci es pot representar com:
Tanmateix els òxids de calci i de magnesi rarament se'ls troba presents a la natura i se'ls obté a partir de minerals constituïts per silicats (serpentina, olivina, talc i wol·lastonita). Els silicats poden ser atacats per l'àcid carbònic que es produeix en reaccionar el diòxid de carboni amb l'aigua perquè és un àcid més fort que l'àcid silícic . Tots aquests minerals són abundants a l'escorça terrestre, els dos primers contenen magnesi i els altres dos calci. El procés de carbonatació amb la serpentina segueix les següents etapes:[35]
Variació en el passat
[modifica]El mètode més directe per mesurar les concentracions de diòxid de carboni atmosfèriques per a períodes en què el mostreig directe no fou possible és analitzant les bombolles d'aire (fluid o inclusions de gas) atrapat als casquets glacials de l'Antàrtida o Groenlàndia. Els estudis més àmpliament acceptats s'han fet amb testimonis antàrtics i indiquen que els nivells de atmosfèrics es trobaven entre els 260-280 ppmv immediatament abans que les emissions industrials comencessin i s'havien mantingut en aquest nivell durant els darrers 10 000 anys.

El registre de gel més llarg prové d'Antàrtida Oriental, on s'ha extret gel d'una edat de 650 000 anys abans del present[36] (1950 per convenció). Durant aquest temps, la concentració de diòxid de carboni atmosfèrica ha variat entre 180-210 ppmv durant les glaciacions, augmentant fins a 280-300 µL/L durant els períodes interglacials més calents.
Alguns estudis han discutit l'afirmació que els nivells de s'han mantingut estables durant el present interglacial (els darrers 10 000 anys). Basat en una anàlisi de fulles fòssils s'ha deduït que els nivells de durant el període de 7 000 a 10 000 anys B.P. eren significativament més altes (~300 µL/L) i contenien substancials oscil·lacions que es poden relacionar amb variacions del clima.[37] D'altres autors han discutit aquestes deduccions, suggerint que és més probable que reflecteixin problemes de calibratge que els canvis reals en la concentració de .[38] Pertinent a aquesta disputa és l'observació que els testimonis de gel de Groenlàndia sovint informin de nivells de més alts i més variables que mesures similars fetes a l'Antàrtida. Tanmateix, els grups responsables de tals mesures creuen que les variacions en els testimonis de Groenlàndia resulten de la descomposició in situ de la pols del carbonat de calci que es trobava en el gel.[39] Quan els nivells de pols de carbonat en els testimonis de Groenlàndia són baixos, com gairebé sempre ho són en els testimonis de l'Antàrtic, els investigadors comuniquen que hi ha un bon acord entre les mesures de de Groenlàndia i l'Antàrtida.

Per a períodes més remots, s'han utilitzat diferents mètodes per intentar determinar els nivells de diòxid de carboni atmosfèrics presents fa milions d'anys. Aquests inclouen les proporcions d'isòtops de bor i carboni en certs tipus de sediments marins, i el nombre d'estomes observat en fulles de plantes fòssils. Si bé aquestes mesures donen estimacions molt menys precises de la concentració de diòxid de carboni que els testimonis de gel, hi ha encara una forta evidència a favor de concentracions de molt altes (>3 000 ppmv) entre 600 i 400 m.a. BP i entre 200 i 150 m.a. BP.[40]
En escales de temps molt llargues, el contingut de atmosfèric està determinat per l'equilibri entre els processos geoquímics incloent-hi l'enterrament de carboni orgànic en sediments, la meteorització de les roques de silicat, i el vulcanisme. L'efecte net de desequilibris lleugers en el cicle de carboni durant milions d'anys ha estat reduir la concentració del atmosfèric. Les velocitats d'aquests processos són extremadament lentes; per això són de pertinència limitada per a resoldre el problema de l'excés de atmosfèric en períodes de cent anys.
En períodes més recents, la concentració de atmosfèrica va continuar caient després d'aproximadament 60 m.a. BP, i hi ha evidència geoquímica que les concentracions ja eren de <300 ppmv fa aproximadament 20 m.a. BP. Les concentracions de baixes poden haver estat l'estímul que hagi afavorit l'evolució de les plantes de C4, que van augmentar en gran manera la seva abundància en el període compres fa entre 7 i 5 m.a. BP. Si bé les concentracions de contemporànies són probablement les més altes dels darrers 20 milions d'anys,[41] encara no són tan elevades com varen ser fa uns 50 milions d'anys. Estudis actuals han intentat determinar com varen ser les condicions del planeta en el passat amb tan altes concentracions de i els resultats es poden classificar com a sorprenents: Una anàlisi dels sediments mostra que les aigües tropicals de l'Atlàntic tenien una temperatura d'uns 35 °C fa entre 100 i 84 milions d'anys, enfront dels 25 °C que tenen en l'actualitat.[42] Uns altres sondejos recents mostren que fa 55 milions d'anys l'Àrtic tenia una mitjana de temperatura d'uns 25 °C, i per tant gaudia d'un clima tropical com el de Florida.[43]
Vegeu també
[modifica]- Reacció Bosch
- Cicle del carboni
- Monòxid de carboni
- Gel sec
- Escalfament global
- Gasos d'efecte d'hivernacle
- Identitat de Kaya
- Llac Kivu
- Llac Nyos
- Llac meromíctic
- Champagne Pool
- Acidificació de l'oceà
Referències
[modifica]- ↑ Permentier, Kris; Vercammen, Steven; Soetaert, Sylvia; Schellemans, Christian «Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department». International Journal of Emergency Medicine, 10, 04-04-2017.
- ↑ 2,0 2,1 2,2 2,3 2,4 «Carbon dioxide». The Gale Encyclopedia of Science [Consulta: 18 setembre 2019].
- ↑ «Carbon dioxide». The Oxford Companion to the Body, 18-09-2019.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Myers, Richard L. (Richard Leroy), 1951-. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007, p. 68-69. ISBN 9780313080579.
- ↑ 5,0 5,1 US Department of Commerce, NOAA. «ESRL Global Monitoring Division - Global Greenhouse Gas Reference Network» (en anglès). [Consulta: 20 setembre 2019].
- ↑ 6,0 6,1 «Global atmospheric mass, surface pressure, and water vapor variations». JOURNAL OF GEOPHYSICAL RESEARCH, 2008. Arxivat de l'original el 2008-08-30. [Consulta: 24 abril].
- ↑ Science, Nola Taylor Redd 2018-10-18T22:23:00Z; Astronomy. «Venus' Atmosphere: Composition, Climate and Weather» (en anglès). [Consulta: 23 setembre 2019].
- ↑ Science, Tim Sharp 2017-09-12T01:24:00Z; Astronomy. «Mars' Atmosphere: Composition, Climate & Weather» (en anglès). [Consulta: 23 setembre 2019].
- ↑ «CO2 Found on Exoplanet» (en anglès), 13-12-2008. [Consulta: 23 setembre 2019].
- ↑ Shaya, Janah; Srour, Hassan; Karamé, Iyad. Introductory Chapter: An Outline of Carbon Dioxide Chemistry, Uses and Technology (en anglès). InTech, 2018-08-16. DOI 10.5772/intechopen.79461. ISBN 9781789235746.
- ↑ De Graef, Marc.. Structure of materials : an introduction to crystallography, diffraction and symmetry. Cambridge: Cambridge University Press, 2007. ISBN 9780521651516.
- ↑ Nahar, Lutfun, 1969-. Chemistry for pharmacy students : general, organic, and natural product chemistry. 2a edició. ISBN 9781119394464.
- ↑ Hazen, Robert M.. Carbon in Earth. Boston: De Gruyter, Inc, 2018. ISBN 9781501508318.
- ↑ Yoo, C. S.; Cynn, H.; Gygi, F.; Galli, G.; Iota, V. «Crystal Structure of Carbon Dioxide at High Pressure: “Superhard” Polymeric Carbon Dioxide» (en anglès). Physical Review Letters, 83, 26, 27-12-1999, pàg. 5527–5530. DOI: 10.1103/PhysRevLett.83.5527. ISSN: 0031-9007.
- ↑ Sun, J.; Klug, D. D.; Martonak, R.; Montoya, J. A.; Lee, M.-S. «High-pressure polymeric phases of carbon dioxide» (en anglès). Proceedings of the National Academy of Sciences, 106, 15, 14-04-2009, pàg. 6077–6081. DOI: 10.1073/pnas.0812624106. ISSN: 0027-8424.
- ↑ Gallego Picó, Alejandrina.. Contaminacion atmosférica.. UNED - Universidad Nacional de Educación a Distancia, 2000. ISBN 9788436265231.
- ↑ Liu, Qiang; Wu, Lipeng; Jackstell, Ralf; Beller, Matthias «Using carbon dioxide as a building block in organic synthesis» (en anglès). Nature Communications, 6, 1, 5-2015. DOI: 10.1038/ncomms6933. ISSN: 2041-1723.
- ↑ 18,0 18,1 «fotosíntesi | enciclopèdia.cat». [Consulta: 24 setembre 2019].
- ↑ Administrator, NASA Content. «The Sabatier System: Producing Water on the Space Station» (en anglès), 17-08-2015. Arxivat de l'original el 2021-03-25. [Consulta: 25 setembre 2019].
- ↑ Mukhopadhyay, Mamata.. Natural extracts using supercritical carbon dioxide. Boca Raton, Fla.: CRC Press, 2000. ISBN 9781420041699.
- ↑ Chapman piloting & seamanship. 66th ed. Nova York: Hearst Books, 2009. ISBN 9781588167446.
- ↑ «Tobogán de evacuación» (en castellà), 23-08-2018. [Consulta: 26 setembre 2019].
- ↑ The wildlife techniques manual. 7th ed. Baltimore, Md.: Johns Hopkins University Press, 2012. ISBN 9781421401591.
- ↑ Bortman, Tori.. The bicycling big book of cycling for beginners. ISBN 9781623361655.
- ↑ Fundamentals of fire fighter skills.. 2a edició. Sudbury, Mass.: Jones and Bartlett Publishers, 2009. ISBN 9780763753429.
- ↑ Fortes, Cleber. «Soldadura MIG/MAG» (
 PDF), 25-01-2005.
PDF), 25-01-2005.
- ↑ «CO2 Being Used to Increase Oil Extraction» (en anglès). [Consulta: 25 setembre 2019].
- ↑ Wirz, D. Commercial Refrigeration for Air Conditioning Technicians (en anglès). Cengage Learning, 2017, p. 259. ISBN 9781337514699.
- ↑ Rodríguez Díaz, F. Control y robótica en agricultura. Almería: Universidad de Almería, Servicio de Publicaciones, 2004. ISBN 8482407392.
- ↑ Witteman, W. J.. The CO₂ laser. Berlín: Springer-Verlag, 1987. ISBN 9783540477440.
- ↑ Captura y almacenamiento de CO₂. Saragossa: Prensas Universitarias de Zaragoza, 2010. ISBN 9788416028146.
- ↑ Keeling, C.D.; T.P. Whorf. «Atmospheric carbon dioxide record from Mauna Loa». Arxivat de l'original el 2004-12-10. [Consulta: 19 abril 2006].
- ↑ 33,0 33,1 Suñé Grande, F.J. «Captura y almacenamiento de CO₂ (I)» (en espanyol europeu). [Consulta: 25 setembre 2019].
- ↑ 34,0 34,1 34,2 Suñé Grande, F.J. «Captura y almacenamiento de CO₂ (II)» (en espanyol europeu). [Consulta: 25 setembre 2019].
- ↑ Carbon Dioxide Sequestration in Cementitious Construction Materials. ISBN 9780081024478.
- ↑ «Chemical & Engineering News: Latest News - Ice Core Record Extended».
- ↑ Wagner, Friederike; Bent Aaby and Henk Visscher «Rapid atmospheric O₂ changes associated with the 8,200-years-B.P. cooling event». PNAS, 99, 19, 2002, pàg. 12011–12014. doi:10.1073/pnas.182420699.
- ↑ Indermühle, Andreas; Bernhard Stauffer, Thomas F. Stocker «Early Holocene Atmospheric CO₂ Concentrations». Science, 286, 5446, 1999, pàg. 1815. doi:10.1126/science.286.5446.1815a [Consulta: maig 2001].
- ↑ Smith, H.J.; M Wahlen and D. Mastroianni «The CO₂ concentration of air trapped in GISP2 ice from the Last Glacial Maximum-Holocene transition». Geophysical Research Letters, 24, 1, 1997, pàg. 1–4.
- ↑ «Climate Change 2001: The Scientific Basis». Arxivat de l'original el 2007-04-27. [Consulta: 24 juliol 2006].
- ↑ «Climate Change 2001: The Scientific Basis». Arxivat de l'original el 2006-07-09. [Consulta: 24 juliol 2006].
- ↑ «Ocean Was a Hot Tub in Dino Era | LiveScience».
- ↑ «BBC NEWS | Science/Nature | Arctic's tropical past uncovered».




















![{\displaystyle {\ce {CaCO3(s) ->[\Delta] CaO(s) + CO2(g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82b51c3910b8eee810f8c363410a383c8fac34e9)


![{\displaystyle {\ce {C6H12O6(aq)->[{\text{ferment}}]2C2H5OH(aq){}+2CO2(g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb4a2e7965d60ee47a42c01b5d2872082a3a2010)
![{\displaystyle {\ce {6CO2{}+6H2O->[{} \atop {h\nu }]C6H12O6{}+6O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f26fc1895ffb88fe238f39a3307515228f8cfb6e)



![{\displaystyle {\ce {2 NaHCO3(s) ->[\Delta] Na2CO3(s) + H2O(l) + CO2(g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/954a82dc2ffab668bfe1bce7f34dff368e0bb89f)



![{\displaystyle {\ce {4H2(g){}+CO2(g)->[{} \atop {400\;^{o}C}]CH4(g){}+2H2O(g)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce8989005fb3b2d6b0feb217f6bc5084f8acfd82)












![{\displaystyle {\ce {MgCl2.6H2O(aq)->[{} \atop {250\;^{o}C}]MgCl(OH)(aq){}+HCl(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e47ac9e16d5fab6e8bc8f9b3620b55a4121358ff)


