Magnesi
| Magnesi | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
12Mg
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||
Gris sòlid brillant  Línies espectrals del magnesi | |||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||
| Nom, símbol, nombre | Magnesi, Mg, 12 | ||||||||||||||||||||||||
| Categoria d'elements | Metalls alcalinoterris | ||||||||||||||||||||||||
| Grup, període, bloc | 2, 3, s | ||||||||||||||||||||||||
| Pes atòmic estàndard | 24,3050(6) | ||||||||||||||||||||||||
| Configuració electrònica | [Ne] 3s2 2, 8, 2 
| ||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
1,738 g·cm−3 | ||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
1,584 g·cm−3 | ||||||||||||||||||||||||
| Punt de fusió | 923 K, 650 °C | ||||||||||||||||||||||||
| Punt d'ebullició | 1.363 K, 1.091 °C | ||||||||||||||||||||||||
| Entalpia de fusió | 8,48 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpia de vaporització | 128 kJ·mol−1 | ||||||||||||||||||||||||
| Capacitat calorífica molar | 24,869 J·mol−1·K−1 | ||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||
| Estats d'oxidació | 2, 1[1] (òxid bàsic fort) | ||||||||||||||||||||||||
| Electronegativitat | 1,31 (escala de Pauling) | ||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 737,7 kJ·mol−1 | ||||||||||||||||||||||||
| 2a: 1.450,7 kJ·mol−1 | |||||||||||||||||||||||||
| 3a: 7.732,7 kJ·mol−1 | |||||||||||||||||||||||||
| Radi atòmic | 160 pm | ||||||||||||||||||||||||
| Radi covalent | 141±7 pm | ||||||||||||||||||||||||
| Radi de Van der Waals | 173 pm | ||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| ||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | ||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 43,9 nΩ·m | ||||||||||||||||||||||||
| Conductivitat tèrmica | 156 W·m−1·K−1 | ||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 24,8 µm·m−1·K−1 | ||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) (recuit) 4.940 m·s−1 | ||||||||||||||||||||||||
| Mòdul d'elasticitat | 45 GPa | ||||||||||||||||||||||||
| Mòdul de cisallament | 17 GPa | ||||||||||||||||||||||||
| Mòdul de compressibilitat | 45 GPa | ||||||||||||||||||||||||
| Coeficient de Poisson | 0,290 | ||||||||||||||||||||||||
| Duresa de Mohs | 2,5 | ||||||||||||||||||||||||
| Duresa de Brinell | 260 MPa | ||||||||||||||||||||||||
| Nombre CAS | 7439-95-4 | ||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||
| Article principal: Isòtops del magnesi | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El magnesi és l'element químic de símbol Mg i nombre atòmic 12. És un metall del grup dels alcalinoterris, blanc brillant, d'aspecte semblant a l'argent. És el setè element més abundant a la natura. Fou identificat com a element el 1755 pel químic Joseph Black i aïllat pur per Humphry Davy el 1808. A l'aire sec es manté inalterable, però en presència d'humitat es cobreix d'una capa d'òxid que evita l'oxidació posterior. Amb el foc s'encén amb una flama blanca molt viva. És dúctil i mal·leable, i resulta imprescindible per a la fabricació d'aliatges lleugers, molt útils en aviació.
Història
[modifica]
L'estiu de 1618 Anglaterra sofria una sequera, però quan Henry Wicker, un pastor local, pasturava el seu ramat a la comuna d'Epsom, Surrey, es topà amb una bassa d'aigua de la qual el seu bestiar assedegat es negà a beure. L'aigua tenia un gust amarg i en evaporar-se donava una sal (sulfat de magnesi—aigua(1/7) ) que tenia un efecte notable: era un laxant. Aquesta sal fou coneguda com a sal d'Epsom i s'estengué a tot Europa el seu ús perquè se suposa que curava tota mena de molèsties, però sobretot el restrenyiment. La majoria no s'obtingueren d'Epsom sinó d'altres salmorres riques en magnesi i fins i tot d'aigua de mar.[2]

El 1755 a Edimburg, Escòcia el químic Joseph Black (1728–1799) reconegué que el magnesi era un nou element. Demostrà que la magnèsia (òxid de magnesi, ) no era el mateix que la calç (òxid de calci, ), encara que tots dos es produïen escalfant els seus minerals carbonatats.[2]

Una forma impura de magnesi metàl·lic fou produïda per primera vegada el 1792 pel químic hongarès Anton von Ruprecht (1748–1814) escalfant la magnèsia amb carbó vegetal i l'anomenà «austrium», d'Austria. Una petita mostra del metall fou aïllada per primera vegada pel químic anglès Humphry Davy (1778–1829) el 1808, mitjançant l'electròlisi d'òxid de magnesi. Proposà el nom de «magnium», derivat del mineral magnesita (carbonat de magnesi, ), que provenia de Magnèsia, Tessàlia, Grècia, perquè la paraula «magnesi» s'assemblava massa a «manganès» i portaria a confusió. El seu suggeriment no tengué èxit, i l'element rebé el nom de magnesi.[2]
El científic francès, Antoine-Alexandre-Brutus Bussy (1794–1882), obtingué una quantitat considerable de magnesi metàl·lic el 1831 fent reaccionar clorur de magnesi () amb potassi i en pogué estudiar les seves propietats.[2]
El 1906, el químic alemany Richard Willstätter (1872–1942) demostrà que el magnesi era essencial per a les plantes verdes quan cremà una mica de clorofil·la purificada i obtingué al voltant de l'1,7 % d'un residu de cendra que demostrà que era principalment òxid de magnesi. Descobrí que el resultat era el mateix, sense importar d'on hagués vingut la clorofil·la.[2]
Tot i que al segle xviii se sabia que l'aigua del mar tenia un gust lleugerament amarg a causa del magnesi que contenia, no fou fins al 1941 que la Dow Chemical Company de Texas ideà per primera vegada una manera d'extreure magnesi d'aquesta font i produí un lingot de magnesi.[2]
Abundància i obtenció
[modifica]
El magnesi és el vuitè element més abundant a l'escorça terrestre, amb una concentració del 2,3 %. En el sols la concentració oscil·la entre l'1 i el 2 %, i a l'aigua de la mar és de 1.200 ppm. En el mantell de la Terra és el tercer element més abundant i hi és present en forma de silicats (olivina i piroxè).[2]
Prop de nou-cents minerals contenen magnesi en la seva composició. Els minerals que tenen més del 39 % de magnesi són: periclasi 69,30 %, brucita 41,68 %, hidroxilborita 39,75 %, fluoborita 39,33 % i sel·laïta 39,01 %.[3] Els més importants industrialment són els dipòsits de dolomita, magnesita, brucita, carnal·lita i olivina.
Als Estats Units, el metall s'obté principalment per electròlisi del clorur de magnesi, obtingut de salmorres i aigua de mar, mètode que ja feia servir l'alemany Robert Bunsen:
Propietats
[modifica]Propietats físiques
[modifica]El magnesi és un metall de densitat és 1,738 g/cm³, la més baixa dels metalls, exceptuant la del liti i la del beril·li. Té un punt de fusió de 650 °C i un d'ebullició de 1.090 °C. És dúctil i mal·leable.
Propietats químiques
[modifica]En els composts, el magnesi pràcticament sempre presenta un estat d'oxidació +2 a causa de la pèrdua o compartició dels seus dos electrons 3s. Tanmateix, hi ha un nombre reduït de complexos de coordinació coneguts amb enllaços magnesi-magnesi, LMg-MgL, en els quals els centres de magnesi tenen un estat d'oxidació formal +1.[4]

La superfície del metall de magnesi està coberta amb una fina capa d'òxid que ajuda a protegir el metall dels atacs de l'aire. El potencial de reducció per a la reacció val –2,372 V, un valor prou baix.[5] Un cop encès, el magnesi crema a l'aire amb una flama blanca brillant i encegadora característica per donar una barreja d'òxid de magnesi () i nitrur de magnesi ().[6]
L'òxid de magnesi s'obté habitualment escalfant carbonat de magnesi () i es desprèn diòxid de carboni:[6]

El magnesi no reacciona amb l'aigua. Això contrasta amb el calci, immediatament per sota del magnesi a la taula periòdica, que reacciona lentament amb l'aigua freda. Tanmateix, el magnesi reacciona amb el vapor d'aigua per donar òxid de magnesi, o hidròxid de magnesi, , si hi ha un excés de vapor, i hidrogen.[6]
El magnesi és molt reactiu amb els halògens com el clor o el brom, i hi reacciona per formar els dihalurs clorur de magnesi i bromur de magnesi segons les reaccions:
El magnesi no reacciona amb àlcalis aquosos diluïts, però es dissol fàcilment en àcid sulfúric diluït per formar solucions que contenen l'ió Mg2+ juntament amb el gas hidrogen. Les reaccions corresponents amb altres àcids com l'àcid clorhídric també donen l'ió Mg2+ i hidrogen:[6]
Isòtops
[modifica]El magnesi es troba a la natura com una barreja de tres isòtops: magnesi 24 (79,0 %), magnesi 26 (11,0 %) i magnesi 25 (10,0 %). S'han preparat dinou isòtops radioactius; el magnesi 28 té la vida mitjana més llarga, amb 20,9 hores, i és un emissor β. Tot i que el magnesi 26 no és radioactiu, és el núclid fill de l'alumini 26, que té una vida mitjana de 7,2 × 10⁵ anys. S'han trobat nivells elevats de magnesi 26 en alguns meteorits, i la proporció de magnesi 26 a magnesi 24 s'ha utilitzat per determinar la seva edat.[4] En les inclusions riques en calci i alumini d'alguns meteorits, els objectes més antics del sistema solar, s'han trobat quantitats de Mg-26 més grans que les esperades, que s'atribuïxen a la desintegració de l'Al-26. Aquests objectes, quan s'han desprès en les etapes primerenques de la formació dels planetes i asteroides, no han patit els processos geològics que fan desaparèixer les estructures condrítiques (formades a partir de les inclusions) i, per tant, guarden informació sobre l'edat del sistema solar.
Aplicacions
[modifica]
Indústria metal·lúrgica
[modifica]
La principal aplicació del magnesi és la fabricació d'aliatges amb l'alumini. Les llandes d'aliatge dels automòbils estan fabricades amb magnesi o amb una combinació de magnesi i alumini; el magnesi proporciona més resistència i ajuda a dissipar la calor produïda pel sistema de frenada dels vehicles. També s'utilitza en la fabricació de llaunes de begudes, maquinetes de fer punta, etc. El magnesi forma part dels aliatges que s'empren en la fabricació de bicicletes molt lleugeres, ultralleugers, arcs, fletxes i pals de golf.[7]

L'aliatge elektron ZRE1 combina el magnesi amb el zirconi, el zinc i les terres rares, i el resultat és un producte resistent amb el qual es pot treballar a més de 150 °C per a fabricar peces d'helicòpters tipus Eurocopter i de tota la indústria aeroespacial.[7] L'aplicació de magnesi en la indústria aeroespacial comercial es restringeix generalment als components relacionats amb el motor, ja sigui a causa dels riscos percebuts amb peces de magnesi en cas d'incendi o de corrosió. Actualment, el seu ús està en augment, impulsada principalment per la creixent importància de l'economia de combustible i la necessitat de reduir el pes. El desenvolupament i prova de nous aliatges de magnesi continua, especialment Elektron 21, que ha superat amb èxit els assajos aeroespacials per a la seva utilització en motors i en components interns i bucs.[8][9]

Indústria electrònica
[modifica]El magnesi s'utilitza en la fabricació de xassís per a telèfons mòbils, ordinadors, càmeres fotogràfiques, etc., gràcies a la seva lleugeresa i a les bones propietats mecàniques que posseeix.[7]
Indústria siderúrgica
[modifica]L'òxid de magnesi s'usa com a material refractari en els forns siderúrgics per a la producció d'acers, metalls no ferrosos, vidre i ciment.[7]

Indústria farmacèutica
[modifica]Les preparacions farmacèutiques de magnesi s'utilitzen per a tractar la deficiència de magnesi i hipomagnesèmia, així com l'eclàmpsia. En general, en dosis més baixes, el magnesi s'inclou comunament en preparacions de minerals dietètics, incloent-hi moltes preparacions de multivitamines.
El sulfat de magnesi s'usa en forma de sals de bany, com a laxant, i com un fertilitzant altament soluble. L'hidròxid de magnesi suspès en aigua es fa servir en la llet de magnèsia antiàcida i laxants. El clorur de magnesi i altres sals de magnesi s'empren com a suplements orals del magnesi. El borat de magnesi, salicilat de magnesi i sulfat de magnesi s'utilitzen com a antisèptics. L'estearat de magnesi té propietats lubricants i s'empra en la fabricació de nombrosos tipus de comprimits, per evitar que els comprimits s'enganxin a l'equip durant el procés de compressió de la tauleta.[10]
Indústria química
[modifica]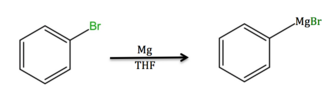
El magnesi, si es fa reaccionar amb un hidrocarbur halogenat, dona un reactiu de Grignard, que és una eina molt útil per a la preparació d'alcohols.[5] En la forma d'encenalls o cintes, el Mg és útil en la purificació de dissolvents, per exemple la preparació d'etanol de supersec.
Altres camps
[modifica]En forma d'encenalls i en pols, el magnesi és molt inflamable i explosiu; produeix una forta llum blanca i un gran soroll, raó per la qual s'utilitza en els focs d'artifici, flaixos fotogràfics i bombes incendiàries.[7]
El magnesi s'empra per a protegir metalls, a causa del seu baix potencial de reducció, que estiguin en contacte amb l'aigua i puguin ser oxidats (ànode de sacrifici), ja que s'oxida primer que ells i és bo de substituir. Serveix per a protegir els tancs subterranis, canonades, estructures enterrades, vaixells i escalfadors d'aigua. A l'ànode de magnesi es produeix l'oxidació , i al càtode de ferro, o altre metall, la reducció [11]
Altres usos són: additiu de propel·lents convencionals; obtenció de fosa nodular (Fe-Si-Mg), additiu en la producció de grafit nodular de ferro fos, agent reductor per a la producció d'urani i altres metalls a partir de les seves sals;[5] aliat amb zinc es produeixen plaques de fotogravat en la indústria de la impressió i les parets de bateries de pila seca i sostres.
El carbonat de magnesi en pols és utilitzat com a dessecant pels atletes, gimnastes i escaladors per a millorar l'adherència als objectes. El ferroceri és un material de ferro, magnesi, ceri, lantani, neodimi i praseodimi, fet servir en la fabricació de pedres d'encenedor.[7] L'òxid de magnesi i altres compostos de magnesi també s'usen en les indústries agrícoles, químiques, i de la construcció. L'òxid de magnesi de la calcinació s'empra com un aïllant elèctric en cables resistents al foc. El sulfit de magnesi s'empra en la fabricació de paper (procés de sulfit). El fosfat de magnesi s'utilitza per a fusta a prova de foc en la construcció. L'hexafluorosilicat de magnesi s'usa en el tractament antiarnes dels tèxtils.
Rol biològic
[modifica]
El magnesi és essencial per a totes les cèl·lules vives, ja que el catió està implicat en els compostos biològics de polifosfat d'importància crítica ADN, ARN i trifosfat d'adenosina (ATP). Molts enzims depenen del magnesi per al seu funcionament. Aproximadament una sisena part de l'abundància del potassi a les cèl·lules del cos humà, el magnesi es requereix com a catalitzador de les reaccions enzimàtiques en el metabolisme dels glúcids.[4]
El magnesi també és un constituent essencial del pigment verd clorofil·la, que es troba pràcticament en totes les plantes, algues i cianobacteris. La funció fotosintètica de les plantes depèn de l'acció dels pigments de la clorofil·la, que contenen magnesi al centre d'un complex sistema d'anells que conté nitrogen (porfirina). Aquests compostos de magnesi permeten que l'energia lumínica impulsi la conversió del diòxid de carboni i l'aigua en glúcids i oxigen i, per tant, directament o indirectament proporcionen la clau de gairebé tots els processos vius.[4]
En funció del pes i l'alçada, la quantitat diària recomanada és de 300-350 mg, quantitat que es pot obtenir fàcilment perquè es troba en la majoria dels aliments. Les fulles verdes de les hortalisses són especialment riques en magnesi.
Precaucions
[modifica]El magnesi és extremadament inflamable, especialment si està polvoritzat. Reacciona exotèrmicament i ràpidament en contacte amb aire o aigua; per tant, cal manipular-lo amb precaució. El foc no s'haurà d'intentar apagar amb aigua sinó amb un extintor per a focs de classe D (sodi, alumini, reactius...) o amb extintors de pols específic o CO₂.
Referències
[modifica]- ↑ Bernath, P. F., Black, J. H., & Brault, J. W. «The spectrum of magnesium hydride». Astrophysical Journal, 298, 1985, pàg. 375. Bibcode: 1985ApJ...298..375B. DOI: 10.1086/163620.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Emsley, John. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Barthelmy, David. «Mineral Species sorted by the element Mg Magnesium». Mineralogy Database. [Consulta: 1r febrer 2023].
- ↑ 4,0 4,1 4,2 4,3 «magnesium» (en anglès). Encyclopædia Britannica, 2003.
- ↑ 5,0 5,1 5,2 Lide, D.R.. CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.. 95a edició. Boca Raton, Florida: CRC Press, 2014. ISBN 978-1-4822-0867-2.
- ↑ 6,0 6,1 6,2 6,3 Winter, Mark. «WebElements Periodic Table » Magnesium » reactions of elements». [Consulta: 2 febrer 2023].
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ Aghion, E.; Bronfin, B. «Magnesium Alloys Development towards the 21st Century». Materials Science Forum, 350-351, 2000, pàg. 19. DOI: 10.4028/www.scientific.net/MSF.350-351.19.
- ↑ Bronfin, B; et al.. «Elektron 21 specification». A: Kainer, Karl. Magnesium: Proceedings of the 7th International Conference on Magnesium Alloys and Their Applications. Weinheim (Alemanya): Wiley, 2007, p. 23. ISBN 978-3-527-31764-6.
- ↑ Linsley, Trevor. «Properties of conductors and insulators». A: Basic Electrical Installation Work, p. 362. ISBN 978-0-08-096628-1.
- ↑ Gillespie, R.J. Química. Ed. en español. Barcelona: Reverté, D.L. 1990. ISBN 84-291-7183-5.
Enllaços externs
[modifica]- webelements.com - magnesi (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||




















