Enllaç C-Rh
Els compostos d'organorodi (o compostos orgànics del rodi) són compostos químics que contenen un enllaç químic entre carboni (C) i rodi (Rh) (enllaç C-Rh).
-
Dímer de clorur de rodi ciclooctadiè
La química de l'organorodi és la química dels compostos organometàl·lics que contenen un enllaç químic carboni-rodi (C-Rh),[1] i l'estudi del rodi i els seus compostos com a catalitzadors en reaccions orgàniques.
Com a catalitzadors s'utilitzen compostos d'organorodi estables i intermedis transitoris d'organorodi, com ara la hidroformilació d'olefines, la hidrogenació d'olefines, la isomerització d'olefines i el procés Monsanto.[2]
Classificació en funció dels principals estats d'oxidació
[modifica]Els compostos organometàl·lics de rodi comparteixen moltes característiques amb els de l'iridi (Ir), però menys amb el cobalt (Co). El rodi pot existir en estats d'oxidació de -III a +V, però el rodi(I) i el rodi(III) són els més comuns. Els compostos de rodi(I) (configuració d8) solen aparèixer amb geometries bipiramidals quadrades planes o trigonals, mentre que els compostos de rodi(III) (configuració d6) solen tenir una geometria octaèdrica.[2]
Rodi(0)
[modifica]Els complexos de rodi(0) són carbonils binaris. Els exemples principals són el dodecacarbonil de tetrarodi, Rh₄(CO)₁₂, i l'hexadecacarbonilhexarodi, Rh₆(CO)16. Aquests compostos s'obtenen per carbonilació reductora de sals de rodi(III) o Rh₂Cl₂(CO)₄. En contrast amb l'estabilitat del Co₂(CO)₈ homòleg, Rh₂(CO)₈ és molt labil.
Rodi(I)
[modifica]Els complexos de rodi(I) són catalitzadors homogenis importants. Els complexos comuns inclouen clorur de carbonil de bis(trifenilfosfina)rodi, dímer de clorobis(etilè)rodi, dímer de clorur de (ciclooctadiè)rodi, dímer de clorobis(ciclooctè)rodi, dicarbonil(acetilacetonat)rodi(I) i clorur de carbonil de rodi. Encara que no és formalment organometàl·lic, el catalitzador de Wilkinson (RhCl(PPh₃)₃), s'inclou a la llista de catalitzadors importants. Els complexos simples d'olefina com el dímer de clorobis(etilè)rodi, el dímer de clorobis(ciclooctè)rodi i el dímer de clorur de rodi ciclooctadiè s'utilitzen sovint com a fonts de «RhCl», aprofitant la labilitat dels lligands alquens o la seva susceptibilitat a l'eliminació per hidrogenació. (η5-Cp)RhL₂ es deriven de Rh₂Cl₂L₄ (L = CO, C₂H₄).
Rodi(II)
[modifica]A diferència de la prevalença dels complexos de cobalt(II), els compostos de rodi(II) són rars. El compost sandvitx rodocè n'és un exemple, fins i tot existeix en equilibri amb un derivat dimèric Rh(I). Encara que no és organometàl·lic, l'acetat de rodi(II) (Rh₂(OAc)₄) catalitza ciclopropanacions mitjançant intermedis organometàl·lics. Els complexos de porfirina de rodi(II) reaccionen amb metà.[3]
Rodi(III)
[modifica]El rodi se sol subministrar comercialment en estat d'oxidació Rh(III), el reactiu de partida principal és el triclorur de rodi hidratat. Aquest últim reacciona amb olefines i amb CO per donar complexos organometàl·lics, sovint concomitants amb la reducció a Rh(I). Els complexos de ciclopentadienil de rodi inclouen el mig sandvitx dímer de diclorur de rodi pentametilciclopentadienil.
Rodi(V)
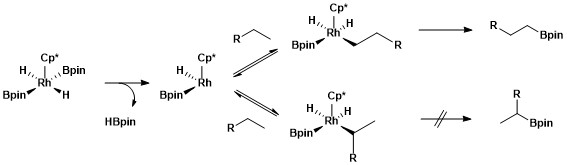
[modifica]Es necessiten lligands donants forts (hidrur, silil, boril) per estabilitzar Rh(V). Aquest estat d'oxidació s'invoca en les reaccions de borilació.
-
Les reaccions de borilació catalitzades per Rh impliquen intermedis Rh(V).
Metal·locicles
[modifica]Els compostos ciclometal·lats del rodi constitueixen una classe important de química organometàl·lica. Tot i que aquests compostos estan ben documentats a la literatura, els ciclometal·lats de rodi(III) amb funció azo són de recanvi. Un exemple típic d'aquesta categoria és el nou complex ortometal·lat hexacoordinat tiolat de rodi(III) trans-[Rh(C∧N∧S)Cl(PPh₃)₂], que es va sintetitzar a partir de benzil 2-(fenilazo)fenil tioèter i RhCl₃·3H₂O en presència d'excés de PPh₃ via in situ escissions d'enllaç C(sp2)−H i C(sp3)−S. Aquest és el primer exemple d'un compost de coordinació de lligand (fenilazo)tiolat. El mecanisme de formació del derivat d'azobenzè ortometal·lat es va descriure mitjançant la coordinació inicial de l'azo-nitrogen seguida de la substitució electròfila a l'anell de fenil penjant. PPh₃ té un paper crucial en el procés d'escissió C(sp3)-S. És probable que la divisió reductora mitjançant un mecanisme de transferència d'electrons únics (SET) sigui operativa per a la divisió de l'enllaç C−S. A diferència del compost anàleg (fenilazo)fenolat, el complex tiolat ortometal·lat presenta una ona oxidativa totalment reversible a 0,82 V vs Ag/AgCl i se suposa que aquesta resposta es centra principalment en l'àtom de sofre del tiolat.[4]
Algunes aplicacions
[modifica]Malgrat el seu alt cost, es confia molt en el rodi com a catalitzador comercial.
Síntesis d'àcid acètic i anhídrid acètic
[modifica]El procés Monsanto és un mètode industrial per a la fabricació d'àcid acètic per carbonilació catalítica de metanol,[5] tot i que ha estat substituït en gran part pel procés Cativa basat en iridi.
-
El cicle catalític del procés Monsanto per a la producció d'àcid acètic
L'espècie catalíticament activa és l'anió cis-[Rh(CO)₂I₂]−,[6] que pateix addició oxidativa amb iodur de metil. El procés relacionat d'anhídrid acètic de Tennessee Eastman proporciona anhídrid acètic per carbonilació d'acetat de metil.[7]
- CH₃CO₂CH₃ + CO → (CH₃CO)₂O
Hidroformilació
[modifica]-
Un catalitzador d'hidroformilació a base de rodi, on PAr₃ = trifenilfosfina o el seu anàleg sulfonat Tppts
Les hidroformilacions sovint es basen en catalitzadors a base de rodi. També s'han desenvolupat catalitzadors solubles en aigua. Faciliten la separació dels productes del catalitzador.[8]
Hidrogenació
[modifica]El catalitzador de Wilkinson s'utilitza com a catalitzador homogeni per a la hidrogenació d'olefines.[9] El mecanisme de catàlisi implica l'addició oxidant d'H₂, la complexació π d'alquè, la inserció migratòria (transferència intramolecular d'hidrur o inserció d'olefines) i l'eliminació reductora.
Els catalitzadors d'organorhodi(I) catiònics són útils per a hidrogenacions asimètriques, que s'apliquen a productes bioactius com ara agents farmacèutics i agroquímics.[11]
Altres reaccions
[modifica]La reducció de nitrobenzè és una altra reacció catalitzada per aquest tipus de compost:
Referències
[modifica]- ↑ Komiya i Hurano, 1997.
- ↑ 2,0 2,1 Crabtree, 2005.
- ↑ Bradford, Wayland i Sherry, 1991, p. 5305-5311.
- ↑ Pramanik et al., Stoeckli-Evans, p. 429-438.
- ↑ Cheung, Tanke i Torrence, 2002.
- ↑ Harwig, 2010.
- ↑ Zoeller et al., Polichnowski, p. 73-91.
- ↑ Cornils i Herrmann, 1998.
- ↑ Hartwig, 2010.
- ↑ Drexler, H. J; Zhang, Songlin; Sun, Ailing; Spannenberg, A; Arrieta, A; Preetz, A; Heller, D «Cationic Rh-bisphosphine-diolefin complexes as precatalysts for enantioselective catalysis––what information do single crystal structures contain regarding product chirality?» (en anglès). Tetrahedron: Asymmetry, 15, pàg. 2139-2150. DOI: 10.1016/j.tetasy.2004.06.036.
- ↑ Knowles, 2002, p. 1998.
Bibliografia
[modifica]- Bradford, B.; Wayland, Sujuan Ba; Sherry, Alan E. «Activation of Methane and Toluene by Rhodium(II) Porphyrin Complexes» (en anglès). J. Am. Chem. Soc., 113, 1991. DOI: 10.1021/ja00014a025.
- Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul. «Acetic Acid». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a01_045.
- Cornils, B.; Herrmann, W. A. Aqueous-Phase Organometallic Catalysis (en anglès). Weinheim: VCH, 1998.
- Crabtree, Robert H. The Organometallic Chemistry of the Transition Metals (en anglès). Wiley-Interscience, 2005. ISBN 0-471-66256-9.
- Hartwig, John F. Organotransition metal chemistry- From bonding to Catalysis. University Science Books, 2010. ISBN 978-1-891389-53-5.
- Knowles, William S. «Asymmetric Hydrogenations (Nobel Lecture)» (en anglès). Angewandte Chemie International Edition, 41, 2002. DOI: 10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8.
- Komiya, S; Hurano, M. Synthesis of Organometallic Compounds: A Practical Guide (en anglès). Sanshiro Komiya Ed, 1997.
- Pramanik, K.; Das, U.; Adhikari, B.; Chopra, D.; Stoeckli-Evans, H. «RhCl₃-Assisted C-H and C-S Bond Scissions: Isomeric Self-Association of Organorhodium(III) Thiolato Complex. Synthesis, Structure, and Electrochemistry» (en anglès). Inorg. Chem, 47(2), 2008. DOI: 10.1021/ic7016006. PMID: 18161963.
- Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. «Eastman Chemical Company Acetic Anhydride Process» (en anglès). Catalysis Today, 13(1), 1992. DOI: 10.1016/0920-5861(92)80188-S.




![{\displaystyle {\ce {{\overset {alque}{RHC=CH2}}+{CO}+H2->[{\ce {HRh(CO)(PPh3)3}}][{\text{hidroformilacio}}]{\overset {aldehid}{RCH2CH2CHO}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b53648cdda537b54cb195037d7add9dd26eb0bb1)
![L'estructura de [Rh(DIPAMP)(cod)]+, un precatalitzador per a la hidrogenació asimètrica.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/33/IBOZABcationDownC2.png/357px-IBOZABcationDownC2.png)
![{\displaystyle {\ce {{\overset {nitrobenze}{PhNO2}}+ {C6H6}+ 3CO ->[{\ce {Rh6(CO)16}}] {PhNHCOPh}+ {2CO2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/faa045e5064619d893d628324e51fa402379f8a1)