Enllaç C-Se
Els compostos d'organoseleni (o compostos orgànics del seleni) són compostos químics que contenen un enllaç químic entre carboni (C) i seleni (Se) (enllaç C-Se). La química de l'organoseleni és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos.[1][2][3]
El seleni pertany amb l'oxigen i el sofre als elements del grup 16 o calcògens, i s'han d'esperar similituds en la química. Els compostos d'organoseleni es troben a nivells de traça a les aigües ambientals, sòls i sediments.[4]
El seleni pot existir amb estat d'oxidació -2, +2, +4, +6. Se(II) és la forma dominant en la química de l'organoseleni. A la columna del grup 16, l'energia d'enllaç es fa cada cop més feble (234 kJ/mol per a l'enllaç C−Se i 272 kJ/mol per a l'enllaç C−S) i les longituds d'enllaç són més llargues (C−Se 198 pm, C−S. 181 pm i C−O 141 pm). Els compostos de seleni són més nucleòfils que els corresponents compostos de sofre i també més àcids. Els valors de pKa de XH₂ són 16 per a l'oxigen, 7 per al sofre i 3,8 per al seleni. A diferència dels sulfòxids, els selenòxids corresponents són inestables en presència de protons β i aquesta propietat s'utilitza en moltes reaccions orgàniques del seleni, sobretot en oxidacions de selenòxid i en eliminacions de selenòxid.
El primer compost organoseleni que es va aïllar va ser el selenur de dietil el 1836.[5][6]
Classificació estructural dels compostos d'organoseleni
[modifica]
- Els selenols (RSeH) són els equivalents de seleni dels alcohols i tiols. Aquests compostos són relativament inestables i generalment tenen una olor desagradable. El benzeselenol (també anomenat selenofenol o PhSeH) és més àcid (pKa 5,9) que el tiofenol (pKa 6,5) i també s'oxida més fàcilment a diselenur. El benzeselenol es prepara mitjançant la reducció de difenildiselenur.[7]
- Els diselenurs (R-Se-Se-R) són els equivalents de seleni de peròxids i disulfurs. Són precursors útils estables per a reactius d'organoseleni més reactius com ara selenols i halurs de selanil. El més conegut en química orgànica és el difenildiselenur, preparat a partir de bromur de fenilmagnesi i seleni seguit de l'oxidació del producte PhSeMgBr.[8]
- Els halurs de selanil (R-Se-Cl, R-Se-Br) es preparen per halogenació de diselenurs. La bromació del difenildiselenur dona bromur de fenilselanil (PhSeBr). Aquests compostos són fonts de «PhSe+».
- Els selenurs (R−Se−R), també anomenats selenoèters, són els equivalents de seleni dels èters i sulfurs. Un exemple és el dimetilselenur ((CH₃)₂Se). Aquests són els compostos organoseleni més freqüents. Els selenurs simètrics solen preparar-se per alquilació de sals de selenur de metalls alcalins (per exemple, selenur de sodi). Els selenurs asimètrics es preparen per alquilació de selenoats. Aquests compostos solen reaccionar com a nucleòfils (per exemple, amb halurs d'alquil (R'−X) per donar sals de selenoni R'RRSe+X−). El seleni divalent també pot interactuar amb heteroàtoms tous per formar centres de seleni hipervalents.[6] També reaccionen en algunes circumstàncies com a electròfils (per exemple, amb reactius d'organoliti (R'Li) al complex at R'RRSe−Li+).
- Els selenòxids (R-Se(O)-R) són els equivalents de seleni dels sulfòxids. Es poden oxidar encara més a selenones R-Se(O)₂R, els anàlegs de seleni de les sulfones.
- Els SeO-Selenoperoxols (RSe-OH; abans àcids selenònics) són intermedis en l'oxidació dels selenols. Es produeixen en alguns selenoenzims, com la glutatió peroxidasa.
- Els àcids selenínics (RSe(O)OH) són anàlegs dels àcids sulfínics.
- Els àcids peroxiselenínics (RSe(O)OOH) catalitzen les reaccions d'epoxidació i les oxidacions de Baeyer-Villiger.
- Els selenurans són compostos d'organoseleni hipervalents, formalment derivats dels tetrahalurs com el SeCl4. Alguns exemples són del tipus ArSeCl₃.[9] Els clorurs s'obtenen per cloració del clorur de selenenil.
- Els selenirans són anells de tres membres (parent: C₂H4Se) relacionats amb els tiirans, però, a diferència dels tiirans, els selenirans són cinèticament inestables, extruint seleni directament (sense oxidació) per formar alquens. Aquesta propietat s'ha utilitzat en química orgànica sintètica.[10]
- Les selones (R2C=Se) són els anàlegs de seleni de les cetones. Són rars per la seva tendència a oligomeritzar.[11] La diselenobenzoquinona és estable com a complex metàl·lic.[12] La selenourea és un exemple de compost estable que conté un enllaç C=Se.
- Els selenotioperòxids (R−Se−S−R), compostos amb enllaços seleni-sofre, anàlegs als disulfurs.
Compostos d'organoseleni a la natura
[modifica]El seleni, en forma de compostos organoseleni, és un micronutrient essencial l'absència del qual de la dieta provoca disfunció muscular cardíaca i esquelètica. Els compostos d'organoseleni són necessaris per a la defensa cel·lular contra el dany oxidatiu i per al correcte funcionament del sistema immunitari. També poden tenir un paper en la prevenció de l'envelliment prematur i el càncer. La font de seleni utilitzada en la biosíntesi és el selenofosfat.
La glutatió oxidasa és un enzim amb un selenol al seu lloc actiu. S'han trobat compostos d'organoseleni en plantes superiors. Per exemple, després de l'anàlisi de l'all mitjançant la tècnica de cromatografia líquida d'alta resolució combinada amb espectrometria de masses per plasma d'acoblament inductiu (HPLC-ICP-MS), es va trobar que la γ-glutamil-Se-metilselenocisteïna era el component principal que contenia seleni. juntament amb quantitats menors de Se-metilselenocisteïna. Es troben traces de seleniur de dimetil i d'alilmetilseleniur en l'alè humà després de consumir all cru.[13]
Selenocisteïna i selenometionina
[modifica]La selenocisteïna, anomenada l'aminoàcid 21, és essencial per a la síntesi de proteïnes dirigida pels ribosomes en alguns organismes.[14] Actualment es coneixen més de 25 proteïnes que contenen seleni (selenoproteïnes).[15] La majoria dels enzims dependents del seleni contenen selenocisteïna, que està relacionada amb l'anàleg de la cisteïna però amb seleni que substitueix el sofre. Aquest aminoàcid està codificat d'una manera especial per l'ADN.
La selenometionina és un aminoàcid que conté seleniur que també es produeix de manera natural, però que es genera per modificació post-transcripcional.
Química de l'organoseleni en síntesi orgànica
[modifica]Els compostos d'organoseleni són una col·lecció especialitzada però útil de reactius útils en la síntesi orgànica, tot i que generalment s'exclouen dels processos útils per a productes farmacèutics a causa de problemes de regulació. La seva utilitat depèn de certs atributs, incloent (i) la debilitat de l'enllaç C-Se i (ii) la fàcil oxidació dels compostos de seleni divalent.
Selenurs vinílics
[modifica]Els selenurs vinílics són compostos d'organoseleni que tenen un paper en la síntesi orgànica, especialment en el desenvolupament de rutes estereoselectives convenients per als alquens funcionalitzats.[16]
Tot i que s'esmenten diversos mètodes per a la preparació de selenurs vinílics, un procediment més útil s'ha centrat en l'addició d'organoseleni nucleòfil o electròfil als alquins terminals o interns.[17][18][19][20]
Per exemple, l'addició nucleòfila de selenofenol als alquins proporciona, preferentment, els selenurs Z-vinílics després de temps de reacció més llargs a temperatura ambient. La reacció és més ràpida a alta temperatura; tanmateix, la barreja de selenurs vinílics Z i E es va obtenir en una proporció gairebé 1:1.[21] D'altra banda, els adductes depenen de la naturalesa dels substituents del triple enllaç. Per contra, els selenurs vinílics es poden preparar per hidroselenació d'alquins catalitzada per pal·ladi per obtenir l'adducte de Markóvnikov amb bons rendiments. Hi ha algunes limitacions associades a les metodologies per preparar selenurs vinílics il·lustrades anteriorment; els procediments descrits utilitzen diorganoil, diselenurs o selenofenol com a materials de partida, que són volàtils i inestables i tenen una olor desagradable. A més, la preparació d'aquests compostos és complexa.
Oxidacions de selenòxid
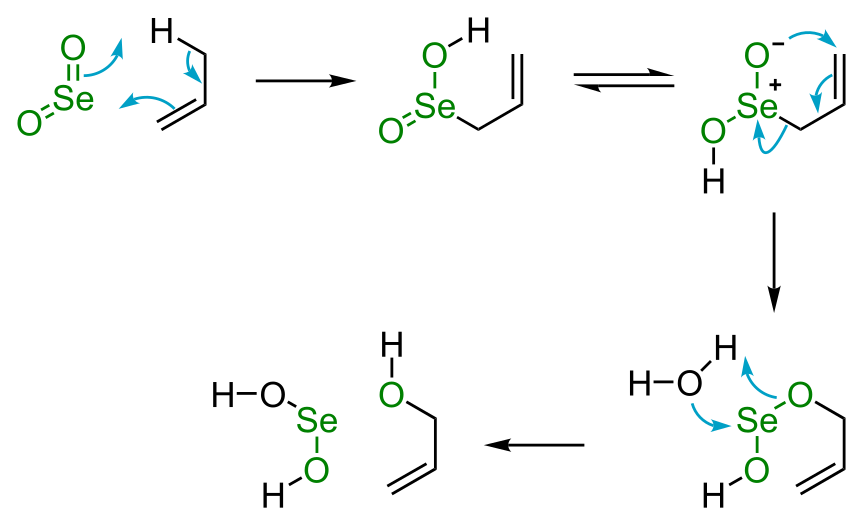
[modifica]El diòxid de seleni és útil en l'oxidació orgànica. Concretament, el SeO₂ convertirà un grup metilè al·lílic en l'alcohol corresponent. Diversos altres reactius provoquen aquesta reacció:
-
Esquema 1. Oxidació del diòxid de seleni
Pel que fa al mecanisme de reacció, el SeO₂ i el substrat al·lílic reaccionen mitjançant un procés pericíclic que comença amb una reacció ene que activa l'enllaç C−H. El segon pas és una reacció sigmatròpica [2,3]. Les oxidacions que impliquen diòxid de seleni es duen a terme sovint amb quantitats catalitzadores del compost de seleni i en presència d'un catalitzador de sacrifici o cooxidant com el peròxid d'hidrogen.
Les oxidacions basades en SeO₂ de vegades produeixen compostos carbonílics com ara cetones,[22] β-pinè[23] i oxidació de ciclohexanona a 1,2-ciclohexanodiona.[24] L'oxidació de cetones que tenen grups α-metilè produeix dicetones. Aquest tipus d'oxidació amb òxid de seleni s'anomena oxidació de Riley.[25]
Eliminacions de selenòxid
[modifica]En presència d'un β-hidrogen, un selenur donarà una reacció d'eliminació després de l'oxidació, per deixar enrere un alquè i un SeO-selenoperoxol. El SeO-selenoperoxol és altament reactiu i no està aïllat com a tal. En la reacció d'eliminació, els cinc centres de reacció participants són coplanars i, per tant, l'estereoquímica de la reacció és sin. Els agents oxidants utilitzats són peròxid d'hidrogen, ozó o MCPBA. Aquest tipus de reacció s'utilitza sovint amb cetones que condueixen a enones. Un exemple és l'eliminació de l'acetilciclohexanona amb clorur de benzeneselenil i hidrur de sodi.[26]
-
Esquema 2. Eliminació de selenòxid de compostos carbonílics
L'eliminació de Grieco és una eliminació similar de selenoxid utilitzant o-nitrofenilselenocianat i tributilfosfina per provocar l'eliminació dels elements d'H₂O.
Referències
[modifica]- ↑ Krief i Hevesi, 1988.
- ↑ Patai i Rappoport, 1986.
- ↑ Paulmier i Baldwin, 1986.
- ↑ Wallschläger i Feldmann, 2010, p. 319-364.
- ↑ Löwig, 1836, p. 550-553.
- ↑ 6,0 6,1 Mukherjee et al., 2010, p. 4357-4416.
- ↑ Organic Syntheses, Coll. Vol. 3, p. 771 (1955); Vol. 24, p. 89 (1944)
- ↑ Organic Syntheses, Coll. Vol. 6, p. 533 (1988); Vol. 59, p. 141 (1979)
- ↑ Akiba, 1999.
- ↑ Młochowski et al., Wójtowicz.
- ↑ Okazaki i Tokitoh, 2000, p. 625-630.
- ↑ Amouri et al., Rager, p. 7530-7533.
- ↑ Block, 2010.
- ↑ Axley, Böck i Stadtman, 1991, p. 8450-8454.
- ↑ Papp, Lu i Holmgren, 2007, p. 775-806.
- ↑ Comasseto et al., 1997, p. 373.
- ↑ Comasseto, 1983, p. 131-181.
- ↑ Zeni et al., Menezes, p. 1135-1138.
- ↑ Dabdoub, 2001, p. 4271-4276.
- ↑ Doregobarros et al., Zeni, p. 7921.
- ↑ Comasseto, 1981, p. 287-294.
- ↑ Organic Syntheses, Coll. Vol. 9, p. 396 (1998); Vol. 71, p. 181 (1993)
- ↑ Organic Syntheses, Coll. Vol. 6, p. 946 (1988); Vol. 56, p.25 (1977)
- ↑ Organic Syntheses, Coll. Vol. 4, p. 229 (1963); Vol. 32, p. 35 (1952)
- ↑ Riley, Morley i Friend, 1932, p. 1875.
- ↑ Organic Syntheses, Coll. Vol. 6, p. 23 (1988); Vol. 59, p. 58 (1979)
Bibliografia
[modifica]- Akiba, Kin-ya. Chemistry of hypervalent compounds (en anglès), 1999. ISBN 978-0-471-24019-8.
- Amouri, H.; Moussa, J.; Renfrew, A. K.; Dyson, P. J.; Rager, M. N.; Chamoreau, L. M. «Discovery, Structure, and Anticancer Activity of an Iridium Complex of Diselenobenzoquinone» (en anglès). Angewandte Chemie International Edition, 49(41), 2010. DOI: 10.1002/anie.201002532. PMID: 20602399.
- Axley, M. J.; Böck, A.; Stadtman, T. C. «Catalytic properties of an Escherichia coli formate dehydrogenase mutant in which sulfur replaces selenium» (en anglès). Proc. Natl. Acad. Sci. U.S.A., 88(19), 1991. Bibcode: 1991PNAS...88.8450A. DOI: 10.1073/pnas.88.19.8450. PMC: 52526. PMID: 1924303.
- Block, E. Garlic and Other Alliums: The Lore and the Science (en anglès). Royal Society of Chemistry, 2010. ISBN 978-0-85404-190-9.
- Comasseto, J. «Stereoselective synthesis of vinylic selenides» (en anglès). Journal of Organometallic Chemistry, 216(3), 1981. DOI: 10.1016/S0022-328X(00)85812-X.
- Comasseto, J. «Vinylic selenides» (en anglès). Journal of Organometallic Chemistry, 253(2), 1983. DOI: 10.1016/0022-328X(83)80118-1.
- Comasseto, João Valdir; Ling, Lo Wai; Petragnani, Nicola; Stefani, Helio Alexandre «Vinylic Selenides and Tellurides - Preparation, Reactivity and Synthetic Applications» (en anglès). Synthesis, 1997(4), 1997. DOI: 10.1055/s-1997-1210.
- Dabdoub, M «Synthesis of (Z)-1-phenylseleno-1,4-diorganyl-1-buten-3-ynes: hydroselenation of symmetrical and unsymmetrical 1,4-diorganyl-1,3-butadiynes» (en anglès). Tetrahedron, 57(20), 2001. DOI: 10.1016/S0040-4020(01)00337-4.
- Doregobarros, O; Lang, E; Deoliveira, C; Peppe, C; Zeni, G «Indium(I) iodide-mediated chemio-, regio-, and stereoselective hydroselenation of 2-alkyn-1-ol derivatives» (en anglès). Tetrahedron Letters, 43(44), 2002. DOI: 10.1016/S0040-4039(02)01904-4.
- Krief, A.; Hevesi, L. Organoselenium Chemistry I. Functional Group Transformations (en anglès). Berlín: Springer, 1988. ISBN 3-540-18629-8.
- Löwig, C. J. «Ueber schwefelwasserstoff und selenwasserstoffäther» (en alemany). Annalen der Physik, 37(3), 1836. Bibcode: 1836AnP...113..550L. DOI: 10.1002/andp.18361130315.
- Młochowski, Jacek; Kloc, Krystian; Lisiak, Rafał; Potaczek, Piotr; Wójtowicz, Halina «Developments in the chemistry of selenaheterocyclic compounds of practical importance in synthesis and medicinal biology» (en anglès). Arkivoc, JE-1901MR, 2006.
- Mukherjee, Anna J.; Zade, Sanjio S.; Singh, Harkesh B.; Sunoj, Raghavan B. «Organoselenium Chemistry: Role of Intramolecular Interactions» (en anglès). Chemical Reviews, 110(7), 2010. DOI: 10.1021/cr900352j. PMID: 20384363.
- Okazaki, R.; Tokitoh, N. «Heavy ketones, the heavier element congeners of a ketone» (en anglè). Accounts of Chemical Research, 33(9), 2000. DOI: 10.1021/ar980073b. PMID: 10995200.
- Papp, L. V.; Lu, J.; Holmgren, A.; Khanna, K. K. «From selenium to selenoproteins: synthesis, identity, and their role in human health» (en anglès). Antioxidants & Redox Signaling, 9(7), 2007. DOI: 10.1089/ars.2007.1528. PMID: 17508906.
- Patai, S.; Rappoport, Z. The Chemistry of Organic Selenium and Tellurium Compounds (en anglès). 1. John. Wiley and Sons, Chichester, 1986. ISBN 0-471-90425-2.
- Paulmier, C.; Baldwin, J. E.. Selenium Reagents and Intermediates in Organic Synthesis (en anglès). Nova York: Pergamon Books Ltd, 1986. ISBN 0-08-032484-3.
- Riley, Harry Lister; Morley, John Frederick; Friend, Norman Alfred Child «255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones» (en anglès). Journal of the Chemical Society (resumit), 1932. DOI: 10.1039/JR9320001875.
- Wallschläger, D.; Feldmann, F. Formation, Occurrence, Significance, and Analysis of Organoselenium and Organotellurium Compounds in the Environment (en anglès). vol. 7. Organometallics in Environment and Toxicology. RSC Publishing, 2010 (Metal Ions in Life Sciences). ISBN 978-1-84755-177-1.
- Zeni, Gilson; Stracke, Marcelo P.; Nogueira, Cristina W.; Braga, Antonio L.; Menezes, Paulo H.; Stefani, Helio A. «Hydroselenation of Alkynes by Lithium Butylselenolate: an Approach in the Synthesis of Vinylic Selenides» (en anglès). Organic Letters, 6(7), 2004. DOI: 10.1021/ol0498904. PMID: 15040741.