Enterobàcter
| Enterobacter | |
|---|---|
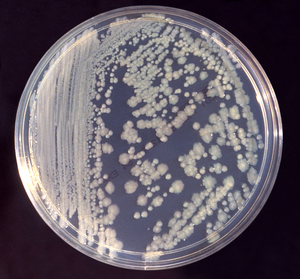 Enterobacter cloacae | |
| Dades | |
| Tinció de Gram | gramnegatiu |
| Mida del genoma | 4,5 - 5,5 Mb |
| Taxonomia | |
| Regne | Pseudomonadati |
| Fílum | Pseudomonadota |
| Classe | Gammaproteobacteria |
| Ordre | Enterobacterales |
| Família | Enterobacteriaceae |
| Gènere | Enterobacter |
| Tipus taxonòmic | Enterobacter cloacae |
| Espècies | |
Els enterobàcters (Enterobacter) són un gènere de bacteris (eubacteris) gramnegatius pertanyents a la família de les Enterobacteriaceae. Tenen un metabolisme facultativament anaeròbic i són ubics, és a dir, estan estesos arreu del món. Aquest gènere inclou tant espècies que viuen de manera independent al medi ambient com d'altres que formen part de la microbiota intestinal d'animals.[1][2][3]
La paraula Enterobacter prové del terme grec ἔντερον (enter[o]) que significa «intestí» i βακτήρ (baktēr) que vol dir «bastonet».[4] Tot i aquesta etimologia, no tots els enterobàcters es troben al tracte intestinal dels éssers vius. És a dir, la principal característica compartida entre tots els membres del gènere Enterobacter és el seu metabolisme, no l'hàbitat intestinal.[5]
El nombre i la classificació de les espècies dins el gènere Enterobacter ha anat variant a causa dels estudis taxonòmics, però, actualment, s'hi descriuen 22 espècies pertanyents a aquest gènere. Algunes d'aquestes espècies s'han definit com a patògens oportunistes en plantes, humans i altres animals.[6] Aquests bacteris nocius causen infeccions en persones immunodeficients, generalment hospitalitzades i predominantment amb ventilació mecànica. Els enterobàcters desencadenen preferentment infeccions a l'aparell urinari i al sistema respiratori. Alguns exemples de les espècies clínicament més importants i estudiades d'aquest gènere són: Enterobacter cloacae, E. aerogenes (actualment reclassificada com a Klebsiella aerogenes), E. sakazakii (actualment reclassificada com a Cronobacter sakazakii),[3] E. hormaechei i E. asburiae.[7][8] Altres espècies d'Enterobacter de gran importància i menor patogenicitat són: Enterobacter ludwigii, E. amnigenus i E. gergoviae.[3]
Caracterització i identificació
[modifica]
Els bacteris del gènere Enterobacter són bacils amb marges arrodonits, mesuren entre 0,3 i 1 µm d'ample i entre 3 i 6 µm de llargada, i no tenen tendència a agregar-se entre ells. A més, no formen espores ni presenten tinció acidoresistent. Poden presentar flagels perítrics que els proporcionen certa motilitat o ser cèl·lules immòbils. No tenen càpsula.[2][3][9] En ser bacteris gramnegatius, després de fer la tinció de Gram, es veuen de color vermell-rosat durant la seva observació microscòpica. Això és perquè, com que tenen una capa de peptidoglicà prima i una membrana externa addicional a la seva paret cel·lular, es tenyeixen d'aquest color rosat quan s'afegeix safranina a la tinció de gram. D'aquesta manera es poden observar correctament, ja que si no, serien incolors.[10]
Els microorganismes del gènere Enterobacter són membres del grup de bacteris coliformes totals. Aquest grup fa referència a un conjunt de bacteris bacil·lars gramnegatius que fermenten la lactosa en presència de sals biliars amb producció de gas (CO2) a una temperatura de 35-37 °C dins les primeres 48 hores de cultiu. Són microorganismes aerobis o anaerobis facultatius, oxidasa negatius, no són formadors d'espores i presenten activitat de la β-D-galactosidasa (hidròlisi de la lactosa) la qual resulta essencial per a la determinació de coliforms.[11] El grup dels bacteris coliformes totals inclou altres gèneres, a part d'Enterobacter, com ara Escherichia, Klebsiella o Citrobacter. Tanmateix, les espècies del gènere Enterobacter no pertanyen al grup de bacteris coliformes fecals (o també anomenats bacteris coliformes termotolerants), ja que, a diferència d'altres bacteris com Escherichia coli, no poden créixer a temperatura 44,5 °C en presència de sals biliars. Aquests darrerrs microorganismes solen usar-se com a indicadors de contaminació fecal en aigua i aliments, preferentment E. coli. Tot i que no tots els bacteris coliformes són patògens, la majoria ho poden ser i la seva presència en aliments de consum humà suposa un risc, essent essencial el control de la qualitat i la seguretat alimentària relacionada amb les bones pràctiques higièniques.[12][13]
Alguns bacteris d'aquest gènere poden comunicar-se entre ells mitjançant el mecanisme de percepció de quòrum. Aquest sistema permet als bacteris coordinar l'expressió de gens en funció de la densitat poblacional. En el cas d'Enterobacter, permet regular el comportament col·lectiu en processos com ara la formació de biofilms, la producció de factors de virulència i la resistència a antibiòtics. La comunicació entre bacteris es fa a mitjançant l'alliberació al medi extern de molècules senyalitzadores anomenades autoinductors. Aquestes molècules són detectades per la resta de bacteris a través dels receptors de membrana i quan la densitat bacteriana assoleix un valor crític es genera una resposta fixada genèticament. Els enterobàcters secreten el tipus d'autoinductor més comú, l'N-acil homoserina lactona (AHL). A part de respondre a la percepció de quòrum, els enterobàcters també interaccionen entre ells per a coordinar-se en la transmissió de gens a través de la conjugació bacteriana, un mecanisme de transferència horitzontal de material genètic.[14]
Anàlisis bioquímiques
[modifica]Els cultius d'Enterobacter als laboratoris es fan generalment en medis convencionals com l'agar sang, l'agar MacConckey o agar eosina blau de metilè (EMB, de l'anglès eosin methylene blue) i la seva identificació es pot dur a terme a través de les proves bioquímiques habituals. Aquests microorganismes proliferen amb facilitat en medis simples, comunament amb una sola font de carboni, ja que són poc exigents nutricionalment. A més, són prou resistents a agents ambientals i tenen una elevada capacitat de variar genotípicament, cosa que els permet adaptar-se als ambients amb facilitat. Les espècies d'Enterobacter fermenten la glucosa, són catalasa positius i oxidasa negatius, donen negatiu a la prova d'indol, positiu a la prova del citrat i són ureasa variables. Per exemple, E. cloacae dona positiu a la prova de la ureasa, però E. aerogenes dona negatiu. A més, tenen la capacitat de reduir els nitrats (NO₃⁻) a nitrits (NO₂⁻), és a dir, donen positiu a la prova de reducció de nitrats.[1][2][9]
Les colònies en plaques de Petri típiques dels enterobàcters poden variar segons l'espècie determinada i el tipus de medi de cultiu utilitzat. En l'agar MacConckey (medi selectiu i diferencial) es formen unes colònies arrodonides de mida mitjana i de color vermell-rosat. En l'agar sang (medi selectiu), les colònies solen ser més grans (2-3 mm), d'aspecte mucós i humit, i de color gris o blanquinós. No produeixen hemòlisi (els enterobàcters són γ-hemolítics), és a dir, no tenen la capacitat de lisar els glòbuls vermells i no generen un halo ni canvis en el medi del voltant de les colònies a diferència dels bacteris α-hemolítics i β-hemolítics.[15][16]

També es poden usar medis cromogènics que contenen substrats hidrolitzables per la β-galactosidasa, un enzim present en els bacteris del gènere Enterobacter, que permet diferenciar-los d'Escherichia coli. El resultat d'aquests medis de cultiu ajuda a escollir les proves adients per a la identificació final. Una altra possibilitat és usar l'agar CLED (amb cisteïna, lactosa i deficient en electrolits).[3]
També es recomana analitzar la seqüència de gens addicionals que codifiquin proteïnes. L'anàlisi de seqüència multilocus (MLSA, de l'anglès multilocus sequence analysis) basat en gens recN (recombinació i reparació de proteïnes), rpoA (subunitat α de l'ARN polimerasa) i thdF (oxidació de tiofè i furà) sembla ser una alternativa útil per tal d'obtenir una correcta assignació de les espècies. El conjunt de resultats de totes aquestes proves permet procedir a l'aïllament, detecció i identificació de les espècies de bacteris del gènere d'Enterobàcter.[17][18]
Ecologia i ambient
[modifica]El gènere Enterobacter és un grup molt heterogeni que es troba distribuït en múltiples ambients naturals, incloent sòls, aigües dolces i residuals i a la femta.[1][3][19] A més, algunes espècies d'aquest gènere es poden localitzar al tracte gastrointestinal d'éssers humans i altres animals, així com a les seves superfícies epitelials.[20]
A l'intestí humà s'hi allotgen aproximadament 1014 microorganismes, d'entre els quals la família Enterobacteriaceae constitueix menys d'un 1 per cent, sent el gènere Enterobacter un dels contribuents minoritaris.[21] Aquests darrers poden ser tant comensals com patògens.[20]
Patogenicitat i virulència
[modifica]Tot i que no totes les espècies d'Enterobacter són responsables de malalties, algunes poden ser patògenes i causar infeccions oportunistes i nosocomials, és a dir, aquelles que afecten pacients immunodeprimits o que es presenten durant el procés d'assistència de salut, especialment en pacients hospitalitzats.[22][23] En humans, Enterobacter és el tercer patogen més freqüent del sistema respiratori, el quart en ferides quirúrgiques i el cinquè en l'aparell urinari i torrent sanguini.[24]
La patogenicitat i virulència d'Enterobacter és poc clara a causa de la quantitat limitada d'investigacions que se n'han fet. Tanmateix, se sap que comparteix algunes característiques amb altres enterobacteris, com ara la presència de flagels, els quals a més de participar en la motilitat, també contribueixen a la formació de biopel·lícules, exportació de proteïnes i adhesió. A més, produeixen endotoxines.[6]
S'han trobat altres mecanismes de patogenicitat en Enterobacter com ara el sistema de secreció de tipus III (TTSS), present en alguns bacteris gramnegatius, o l'adquisició del plasmidi pQC, el qual conté gens de virulència i resistència, per part d'E. cloacae.[6]
Patogenicitat d'Enterobacter cloacae
[modifica]En Enterobacter cloacae s'ha demostrat l'adhesió i penetració a cèl·lules epitelials, provocant la inducció d'apoptosi.[25] La seva plasticitat genòmica va quedar clarament demostrada quan es va produir un brot a Holanda causat per una soca que tenia diversos mecanismes de virulència codificats tant per gens constitutius com per elements adquirits.[26] Aquest brot es va produir entre 2001 i 2002 i va afectar a 61 pacients en 10 hospitals. La espècie causant és Enterobacter hormaechei, la qual pertany al complex Enterobacter cloacae (ECC), un complex que inclou diverses espècies d'Enterobacter que són fenotípicament molt semblants però diferents a nivell genètic.[26]
Enterobacter cloacae s'ha identificat com un patogen que pot formar biopel·lícules i, per tant, adherir-se a superfícies biològiques i dispositius mèdics, afavorint la seva persistència i també dificultant l'erradicació mitjançant antibiòtics o pel propi sistema immunitari. La seva capacitat de diversificació i adaptació a diferents ambients així com la transferència horitzontal de gens de resistència, fan que destaqui com a patogen emergent.[27]
A més, Enterobacter cloacae presenta en la seva membrana externa el lípid-A del lipopolisacàrid (també conegut com a endotoxina), que provoca sèpsia.[28] El lípid-A indueix l'alliberament de citocines proinflamatòries, com TNF-α i IL-1, les quals poden causar inflamació sistèmica, augment de la permeabilitat vascular i facilitar la disseminació de toxines i bacteris al teixit o al torrent sanguini. La presència de les toxines al teixit o a la sang depèn del trencament de la integritat bacteriana o de l'alliberament actiu d'aquestes substàncies.[29]
Resistència a agents antimicrobians
[modifica]El gènere Enterobacter pertany a un grup de bacteris que s'anomena ESKAPE, de les inicials dels gèneres que l'integren (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa i Enterobacter spp) i que són els principals bacteris que poden desenvolupar i difondre resistència als antibiòtics.[30] Es va descriure per primera vegada l'any 1960, i aquest membre del grup ha demostrat ser més complex a causa de l'evolució exponencial de mètodes fenotípics i genotípics.[6]
Respecte a la resistència als antibiòtics, Enterobacter cloacae disposa de diversos mecanismes de resistència mitjançant gens reguladors locals i globals, així com la modulació de l'expressió de diferents proteïnes, incloent-hi enzims (com les β-lactamases) o transportadors de membrana, com les porines i les bombes d'eflux.[6] La capacitat que tenen els membres del gènere de portar plasmidis que codifiquin una resistència a nombrosos antimicrobians és un factor de gran rellevància relacionat amb infeccions nosocomials.[31]
En algunes espècies, com ara Enterobacter aerogenes o E. cloacae, s'han observat canvis en les porines expressades a la membrana, identificant mutacions en la seva estructura i afectant-ne la funció. Aleshores, es produeixen canvis en la permeabilitat de la membrana que, juntament amb la presència d'enzims com β-lactamases, donen lloc a una pèrdua significativa de susceptibilitat a antibiòtics, generant un fenomen de resistència a β-lactàmics preocupant.[6]
La producció de β-lactamases és el mecanisme més important responsable de la resistència a antimicrobians en la majoria d'Enterobacter. Aquests enzims s'indueixen enfront β-lactàmics i generen resistència a cefalosporines de tercera generació (C3G), però és més important encara la hiperproducció de monofosfat d'adenosina cíclic (AmpC) per mutants desreprimits. Aquest mecanisme confereix resistència a cefalosporines de tercera generació, monobactames, carboxi i ureidopenicil·lines i també combinacions amb inhibidors com l'àcid clavulànic o sulbactama. Tant en Enterobacter com en altres grups d'enterobacteris, s'ha observat un augment considerable de la resistència a β-lactàmics, aminoglucòsids, trimetoprimi-sulfametoxazol i quinolones.[32]
Hi ha espècies d'Enterobacter que són productores de β-lactamases plasmídiques d'espectre estès (BLEE), enzims que fenotípicament es caracteritzen per conferir resistència a la penicil·lina i la cefalosporina. Cal destacar epidemiològicament la creixent presència de BLEE en enterobacteris productors de β-lactamases cromosòmiques AmpC. La soca en la qual s'ha documentat major disseminació és una soca d'E. aerogenes productora de TEM-24, un tipus de BLEE.[33]
Presència en aliments
[modifica]Hi ha certes espècies del gènere Enterobacter que es troben en una gran varietat d'aliments. Se'n poden trobar en productes làctics i derivats, carns crues i processades, verdures, cereals i aliments fermentats.[22][34] Malgrat no tots els membres del gènere Enterobacter són patògens, algunes espècies sí que ho poden ser i la seva presència suposa un risc en aliments de consum humà. Per consegüent, és indispensable el control de la qualitat i la seguretat alimentària en totes les etapes de la cadena de producció d'aquests aliments. D'aquesta manera, es pot aconseguir una disminució de l'ocurrència de malalties de transmissió alimentària degudes a la presència d'enterobàcters en productes alimentaris.[12][13] Hi ha diverses normatives internacionals que regulen la presència de bacteris patògens en aliments. Tot i això, diferents països poden tenir diferents pautes amb diversos nivells d'acceptació.[35]
| Aliment associat | Espècie d'Enterobacter |
|---|---|
| Amanides fetes | Enterobacter cloacae [36] |
| Verdures fresques | Enterobacter asburiae [37] |
| Productes làctics | Enterobacter cloacae [36] |
| Productes carnis | Enterobacter cloacae,[36] Enterobacter kubei,[36] Enterobacter agglomerans[38] |
| Aliments processats | Altres espècies |
Presència en productes làctics
[modifica]Enterobacter cloacae és un dels contaminants principals de productes làctics. Tot i que durant el procés de pasteurització els microorganismes del gènere Enterobacter se solen eliminar, la seva detecció en productes pasteuritzats com la llet o derivats indica una contaminació posterior al procés, sigui durant l'envasament o per contacte amb equips o ingredients no estèrils. Les espècies d'enterobàcters més comunes en productes làctics són E. cloacae, E. agglomerans, E. pulveris i E. helveticus.[3][22]
La contaminació sol donar-se un cop finalitzada l'etapa d'assecament dels aliments en pols. Pot ser deguda a ingredients crus o aigües contaminades, que poden introduir els bacteris en els productes, per contaminació humana, o a causa de partícules presents a l'ambient.[22]
Algunes espècies, com E. pulveris (present majoritàriament en la llet en pols) són resistents a la dessecació, de manera que poden sobreviure en ambients secs i en productes en pols durant llargs períodes de temps.[3][22] Preocupa especialment per la seva presència en aliments en pols per a infants (llet i cereals), suposant un risc per a la salut dels lactants. Pot causar malalties en nadons prematurs i nounats, podent-se aïllar com a patogen en casos de bacterièmia, meningitis i septicèmia.[39]
Presència en productes carnis
[modifica]S'han identificat espècies del gènere Enterobacter com E. agglomerans, E. aerogenes, E. cloacae i E. hafniae en productes carnis, però principalment en superfícies i instal·lacions de treball. Tanmateix, el seu potencial indicador de la qualitat sanitària i de les condicions higièniques de treball és limitat.[38]
Símptomes
[modifica]Hi ha una gran varietat de manifestacions clíniques degudes a infeccions per Enterobacter. Les més comunes inclouen bacterièmia, infeccions en el tracte respiratori inferior (pneumònia), infeccions en l'aparell urinari (UTIs), infeccions quirúrgiques i infeccions associades a dispositius intravasculars (sondes i catèters). En menor proporció, es presenten infeccions nosocomials com ara meningitis, sinusitis o osteomielitis.[40] Aquestes infeccions poden tenir l'origen en el consum de productes alimentaris contaminats per enterobàcters, per tant, es parlaria de malalties de transmissió alimentària.[41]
Complicacions associades
[modifica]La sèpsia i el xoc sèptic són complicacions greus associades a aquestes infeccions. En el cas de la pneumònia, poden sorgir complicacions com abscessos pulmonars, vessament pleural parapneumònic o síndrome del destret respiratori agut (ARDS, de l'anglès acute respiratory distress syndrome).[24]
Tractament
[modifica]La resistència a antibiòtics planteja una preocupació creixent en el tractament de les infeccions causades per Enterobacter. Les opcions terapèutiques inclouen diversos antibiòtics, entre els quals hi ha els β-lactàmics, carbapenems, fluoroquinolones, aminoglicòsids i la combinació de sulfametoxazol/trimetoprim.[24]
Les cefalosporines de primera i segona generació no mostren efectivitat contra Enterobacter; tanmateix, les de tercera generació poden ser útils en determinades soques. No obstant això, el seu ús pot afavorir l’aparició d’infeccions multiresistents.[24]
Els carbapenems són considerats els agents més eficaços contra infeccions d’Enterobacter multiresistents. En particular, el meropenem i imipenem són actius contra E. cloacae i E. aerogenes, si bé la resistència a aquests agents és una tendència a l’alça.[42]
Infeccions urinàries CRE (carbapenem-resistant Enterobacteriaceae)
[modifica]En pacients no crítics, els aminoglicòsids i la fosfomicina es recomanen com a monoteràpia en funció de la sensibilitat de la soca. No obstant això, la fosfomicina no es recomana per al tractament de la pielonefritis, en cas de baixa disponibilitat oral. La tigeciclina i la colistina tampoc són recomanades en infeccions urinàries causades per enterobacteris resistents als carbapenem (CRE, de l'anglès carbapenem-resistant Enterobacteriaceae), a causa d'una excreció urinària reduïda.[24]
En pacients crítics, la teràpia combinada de carbapenem, juntament amb colistina o un aminoglicòsid, és una opció terapèutica adequada. Un cop el pacient mostra una millora, es pot canviar d’antibiòtics intravenosos a orals, i finalitzar el tractament amb fluoroquinolones o sulfametoxazol/trimetoprim.[24]
El tractament de les infeccions urinàries CRE és molt complex, i requereix una àmplia variabilitat de combinacions farmacològiques. S’estan estudiant diversos fàrmacs experimentals per fer front a la resistència persistent.[24]
Relació amb l'obesitat
[modifica]En molts casos de pacients amb sobrepès o obesitat s'ha observat una alteració de la microbiota intestinal.[21] Un estudi de l'any 2012 va demostrar que la presència d'Enterobacter cloacae B29 a l'intestí d'una persona que patia obesitat mòrbida podria haver contribuït a la seva obesitat.[43] Es va observar que un 35 per cent de la composició bacteriana de la microbiota intestinal del pacient era d'espècies del gènere Enterobacter. Després d'una dieta específica, la presència d'Enterobacter va desaparèixer gairebé completament.[21]
La disminució de la quantitat del bacteri en l'intestí del pacient, passant del 35 per cent de E. cloacae B29 a nivells indetectables, es va poder relacionar amb una reducció paral·lela de les endotoxines (lipopolisacàrids) i una disminució notable del pes de la persona. A més, la mateixa soca aïllada del pacient, va provocar obesitat i resistència a la insulina en ratolins C57BL/6J sense microbiota intestinal, els quals van ser alimentats amb una dieta rica en greixos. L'estudi conclou que E. cloacae B29 podria contribuir a l'obesitat en humans mitjançant un mecanisme d'inflamació induïda per endotoxines.[43]
Aplicacions biotecnològiques
[modifica]Enterobacter inclou una diversitat àmplia d'espècies amb gran potencial biotecnològic. Gràcies a la seva capacitat de produir compostos i l'habilitat de participar en processos de bioremediació, tenen un paper essencial en la transició a processos industrials sostenibles.[44]
| Espècie | Aplicació | Productes | Exemples d'ús |
|---|---|---|---|
| E. aerogenes | Producció de biocombustibles i conversió de residus en biopolímers | Biohidrogen i PHA (polihidroxialcanoats) | Substitució de combustibles fòssils.
Producció de plàstics biodegradables.[45] |
| E. asburiae | Fixació de nitrogen | Amoni i compostos nitrogenats | Adobs naturals (agricultura sostenible).[46] |
| E. cloacae | Producció d'enzims industrials | Àcid succínic i acetoïna | Síntesi de bioplàstics.
Indústria alimentària: additius alimentaris per a la millora del gust i textura.[47] |
| E. hormaechei | Producció de prebiòtics | Oligosacàrids funcionals (xilooligosacàrids) | Indústria alimentària: productes probiòtics i suplements alimentaris.[48] |
| E. kobei | Bioremediació | Degradació d'hidrocarburs | Tractament de sòls i aigües contaminades per petroli.[49] |
| E. ludwigii i E. tabaci | Biorremediació de metalls pesants | Precipitació i acumulació de metalls | Extracció d'arsenic, cadmi i mercuri en aigües contaminades.[50] |
Referències bibliogràfiques
[modifica]- ↑ 1,0 1,1 1,2 Silva, Francisco; Martínez O., Pabla. «Complejo Enterobacter cloacae» (en castellà). Revista Chilena de Infectología, 2018. [Consulta: 9 octubre 2024].
- ↑ 2,0 2,1 2,2 Kenneth J. Ryan; C. George Ray. «Capítol 33: Enterobacterias». A: Sherris: Microbiología Médica (en castellà). Sexta edición. McGraw-Hill, 2017. ISBN 9786071514127.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Lopardo, Horacio A.; Predari, Silvia C.; Vay, Carlos «Bacterias de importancia clínica». Manual de microbiología clínica de la Asociación Argentina de Microbiología - Volumen I, pàg. 102.
- ↑ «Dicciomed: Diccionario médico-biológico, histórico y etimológico» (en castellà). [Consulta: 13 desembre 2024].
- ↑ Ingraham, Ingraham, John L. i Catherine A.. Introducció a la MICROBIOLOGIA. Barcelona: Reverté, S.A, p. 254-255. ISBN 84-291-1864-0.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Davin-Regli, Anne; Lavigne, Jean-Philippe; Pagès, Jean-Marie «Enterobacter spp.: Update on Taxonomy, Clinical Aspects, and Emerging Antimicrobial Resistance» (en anglès). Clinical Microbiology Reviews, 32, 4, 18-09-2019. DOI: 10.1128/CMR.00002-19. ISSN: 0893-8512.
- ↑ «Enterobacter» (en castellà). slideshare: a Scribd company, 06-03-2013. [Consulta: 28 octubre 2024].
- ↑ «Enterobacter cloacae». [Consulta: 12 novembre 2024].
- ↑ 9,0 9,1 «Diccionario médico: Enterobacter» (en castellà). Cloínica Universidad de Navarra, 2024. [Consulta: 16 octubre 2024].
- ↑ A. Rodríguez, Patricia; Arenas, Roberto «Hans Christian Gram y su tinción» (pdf) (en castellà). Dermatología Comética, Médica y Quirúrgica, 16, 2, abril-junio 2018, pàg. 166-167.
- ↑ Larrea-Murrell, Jeny Adina; Rojas-Badía, Marcia María; Romeu-Álvarez, Beatriz; Rojas-Hernández, Nidia Mercedes; Heydrich-Pérez, Mayra «Bacterias indicadoras de contaminación fecal en la evaluación de la calidad de las aguas: revisión de la literatura» (en castellà). Revista CENIC Ciencias Biológicas, Vol. 44, No. 3,, 2013.
- ↑ 12,0 12,1 Cabral, João P. S. «Water Microbiology. Bacterial Pathogens and Water» (en anglès). International Journal of Environmental Research and Public Health, 7, 10, 15-10-2010, pàg. 3657–3703. DOI: 10.3390/ijerph7103657. ISSN: 1660-4601. PMC: PMC2996186. PMID: 21139855.
- ↑ 13,0 13,1 «Capítol 156: Diseases Caused by Gram-Negative Enteric Bacilli». A: Harrison's Principles of Internal Medicine (en anglès). 20ena. Mc GrawHill Education, https://accessmedicine.mhmedical.com/content.aspx?bookid=2129§ionid=192022222.
- ↑ Tan, Wen-Si; Yunos, Nina; Tan, Pui-Wan; Mohamad, Nur; Adrian, Tan-Guan-Sheng «Freshwater-Borne Bacteria Isolated from a Malaysian Rainforest Waterfall Exhibiting Quorum Sensing Properties» (en anglès). Sensors, 14, 6, 13-06-2014, pàg. 10527–10537. DOI: 10.3390/s140610527. ISSN: 1424-8220. PMC: PMC4118381. PMID: 24932870.
- ↑ Ana Fernández Olmos; Celia García de la Fuente; Juan Antonio Saéz Nieto; Sylvia Valdezate Ramos. «Capítulo 37: Metodos de identificación bacteriana en el laboratorio de microbiología». A: Procedimientos en Microbiología Clínica (tesi) (en castellà). ISBN 978-84-614-7932-0.
- ↑ Studio, Polilla. «Edulab Blog detalle». [Consulta: 12 novembre 2024].
- ↑ «CLSI Guideline Addresses Identification of Bacteria and Fungi Using DNA Target Sequencing». Laboratory Medicine, 41, 2, 2-2010, pàg. 116–117. DOI: 10.1309/lmp7hxymieyyomg8. ISSN: 0007-5027.
- ↑ Stackebrandt, Erko; Frederiksen, Wilhelm; Garrity, George M; Grimont, Patrick A D; Kämpfer, Peter «Report of the ad hoc committee for the re-evaluation of the species definition in bacteriology.». International Journal of Systematic and Evolutionary Microbiology, 52, 3, 01-05-2002, pàg. 1043–1047. DOI: 10.1099/00207713-52-3-1043. ISSN: 1466-5026.
- ↑ Silva, Francisco; Martínez O., TM. Pabla «Complejo Enterobacter cloacae» (en anglès). Revista chilena de infectología, 35, 3, 2018, pàg. 297–298. DOI: 10.4067/s0716-10182018000300297. ISSN: 0716-1018.
- ↑ 20,0 20,1 Hupe, Meghan «StatPearls». Journal of Electronic Resources in Medical Libraries, 21, 3, 02-07-2024, pàg. 147–152. DOI: 10.1080/15424065.2024.2389325. ISSN: 1542-4065.
- ↑ 21,0 21,1 21,2 Moreira de Gouveia, Maria Ines; Bernalier-Donadille, Annick; Jubelin, Gregory «Enterobacteriaceae in the Human Gut: Dynamics and Ecological Roles in Health and Disease» (en anglès). Biology, 13, 3, 3-2024, pàg. 142. DOI: 10.3390/biology13030142. ISSN: 2079-7737. PMC: PMC10967970. PMID: 38534413.
- ↑ 22,0 22,1 22,2 22,3 22,4 «Enterobacter - an overview | ScienceDirect Topics». [Consulta: 29 octubre 2024].
- ↑ «La infecció nosocomial». [Consulta: 30 octubre 2024].
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 24,6 Ramirez, Darnelle; Giron, Mariana. Enterobacter Infections. Treasure Island (FL): StatPearls Publishing, 2024.
- ↑ Krzymińska, Sylwia; Koczura, Ryszard; Mokracka, Joanna; Puton, Tomasz; Kaznowski, Adam «Isolates of the Enterobacter cloacae complex induce apoptosis of human intestinal epithelial cells». Microbial Pathogenesis, 49, 3, 9-2010, pàg. 83–89. DOI: 10.1016/j.micpath.2010.04.003. ISSN: 0882-4010.
- ↑ 26,0 26,1 Paauw, Armand; Caspers, Martien P. M.; Leverstein-van Hall, Maurine A.; Schuren, Frank H. J.; Montijn, Roy C. «Identification of resistance and virulence factors in an epidemic Enterobacter hormaechei outbreak strain». Microbiology, 155, 5, 01-05-2009, pàg. 1478–1488. DOI: 10.1099/mic.0.024828-0. ISSN: 1350-0872.
- ↑ Davin-Regli, Anne; Pagès, Jean-Marie «Enterobacter aerogenes and Enterobacter cloacae; versatile bacterial pathogens confronting antibiotic treatment». Frontiers in Microbiology, 6, 18-05-2015. DOI: 10.3389/fmicb.2015.00392. ISSN: 1664-302X.
- ↑ Hopley, Ven. Arthur, (17 Oct. 1906–25 Sept. 1981), Archdeacon Emeritus of the Diocese of Bath and Wells, since 1977 (en anglès). Oxford University Press, 2007-12-01. DOI 10.1093/ww/9780199540884.013.u165457.
- ↑ Gorman, Amy; Golovanov, Alexander P. «Lipopolysaccharide Structure and the Phenomenon of Low Endotoxin Recovery». European Journal of Pharmaceutics and Biopharmaceutics, 180, 01-11-2022, pàg. 289–307. DOI: 10.1016/j.ejpb.2022.10.006. ISSN: 0939-6411.
- ↑ Khasapane, Ntelekwane George; Nkhebenyane, Sebolelo Jane; Lekota, Kgaugelo; Thekisoe, Oriel; Ramatla, Tsepo «“One Health” Perspective on Prevalence of ESKAPE Pathogens in Africa: A Systematic Review and Meta-Analysis» (en anglès). Pathogens, 13, 9, 9-2024, pàg. 787. DOI: 10.3390/pathogens13090787. ISSN: 2076-0817 [Consulta: 12 desembre 2024].
- ↑ Mokracka, Joanna; Koczura, Ryszard; Pawłowski, Konrad; Kaznowski, Adam «Resistance patterns and integron cassette arrays of Enterobacter cloacae complex strains of human origin». Journal of Medical Microbiology, 60, 6, 01-06-2011, pàg. 737–743. DOI: 10.1099/jmm.0.027979-0. ISSN: 0022-2615.
- ↑ Sievert, Dawn M.; Ricks, Philip; Edwards, Jonathan R.; Schneider, Amy; Patel, Jean «Antimicrobial-Resistant Pathogens Associated with Healthcare-Associated Infections Summary of Data Reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009–2010». Infection Control & Hospital Epidemiology, 34, 1, 1-2013, pàg. 1–14. DOI: 10.1086/668770. ISSN: 0899-823X.
- ↑ Antonio Oliver y Rafael Cantón «[https://www.seimc.org/contenidos/ccs/revisionestematicas/bacteriologia/blees.pdf ENTEROBACTERIAS PRODUCTORAS DE β-LACTAMASAS PLASMÍDICAS DE ESPECTRO EXTENDIDO]». ENTEROBACTERIAS PRODUCTORAS DE β-LACTAMASAS PLASMÍDICAS DE ESPECTRO EXTENDIDO.
- ↑ Yassir, Sara Mohssin; Zaid, Basaad Abd «Phenotypic and genotypic detection of Enterobacter spp isolated from food» (en anglès). International journal of health sciences, 6, S5, 23-08-2022, pàg. 9727–9736. DOI: 10.53730/ijhs.v6nS5.12071. ISSN: 2550-696X.
- ↑ «Microorganismos - Enterobacterias» (en castellà). [Consulta: 16 desembre 2024].
- ↑ 36,0 36,1 36,2 36,3 Oyenuga, Naomi; Cobo-Díaz, José Francisco; Alvarez-Ordóñez, Avelino; Alexa, Elena-Alexandra «Overview of Antimicrobial Resistant ESKAPEE Pathogens in Food Sources and Their Implications from a One Health Perspective» (en anglès). Microorganisms, 12, 10, 10-2024, pàg. 2084. DOI: 10.3390/microorganisms12102084. ISSN: 2076-2607.
- ↑ Manhique, Glória Alberto; Hessel, Claudia Titze; Plessis, Erika M. DU; Lopes, Stefani Machado; Elias, Susana de Oliveira «Prevalence of Enterobacteriaceae on Ready to Eat Salads, Drinking Water and Surfaces in Food Markets of Maputo, Mozambique» (en anglès). Journal of Food and Nutrition Research, 8, 1, 07-02-2020, pàg. 63–73. DOI: 10.12691/jfnr-8-1-9. ISSN: 2333-1119.
- ↑ 38,0 38,1 Stiles, M E; Ng, L K «Enterobacteriaceae associated with meats and meat handling». Applied and Environmental Microbiology, 41, 4, 4-1981, pàg. 867–872. DOI: 10.1128/aem.41.4.867-872.1981. PMC: PMC243825. PMID: 7195193.
- ↑ Kandhai, M. Chantal; Reij, Martine W.; Gorris, Leon G. M.; Guillaume-Gentil, Olivier; van Schothorst, Mike «Occurrence of Enterobacter sakazakii in food production environments and households». Lancet (London, England), 363, 9402, 03-01-2004, pàg. 39–40. DOI: 10.1016/S0140-6736(03)15169-0. ISSN: 1474-547X. PMID: 14723994.
- ↑ Fraser, Susan L «Enterobacter Infections: Practice Essentials, Background, Pathophysiology». Medscape, 28-10-2024.
- ↑ «ENTEROBACTERIACEAE EN ALIMENTOS» (en castellà). Cátedra de Microbiología Especial. Carrera de Microbiología Clínica e Industrial. FCV. UNLP, 2009. [Consulta: 16 desembre 2024].
- ↑ Cai, Shiqi; Quan, Jingjing; Wang, Zhengan; Hu, Huangdu; Han, Xinhong «High prevalence of carbapenem-resistant Enterobacter cloacae complex in a tertiary hospital over a decade» (en anglès). Microbiology Spectrum, 30-10-2024. DOI: 10.1128/spectrum.00780-24. ISSN: 2165-0497.
- ↑ 43,0 43,1 Fei, Na; Zhao, Liping «An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice» (en anglès). The ISME Journal, 7, 4, 01-04-2013, pàg. 880–884. DOI: 10.1038/ismej.2012.153. ISSN: 1751-7362.
- ↑ Morhart, Patrick; Gerlach, Roman G.; Kunz, Caroline; Held, Jürgen; Valenza, Giuseppe «Application of Next-Generation Sequencing to Enterobacter Hormaechei Subspecies Analysis during a Neonatal Intensive Care Unit Outbreak» (en anglès). Children, 10, 10, 16-10-2023, pàg. 1696. DOI: 10.3390/children10101696. ISSN: 2227-9067.
- ↑ Arumugam, A.; Sandhya, M.; Ponnusami, V. «Biohydrogen and polyhydroxyalkanoate co-production by Enterobacter aerogenes and Rhodobacter sphaeroides from Calophyllum inophyllum oil cake» (en anglès). Bioresource Technology, 164, 7-2014, pàg. 170–176. DOI: 10.1016/j.biortech.2014.04.104.
- ↑ Singh, Pratiksha; Singh, Rajesh Kumar; Li, Hai-Bi; Guo, Dao-Jun; Sharma, Anjney «Diazotrophic Bacteria Pantoea dispersa and Enterobacter asburiae Promote Sugarcane Growth by Inducing Nitrogen Uptake and Defense-Related Gene Expression». Frontiers in Microbiology, 11, 12-01-2021. DOI: 10.3389/fmicb.2020.600417. ISSN: 1664-302X. PMC: PMC7835727. PMID: 33510724.
- ↑ Su, Hsiang-Yen; Li, Hua-Ying; Xie, Cai-Yun; Fei, Qiang; Cheng, Ke-Ke «Co-production of acetoin and succinic acid by metabolically engineered Enterobacter cloacae» (en anglès). Biotechnology for Biofuels, 14, 1, 12-2021. DOI: 10.1186/s13068-021-01878-1. ISSN: 1754-6834. PMC: PMC7816431. PMID: 33468210.
- ↑ Kumari, Kajal; Nagar, Sushil; Goyal, Sakshi; Maan, Sonu; Sindhu, Meena «Production, Characterization and Prebiotic Potential of Xylooligosaccharides Produced from Wheat Bran using Enterobacter hormaechei KS1 Xylanase» (en anglès). Indian Journal of Microbiology, 63, 3, 9-2023, pàg. 352–360. DOI: 10.1007/s12088-023-01097-2. ISSN: 0046-8991. PMC: PMC10533776. PMID: 37781003.
- ↑ Nawaz, Muhammad Zohaib; Xu, Chunyan; Qaria, Majjid A.; Zeeshan Haider, Syed; Rameez Khalid, Hafiz «Genomic and biotechnological potential of a novel oil-degrading strain Enterobacter kobei DH7 isolated from petroleum-contaminated soil» (en anglès). Chemosphere, 340, 11-2023, pàg. 139815. DOI: 10.1016/j.chemosphere.2023.139815.
- ↑ López Villacis, Isabel C.; Santana, Rita C.; Artieda, Jorge R.; Vásquez, Carlos L. «Evaluación del potencial energético de biomasa residual agrícola como recurso energético renovable en Tungurahua, Ecuador». Revista Boliviana de Química, 41, 1, 30-04-2024. DOI: 10.34098/2078-3949.41.1.3. ISSN: 0250-5460.
