Ferro
| Ferro | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
26Fe
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Metàl·lica brillant amb un matís grisós  Línies espectrals del ferro | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Ferro, Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 8, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 55,845(2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 3d6 2, 8, 14, 2 
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
7,874 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
6,98 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.811 K, 1.538 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.134 K, 2.862 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 13,81 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 340 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,10 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 8,[1] 7,[1] 6, 5[2], 4, 3, 2, 1[3], -1, -2 (òxid amfòter) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,83 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 762,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.561,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.957 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 132±3 (espín baix), 152±6 (espín alt) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en el cos a=286.65 pm; Cúbica centrada en la cara entre 1185–1667 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Ferromagnètic | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1.043 K | |||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 96,1 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 80,4 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 11,8 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) (electrolític) 5.120 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 211 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 82 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,29 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 608 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 490 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del ferro | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El ferro és l'element químic de símbol Fe i nombre atòmic 26. Es tracta d'un metall pertanyent a la primera sèrie de transició i el grup 8 de la taula periòdica. És el quart element més abundant en l'escorça terrestre pel que fa a la massa, just per davant de l'oxigen (32,1% contra 30,1%), i constitueix una part substancial del nucli extern i el nucli intern de la Terra.
Per extreure metall aprofitable de menes de ferro, calen forns que arribin com a mínim a 1.500 °C, és a dir, uns 500 °C més del que cal per a la fosa del coure. Els éssers humans començaren a dominar aquesta tècnica a l'Euràsia del II mil·lenni aC. A partir d'aleshores, les eines i les armes de ferro anaren substituint els aliatges de coure, fet que marca la transició entre l'edat de bronze i l'edat de ferro. En algunes parts del món, aquest esdeveniment es produí en temps més aviat recents, cap al 1200 aC.
També és un dels elements més importants de l'Univers, i el nucli de la Terra (Nife) està format principalment per ferro i níquel, que al moure's pel moviment del planeta genera un camp magnètic. Ha estat històricament molt important com a element que lliga tècnica i cultura humanes, fins al punt que un període de la història de la humanitat rep el nom d'edat del ferro.[4]
Propietats fisicoquímiques
[modifica]És un metall mal·leable, tenaç, de color gris argentat i presenta propietats magnètiques; és ferromagnètic a temperatura ambient.
Es troba en la naturalesa formant part de nombrosos minerals, molts dels quals són òxids, i rarament es troba lliure. Per a obtenir ferro en estat elemental, els òxids es redueixen amb carboni i després és sotmès a un procés de refinat per a eliminar les impureses presents. L'òxid més abundant és l'òxid de ferro III, de fórmula Fe₂O₃.
Fonamentalment s'empra en la producció d'acers, consistents en aliatges de ferro amb altres elements, tant metàl·lics com no metàl·lics, que confereixen distintes propietats al material. Es considera que un aliatge de ferro és acer si conté un 0.008% i un 2,1% de carboni; si el percentatge és entre un 2,1% i un 6,67%, rep el nom de fosa.
És l'element més pesant que es produeix exotèrmicament per fusió, i el més lleuger que es produeix a través d'una fissió, pel fet que el seu nucli té la més alta energia d'enllaç per nucleó (energia necessària per a separar del nucli un neutró o un protó); per tant, el nucli més estable és el del ferro-56.
Presenta diferents formes estructurals depenent de la temperatura:
- Ferro α: És la que es troba a temperatura ambient; fins als 788 °C. El sistema cristal·lí és una xarxa cúbica centrada en el cos i és ferromagnètic.
- Ferro β: 788 °C - 910 °C; té el mateix sistema cristal·lí que la α, però la temperatura de Curie és de 770 °C, i passa a ser paramagnètic.
- Ferro γ: 910 °C - 1400 °C; presenta una xarxa cúbica centrada en les cares.
- Ferro δ: 1400 °C - 1539 °C; torna a presentar una xarxa cúbica centrada en el cos.
Ocurrència a la natura
[modifica]
El ferro és el sisè element químic més abundant a l'Univers, format en l'acte final de la nucleosíntesi, pel procés de fusió del silici. Si bé representa aproximadament un 5% de l'escorça terrestre, es creu que el nucli de la Terra està format per un aliatge de ferro-níquel, constituint un 35% del total de la massa de la Terra. El ferro és conseqüentment l'element més abundant a la Terra, però només el quart element més abundant a l'escorça.[5] Gran part del ferro es troba combinat amb oxigen com a minerals d'òxid de ferro, com l'hematites i la magnetita.
Un de cada vint meteorits estan formats per mineral de níquel-ferro: taenite (35-80% de ferro) i kamacite (90-95% de ferro). Encara que rar, els meteorits fèrrics són la forma essencial de ferro metàl·lic natural a la superfície de la Terra.
El color vermell de la superfície de Mart es pensa que és a causa d'un ferro ric en òxid, la regolita.
Aplicacions
[modifica]El ferro és el metall més utilitzat, amb el 95% en pes de la producció mundial de metall. És molt popular a causa del seu baix preu i duresa, especialment en automòbils, vaixells i components estructurals d'edificis.
El diagrama de fases ferro-carboni caracteritza els acers i les foses. Fins a un valor del 2,1% de carboni en pes es troben els acers. Entre un 2,1% i un 6,67% de carboni, les foses. Aquest valor de 2,1% correspon a la solubilitat màxima del carboni en ferro, que es troba a la fase γ o austenita, i que es troba a una temperatura de 1146 °C.[6]
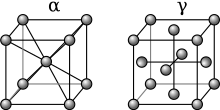
L'austenita és una solució intersticial de carboni en ferro amb estructura de xarxa cúbica centrada en les cares (CCC). La fase α o ferrita té una solubilitat del carboni molt més baixa: un 0,02% a 723 °C. La ferrita té una estructura de xarxa cúbica centrada en el cos (CC).
Al domini dels acers trobem un punt eutectoide per a una concentració de carboni del 0,77% i una temperatura de 723 °C. Pels acers hipoeutectoides, l'excés de carboni dissolt a la fase γ es combina amb el ferro creant perlita. Pels acers hipereutectoides, a més de la perlita, es necessita per absorbir aquest carboni la ledeburita, que porta un 4,5% de carboni i és un aliatge eutèctic d'austenita i cementita (Fe₃C).
L'acer és l'aliatge de ferro més conegut, sent aquest el seu ús més freqüent. Els aliatges ferris presenten una gran varietat de propietats mecàniques, depenent de la seva composició o el tractament que s'hagi dut a terme.

- Els acers són aliatges de ferro i carboni, així com altres elements. Depenent del seu contingut en carboni es classifiquen en:
- Acer baix en carboni. Menys del 0,25% de C en pes. Són tous però dúctils. S'utilitzen en vehicles, canonades, elements estructurals, etcètera. També hi ha els acers d'alta resistència i baix aliatge, que contenen altres elements aliats fins a un 10% en pes; tenen una major resistència mecànica i poden ser treballats fàcilment.
- Acer mitjà en carboni. Entre un 0,25% i un 0,6% de C en pes. Per a millorar les seves propietats són tractats tèrmicament. Són més resistents que els acers baixos en carboni, però menys dúctils; s'empren en peces d'enginyeria que requereixen una alta resistència mecànica i al desgast.
- Acer alt en carboni. Entre un 0,60% i un 1,4% de C en pes. Són encara més resistents, però també menys dúctils. S'afegeixen altres elements perquè formen carburs, per exemple, amb wolframi es forma el carbur de wolframi, WC; aquests carburs són molt durs. Aquests acers s'empren principalment en la fabricació d'eines.
- Un dels inconvenients del ferro és que s'oxida amb facilitat. Hi ha una sèrie d'acers als quals s'afegeixen altres elements aliats (principalment crom) perquè siguin més resistents a la corrosió, s'anomenen acers inoxidables.
- Quan el contingut en carboni és superior a un 2,1% en pes, l'aliatge es denomina fosa. Generalment tenen entre un 3% i un 4,5% de C en pes. Hi ha distints tipus de foses (gris, esferoïdal, blanca i mal·leable); segons el tipus s'utilitzen per a distintes aplicacions: en motors, vàlvules, engranatges, etcètera.
- Per altra banda, els òxids de ferro tenen moltes aplicacions: en pintures, obtenció de ferro, la magnetita (Fe₃O₄) i l'òxid de ferro III en aplicacions magnètiques, etcètera.
Compostos
[modifica]
Els estats d'oxidació del ferro són;
- L'estat Ferro (-II), Fe2- (p. ex. Fe(CO)₄2-,Fe(CO)₂(NO)₂.
- L'estat Ferro (0), Fe(CO)₅, Fe(PF₃)₅.
- L'estat Ferro (I), [Fe(H₂O)₅NO]2+.
- L'estat Ferro (II), Fe2+, anteriorment conegut com a ferrós, és molt comú.
- L'estat Ferro (III), Fe3+, anteriorment conegut com a fèrric, és també molt comú, per exemple en el rovell.
- L'estat Ferro (IV), Fe4+, anteriorment conegut com a ferril, estabilitzat en alguns enzims (p. ex. peroxidases).
- L'estat Ferro (VI), Fe6+ es troba rarament, en el ferrat potàssic.
Els òxids de ferro més coneguts són l'òxid de ferro (II), FeO, l'òxid de ferro (III), Fe₂O₃, i l'òxid mixt Fe₃O₄. Forma així mateix nombroses sals i complexos en aquests estats d'oxidació. L'hexacianoferrat (II) de ferro (III), utilitzat en pintures, s'ha denominat blau de Prússia o blau de Turnbull; es pensava que eren substàncies diferents.

Es coneixen compostos en l'estat d'oxidació +4, +5 i +6, però són poc comuns, i en el cas del +5, no està ben caracteritzat. El ferrat de potassi, K₂FeO₄, en el qual el ferro està en estat d'oxidació +6, s'empra com a oxidant. L'estat d'oxidació +4 es troba en uns pocs compostos i també en alguns processos enzimàtics.
- El Fe₃C es coneix com a cementita, conté un 6,67% en carboni,[7] el ferro α és conegut com a ferrita, i a la mescla de ferrita i cementita, perlita o ledeburita depenent del contingut en carboni. L'austenita és el ferro γ.
Història
[modifica]Es tenen indicis d'ús del ferro, segurament procedent de meteorits, quatre mil·lennis abans de Crist, per part dels sumeris i egipcis.
Entre dos i tres mil·lennis abans de Crist van apareixent cada vegada més objectes de ferro (que es distingeix del ferro procedent de meteorits per l'absència de níquel) a Mesopotàmia, Anatòlia i Egipte. No obstant això, el seu ús sembla cerimonial, sent un metall molt car, més que l'or. Algunes fonts suggereixen que tal vegada es va obtenir com subproducte de l'obtenció de coure. Entre el 1600 aC i el 1200 aC, va augmentar el seu ús a l'Orient Mitjà, però no substitueix a l'ús predominant del bronze.
Entre els segles xii i x aC, es produeix una ràpida transició a l'Orient Mitjà des de les armes de bronze a les de ferro. Aquesta ràpida transició tal vegada fou deguda a la falta d'estany, més que a una millora en la tecnologia del treball del ferro. Aquest període, que es va produir en diferents dates segons el lloc, es denomina edat de ferro, substituint a l'edat del bronze. A l'antiga Grècia va començar a emprar-se entorn de l'any 1000 aC, i no va arribar a Europa occidental fins al segle vii aC. La substitució del bronze pel ferro va ser gradual, perquè era difícil fabricar peces de ferro: localitzar el mineral, després fondre-ho a temperatures altes, per a finalment forjar-ho.
A Europa Central, va sorgir en el segle ix aC la cultura de Hallstatt (substituint la cultura dels camps d'urnes, que es denomina primera Edat de Ferro, perquè coincideix amb la introducció d'aquest metall.
Cap al 450 aC es va desenvolupar la cultura de La Tène, també denominada segona edat de ferro. El ferro s'usa en eines, armes i joieria, encara que segueixen trobant-se objectes de bronze.
Junt amb aquesta transició del bronze al ferro es va descobrir el procés de carburització, consistent a afegir carboni al ferro. El ferro s'obtenia com una mescla de ferro i escòria, amb quelcom de carboni o carburs, i era forjat, extraient l'escòria i oxidant el carboni, creant així el producte ja amb una forma. Aquest ferro forjat tenia un contingut en carboni molt baix i no es podia endurir fàcilment al refredar-lo amb aigua. Es va observar que es podia obtenir un producte molt més dur escalfant la peça de ferro forjat en un llit de carbó vegetal, per a llavors submergir-lo en aigua o oli.
El producte resultant, que tenia la superfície d'acer, era més dur i menys fràgil que el bronze, al qual va començar a reemplaçar.
A l'Xina, el primer ferro que es va utilitzar també procedia de meteorits, havent-se trobat objectes de ferro forjat al nord-oest, prop de Xinjiang, del segle viii aC. El procediment era el mateix que l'utilitzat a Orient Mitjà i Europa.
Als últims anys de la dinastia Zhou (550 aC), a la Xina s'aconsegueix obtenir ferro colat (producte de la fusió de l'arrabi). El mineral trobat allí presenta un alt contingut en fòsfor, amb la qual cosa fon a temperatures menors que a Europa i altres llocs. Encara que va durar força temps, fins a la dinastia Qing (cap a 221 aC) no va tenir una gran repercussió.
El ferro colat va tardar més a arribar a Europa, perquè no s'aconseguia la temperatura suficient. Algunes de les primeres mostres de ferro colat s'han trobat a Suècia, a Lapphyttan i Vinarhyttan, del 1150 i 1350.
A l'edat mitjana, i fins al segle xix, molts països europeus empraven com a mètode siderúrgic la farga catalana. S'obtenia ferro i acer baix en carboni emprant carbó vegetal i mineral de ferro. Aquest sistema estava ja implantat al segle xv, i s'aconseguien temperatures de fins a uns 1200 °C. Aquest procediment va ser substituït per l'emprat als alts forns.
En un principi s'utilitzava carbó vegetal per a l'obtenció de ferro com a font de calor i com a agent reductor. Durant el segle xviii, a Anglaterra, va començar a escassejar i fer-se més car el carbó vegetal, i això va fer que comencés a utilitzar-se carbó de coc, un combustible fòssil, com a alternativa. Va ser utilitzat per primera vegada per Abraham Darby, a l'inici del segle xviii, que va construir a Coalbrookdale, Anglaterra, un alt forn. Així mateix, el coc es va emprar com a font d'energia durant la Revolució Industrial. En aquest període la demanda de ferro va ser cada vegada major, per exemple per a la seva aplicació en el ferrocarril. L'alt forn va anar evolucionant al llarg dels anys. Henry Cort, el 1784, va aplicar noves tècniques que en van millorar la producció. El 1826, l'alemany Friedrich Harkot va construir un alt forn sense maçoneria per als fums.
Al pas del segle xviii al xix, es va començar a emprar àmpliament el ferro com a element estructural (en ponts, edificis, etcètera). Entre el 1776 i 1779 es construí el primer pont de fosa de ferro, construït per John Wilkinson i Abraham Darby. A Anglaterra s'emprà per primera vegada en la construcció d'edificis, per Mathew Boulton i James Watt, a principi del segle xix. També són conegudes altres obres d'aqueix segle, per exemple el Crystal Palace construït per a l'Exposició Universal de 1851 a Londres, de l'arquitecte Joseph Paxton, que té una carcassa de ferro; o la Torre Eiffel, a París, construïda el 1889 per a l'Exposició Universal, on es van utilitzar milers de tones de ferro.
Abundància i obtenció
[modifica]

És el metall de transició més abundant en l'escorça terrestre, i el quart més abundant de tots els elements. També abunda en tot l'Univers, havent-se trobat en meteorits.
Es troba formant part de nombrosos minerals, entre els quals destaquen: l'hematites (Fe₂O₃), la magnetita (Fe₃O₄), la limonita (FeO(OH)), la siderita (FeCO₃), la pirita (FeS₂), ilmenita (FeTiO₃), etcètera.
Es pot obtenir ferro a partir dels òxids amb més o menys impureses. Molts dels minerals de ferro són òxids, i els que no ho són, es poden oxidar per a obtenir els corresponents òxids.
La reducció dels òxids per a obtenir ferro es du a terme en un forn denominat habitualment alt forn. En ell s'afegeixen els minerals de ferro, en presència de carbó de coc i carbonat de calci, CaCO₃ (que actua com a escorificant).
Els gasos resultants, poden intervenir en una sèrie de reaccions; el coc pot reaccionar amb l'oxigen per a formar diòxid de carboni:
- C + O₂ → CO₂
Al seu torn el diòxid de carboni pot reduir-se per a donar monòxid de carboni:
- CO₂ + C → 2CO
Encara que també es pot donar el procés contrari en oxidar-se el monòxid de carboni amb oxigen per a tornar a donar diòxid de carboni:
- 2CO + O₂ → 2CO₂
El procés d'oxidació de coc amb oxigen allibera energia i s'utilitza per a escalfar el forn, arribant fins a uns 1900 °C en la part inferior del forn. La part superior del forn no està tan calenta.
En primer lloc els òxids de ferro poden reduir-se, parcialment o totalment, amb el monòxid de carboni, CO; per exemple:
- Fe₃O₄ + 3CO → 3FeO + CO₂
- FeO + CO → Fe + CO₂
Després, a mesura que arriba a parts més baixes del forn i la temperatura augmenta, reaccionen amb el coc (carboni en la seva major part), reduint-se els òxids. Per exemple:
- Fe₃O₄ + C → 3FeO + CO
El carbonat de calci es descompon:
- CaCO₃ → CaO + CO₂
I el diòxid de carboni és reduït amb el coc a monòxid de carboni com s'ha vist abans.
Més avall es produeixen processos de carburació:
- 3Fe + 2CO → Fe₃C + CO₂
Finalment, es produeix la combustió i dessulfuració (eliminació de sofre) mitjançant l'entrada d'aire. I finalment se separen dues fraccions: l'escòria i el ferro colat (arrabio en castellà), que és la matèria primera que després s'empra en la indústria.
El ferro colat sol contenir força impureses no desitjables, i és necessari sotmetre'l a un procés de refinat en forns anomenats convertidors.
L'any 2000, els cinc majors productors de ferro eren: Xina, el Brasil, Austràlia, Rússia i l'Índia. Conjuntament sumaven el 70% de la producció mundial.
Indústria extractiva del mineral de ferro
[modifica]Les principals empreses productores de mineral de ferro al món el 2008 van ser:[8]
- BHP Billiton i Rio Tinto (39,6% del mercat mundial estimat el 2008, en cas de fusió).
- Vale (antiga CVRD) (Brasil) (35,7%).
- Rio Tinto (Regne Unit) (24%).
- BHP-Billiton (Regne Unit-Austràlia) (16%).
- Fortescue Metals Group (austràlia) (5,4%).
- Kumba (companyia sud-africana de propietaris britànics) (5,2%).
- Altres (LKAB, SNIM, CVG Ferrominera, Hierro Peru, Kudremukh, CAP) (13,7%).
L'any 2007, la Xina va produir un terç de l'acer mundial i al voltant del 50% de les exportacions del mineral de ferro.[9]
Rol biològic
[modifica]
El ferro es troba en pràcticament tots els éssers vius i compleix nombroses i variades funcions.
- Hi ha diferents proteïnes que contenen el grup hemo, que consisteix en el lligand porfirina amb un àtom de ferro. Alguns exemples:
- L'hemoglobina i la mioglobina; la primera transporta oxigen, O₂, i la segona l'emmagatzema.
- Els citocroms; els citocroms c catalitzen la reducció d'oxigen a aigua. Els citocroms P450 catalitzen l'oxidació de compostos hidrofòbics, com a fàrmacs o drogues, perquè puguin ser excretats, i participen en la síntesi de distintes molècules.
- Les peroxidases i catalases catalitzen l'oxidació de peròxids, H₂O₂, que són tòxics.
- Les proteïnes de ferro/sofre (Fe/S) participen en processos de transferència d'electrons.
- També es poden trobar proteïnes, on àtoms de ferro s'enllacen entre si a través d'enllaços pont d'oxigen. Es denominen proteïnes Fe-O-Fe. Alguns exemples:
- Els bacteris metanotròfics, que empren el metà, CH₄, com a font d'energia i de carboni, usen proteïnes d'aquest tipus, anomenades monooxigenases, per a catalitzar l'oxidació d'aquest metà.
- L'hemeritrina transporta oxigen en alguns organismes marins.
- Algunes ribonucleòtid reductasses contenen ferro. Catalitzen la formació de desoxinucleòtids.
Els animals per a transportar el ferro dins del cos empren unes proteïnes anomenades transferrines. Per a emmagatzemar-lo empren la ferritina i l'hemosiderina. El ferro entra en l'organisme en ser absorbit en l'intestí prim i és transportat o emmagatzemat per aqueixes proteïnes. La major part del ferro es reutilitza i molt poc s'excreta.
Tant l'excés com el defecte de ferro pot provocar problemes en l'organisme. En les transfusions de sang s'empren lligands que formen amb el ferro complexos d'alta estabilitat per a evitar que quedi massa ferro lliure.
Aquests lligants es coneixen com a sideròfors. Molts microorganismes empren aquests sideròfors per a captar el ferro que necessiten. També es poden emprar com a antibiòtics, perquè no deixen ferro lliure disponible.
Fonts nutritives i dietètiques
[modifica]Les millors fonts naturals de ferro dietètic es troben el fetge,[10] la carn de vaca,[10] la carn vermella en general, el peix, els mol·luscs,[10] el rovell d'ou,[10] els llegums,[10] els aliments fets amb sang[10] (com la botifarra negra), la fruita seca[10] i la fruita dessecada.[10] Hom pot prendre el ferro com a complement dietètic, comprat a una farmàcia i recomanat per un metge,[10] o bé ja introduït en algun preparat alimentari. Hi ha quantitats menors de ferro en la melassa, el tef i la semolina.
El ferro de la carn (ferro hemo) i dels aliments d'origen animal en general és molt més fàcil d'absorbir que el ferro dels vegetals.[10][11] Sembla que, per a alguns autors, l'hemo/hemoglobina de la carn vermella té efectes que podrien incrementar la probabilitat de patir càncer colorectal.[12][13]
El ferro és essencial a la dieta dels nens en edat escolar, ja que les necessitats d'aquest mineral als períodes de creixement ràpid són molt elevades.[10]
Isòtops
[modifica]El ferro té quatre isòtops estables naturals: 54Fe, 56Fe, 57Fe i 58Fe. Les abundàncies relatives en què es troben en la naturalesa són d'aproximadament:
54Fe (5,8%), 56Fe (91,7%), 57Fe (2,2%) i 58Fe (0,3%).
Precaucions
[modifica]El ferro en excés és tòxic. El ferro reacciona amb peròxid i produeix radicals lliures; la reacció més important és:
- Fe (II) + O₂ → Fe (III) + OH- + OH·
Quan el ferro es troba dins d'uns nivells normals, els mecanismes antioxidants de l'organisme poden controlar aquest procés.
La dosi letal de ferro en un nen de 2 anys és d'uns 3 grams. Quantitats d'1 gram poden provocar un enverinament important.
El ferro en excés s'acumula en el fetge i hi provoca danys.
Aspectes culturals
[modifica]
El ferro durant molt de temps va ser el metall més dur i per això, ha donat peu a nombroses metàfores, com el cavaller de ferro o la Dama de Ferro (Margaret Thatcher). Una relació de ferro és sòlida i no es pot trencar.
Ha jugat també un paper important a la mitologia. Com que la sang té una olor i un regust del ferro que conté, i la sang és el principi de la vida en moltes cultures, s'ha considerat el ferro com el material de la vida, amb poders especials. Per aquest motiu molts amulets estan fets de ferro. Igualment el ferro fred, oposat a la sang calenta, espanta determinats éssers, com els esperits malèfics (d'aquí la superstició d'usar una ferradura per atreure la sort o esquivar la dolenta). Els forjadors del ferro eren déus poderosos i sovint infernals, com l'Hefest grec.
Les característiques magnètiques del ferro van multiplicar les llegendes sobre el seu poder i sempre s'ha associat a la terra. Més endavant, també es va associar al planeta Mart i en va usar el mateix símbol, relació que va fomentar l'alquímia. L'origen d'aquesta es deu d'una banda al fet que Mart fos el déu de la guerra (i les espases de ferro les més preuades)[14] i d'altra al color vermell del planeta (que reforça la relació ferro-sang).
Referències
[modifica]- ↑ 1,0 1,1 «Higher Oxidation States of Iron in Solid State: Synthesis and Their Mössbauer Characterization - Ferrates - ACS Symposium Series (ACS Publications)». http://pubs.acs.org/doi/abs/10.1021/bk-2008-0985.ch007, 2008. DOI: 10.1595/147106704X10801.
- ↑ Demazeau, G.; Buffat, B.; Pouchard, M.; Hagenmuller, P. «Recent developments in the field of high oxidation states of transition elements in oxides stabilization of Six-coordinated Iron(V)». Zeitschrift für anorganische und allgemeine Chemie, 491, 1982, pàg. 60. DOI: 10.1002/zaac.19824910109.
- ↑ R. S. Ram and P. F. Bernath Journal of Molecular Spectroscopy, 221, 2003, pàg. 261. Bibcode: 2003JMoSp.221..261R. DOI: 10.1016/S0022-2852(03)00225-X.
- ↑ Diccionario de Arte I (en castellà). Barcelona: Biblioteca de Consulta Larousse. Spes Editorial SL (RBA), 2003, p.284. ISBN 84-8332-390-7 [Consulta: 1r desembre 2014].
- ↑ «Iron: geological information». [Consulta: 21 maig 2008].
- ↑ Diverses fonts no coincideixen en aquest valor, que ha estat arrodonit al 2,1%, ja que el valor exacte és una qüestió acadèmica degut a la dificultat d'obtenir acer pur amb només Fe i C. De totes formes, cal desmitificar el clàssic 1,76% erroni d'alguns texts. Vegeu:
- Smith, William F.; Hashemi, Javad (2006). Foundations of Materials Science and Engineering (4th ed.). McGraw-Hill. ISBN 0-07-295358-6, p. 363—2,08%.
- Degarmo, E. Paul; Black, J T.; Kohser, Ronald A. (2003). Materials and Processes in Manufacturing (9th ed.). Wiley. ISBN 0-471-65653-4. p. 75 —2,11%.
- Ashby, Michael F.; Jones, David Rayner Hunkin (1992). An introduction to microstructures, processing and design. Butterworth-Heinemann. —2,14%.
- ↑ Materials per a l'enginyeria. Ed. Univ. Politéc. Valencia, 2004, p.36. ISBN 8497056809.
- ↑ Bernstein Resaerch, a Les Echos del 5 de febrer del 2008, pàgina 35
- ↑ Alain Faujas, «Le minerai de fer augmentera d'au moins 65% en 2008 », Le Monde, 20-02-2008
- ↑ «Food Standards Agency - Eat well, be well - Iron deficiency». Arxivat de l'original el 2006-08-08. [Consulta: 20 abril 2009].
- ↑ Sesink AL, Termont DS, Kleibeuker JH, Van der Meer R «Red meat and colon cancer: the cytotoxic and hyperproliferative effects of dietary heme». Cancer Research, 59, 22, 1999, pàg. 5704–9. PMID: 10582688.
- ↑ Glei M, Klenow S, Sauer J, Wegewitz U, Richter K, Pool-Zobel BL «Hemoglobin and hemin induce DNA damage in human colon tumor cells HT29 clone 19A and in primary human colonocytes». Mutat. Res., 594, 1-2, 2006, pàg. 162–71. DOI: 10.1016/j.mrfmmm.2005.08.006. ISSN: 0027-5107. PMID: 16226281.
- ↑ Aldersey-Williams, La tabla periódica, Ariel, 2013
Bibliografia
[modifica]- Doulias PT, Christoforidis S, Brunk UT, Galaris D. Endosomal and lysosomal effects of desferrioxamine: protection of HeLa cells from hydrogen peroxide-induced DNA damage and induction of cell-cycle arrest. Free Radic Biol Med. 2003;35:719-28.
- H. R. Schubert, History of the British Iron and Steel Industry ... to 1775 AD (Routledge, Londres, 1957)
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
- R. F. Tylecote, History of Metallurgy (Institute of Materials, London 1992).
- R. F. Tylecote, 'Iron in the Industrial Revolution' in J. Day and R. F. Tylecote, The Industrial Revolution in Metals (Institute of Materials 1991), 200-60.
- Vagn Fabritius Buchwald: Iron and steel in ancient times. Kong. Danske Videnskab. Selskab, Kobenhagen 2005, ISBN 87-7304-308-7
- James F. Shackelford, Introducción a la Ciencia de Materiales para Ingenieros, 4ª Ed. Madrid 1998, ISBN 84-8322-047-4
Enllaços externs
[modifica]- WebElements.com - Ferro (anglès)
- EnvironmentalChemistry.com - Ferro (anglès)
- It's Elemental - Ferro (anglès)
- Els nuclis de ferro amb enllaços més ferms (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||

