Enllaç C-Mo
Els compostos d'organomolibdè (o compostos orgànics del molibdè) són compostos químics que contenen un enllaç químic entre carboni (C) i molibdè (Mo) (enllaç C-Mo).
-
Estructura de Mo(CH₃)₅, un compost organomolibdè simple.[1]
La química de l'organomolibdè és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos. Els elements més pesats del grup 6 (el molibdè i el tungstè), formen compostos organometàl·lics similars als de la química dels organocroms, però els estats d'oxidació més alts solen ser més comuns.[2]
Mo(0) i estats més reduïts
[modifica]L'hexacarbonil de molibdè és el precursor de molts derivats substituïts. Reacciona amb reactius d'organoliti per donar acils aniònics que poden ser O-alquilats per donar carbens de Fischer.
-
Estructura del (mesitilè)molibdè tricarbonil
El Mo(CO)₆ reacciona amb els arens per donar complexos de «cadira d'escriptori amb rodes» com el (mesitilè)molibdè tricarbonil. El (cicloheptatriè)molibdè tricarbonil, que està relacionat amb (arè)Mo(CO)₃, reacciona amb sals de tritil per donar el complex cicloheptatrienil:[3]
- (C₇H₈)Mo(CO)₃ + (C₆H₅)₃C+ → [(C₇H₇)Mo(CO)₃]+ + (C₆H₅)₃CH
-
Estructura del (cicloheptatriè)molibdè tricarbonil
La reducció de Mo(CO)₆ dona [Mo(CO)₅]2− que formalment és Mo(-II).[4]
Els compostos de Mo(0) lliures de CO tendeixen a ser més reductors i cinèticament labils que els complexos de carbonil.[5] Alguns exemples inclouen bis(benzè)molibdè (Mo(C₆H₆)₂) i tris(butadiè)molibdè. Aquests compostos es poden preparar per síntesi de vapor metàl·lic i vies reductives a partir de clorur de molibdè(V).[6]
Mo(II)
[modifica]L'halogenació de Mo(CO)₆ dona halogenurs de carbonil de Mo(II), que també són precursors versàtils.[7] Una gran col·lecció de compostos té la fórmula (C₅R₅)Mo(CO)₃X, derivada del dímer de(ciclopentadienil)molibdè tricarbonil (X = halogenur, hidrur, alquil).
El tractament de l'acetat de molibdè(II) amb metil·liti dona Li₄[Mo₂(CH₃)₈].[8]
Mo(IV)
[modifica]Amb la fórmula del tipus Cp₂MoX₂, el diclorur de molibdocè (X = Cl) i el dihidrur de molibdocè (X = H) es coneixen com anàlegs d'ansa-metal·locè.
Mo(V) i Mo(VI)
[modifica]Es coneixen Mo(CH₃)₅, Mo(CH₃)₆ i les sals de [Mo(CH₃)₇]−.[5]
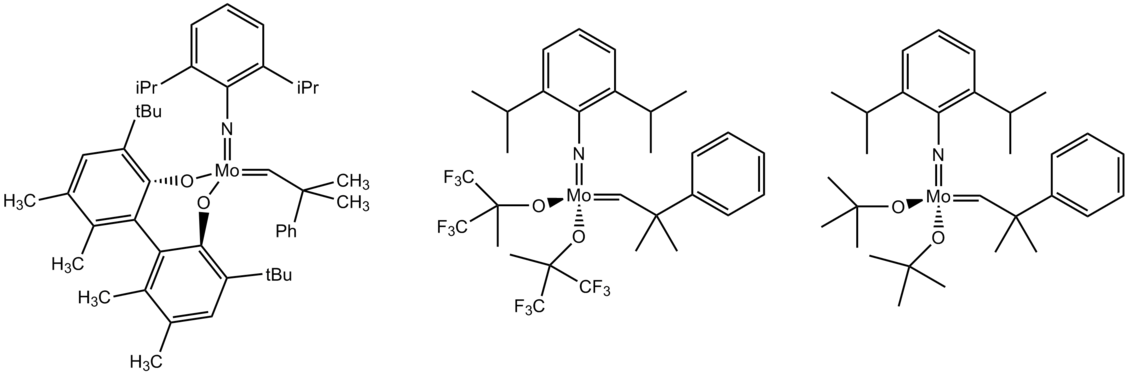
Els lligands -oxo i imida (RN=) es troben en diversos compostos d'organomolibdè en estat d'oxidació elevat. Els complexos (C₅R₅)MoO₂X són il·lustratius.[9] Els catalitzadors de metàtesi d'olefines de Schrock basats en molibdè presenten centres de molibdè(VI) recolzats per lligands alcòxid, alquilidè i imido.[10]
Els complexos de neopentilidina de molibdè dotats de fenolats estèricament exigents o d'alcòxids fluorats ramificats són catalitzadors per a la metàtesi d'olefines.[11] Tanmateix, la preparació d'aquests catalitzadors és problemàtica pel procediment estàndard de Schrock. L'espècie 17 de trisalcòxid és activa a temperatura ambient.[12]
El complex precursor complex 18 relacionat ofereix encara més oportunitats, que originalment està dissenyat per a la escissió estequiomètrica del dinitrogen.[13][14] De fet, quan es tracta el complex 18 amb DCM en toluè, l'espècie principal formada és un complex 19 de metilidina i un complex 20 de monoclorur.[15]
-
Complex Mo(III)
Més important encara, la combinació del complex 18 i DCM tolera nombrosos grups polars; per exemple, les amines bàsiques i els sulfurs, que desactiven el complex més àcid de Lewis com el complex de Schrock. Després d'aquest descobriment original, Moore i els seus col·laboradors van provar RCHCl₂ de diclorur geminal més alt com a agents activadors per augmentar la vida útil del catalitzador.[16] Per reconvertir el subproducte de clorur, van afegir magnesi en la reacció. A més, després de l'intercanvi de lligands a un lligand deficient d'electrons com el p-nitrofenol, va donar accés a un catalitzador 22 molt actiu, que va ser eficaç en moltes aplicacions, particularment en la química dels polímers i la ciència dels materials.[17] D'altra banda, l'alcoholisi de 21 amb un lligand tridentat comporta una vida útil més llarga i un millor abast del substrat.[18]
Malgrat les característiques favorables d'aquests catalitzadors, el complex 18 s'ha de manejar amb molta cura. Aquest compost no només és molt sensible a l'oxidació i la hidròlisi, sinó que fins i tot és prou reactiu per escindir el nitrogen molecular.
Els complexos de nitrur de molibdè amb lligands Ph₃SiO són un precatalitzador pràctic i tolerant per a la metàtesi d'alquins.[19] Aquest resultat implicava que les alquilidines de molibdè dotades de lligands Ph₃SiO havien de ser molt actives. Per augmentar encara més la viabilitat, l'estabilitat i l'activitat d'aquests catalitzadors, van proposar una ruta independent per preparar directament les alquilidines en lloc dels seus homòlegs de nitril. Mitjançant la complexació amb 1,10-fenantrolina, es pot formar un compost 27 estable a l'aire com a precatalitzador, que es pot activar fàcilment per MnCl₂ o ZnCl₂ en dissolvents.[20] Com es mostra a continuació, aquesta ruta és molt escalable i pràctica.
Compostos d'organotungstè
[modifica]Es coneixen anàlegs de tungstè de gairebé tots els compostos d'organomolibdè. Alguns exemples notables inclouen l'hexametiltungstè i anàlegs dels catalitzadors de metàtesi d'olefines de Schrock.
Molts catalitzadors de metàtesi d'alquins basats en tungstè són del tipus general [X₃W≡CR].[21] L'activitat és manipulada pels lligands. Una ruta típica cap a aquests catalitzadors implica el tractament del reactiu de Grignard neopentil al precursor del tungstè(VI) seguit de l'alcohòlisi neta dels lligands alquils.[22] El complex 3 pot experimentar un intercanvi de lligands amb sals de liti per generar catalitzadors tipus Schrock (complex 4). Una altra manera de fer el complex 4 és mitjançant l'escissió de l'alquí intern pel complex W(III), com ara 5.[23][24]
El complex 2, així com el complex 3, no poden metatetitzar alquins interns, la via relacionada es mostra avall. En detall, el compost 6 (quan X no és OR) reaccionarà amb dos alquins equivalents per formar el complex 7. El complex 7 experimentarà un «camí associatiu» per generar un complex 8 de metal·labencè. Es descompondrà en compostos polimeritzats o un complex ciclopentadienil amb un centre de tungstè formalment reduït.
-
Preparació del catalitzador de Schrock i transformació relacionada
El recompte formal de 12 electrons del centre W(VI) del catalitzador de Schrock representa una acidesa de Lewis apreciable, que limita seriosament l'abast d'aquests catalitzadors. Per exemple, el catalitzador de Schrock no pot metatetitzar substrats que contenen llocs donants o bàsics com ara amines, tioèters o segments d'èter corona. Els grups sensibles a l'àcid com els acetals es poden destruir. La substitució dels lligands de tert-butòxid per alcòxids fluorats augmenta el caràcter àcid de Lewis. Per aconseguir un equilibri, es proposa que funcini un entorn d'empenta/estirada heterolèptic al voltant del centre de tungstè.[25][26][27][28][29]
Per exemple, el complex 13 és molt actiu (amb una càrrega d'1-2% mol suficient) i compatible amb molts grups funcionals.
Aplicacions
[modifica]Els catalitzadors basats en Mo són útils per a la metàtesi d'olefines.[10]
-
Alguns catalitzadors de Schrock disponibles comercialment
Els complexos alquilidí de trisamidomolibdè(VI) catalitzen la metàtesi d'alquins.[30][31]
A l'olefinació de Kauffmann, el clorur de molibdè(III) i el metil·liti formen un complex organometàl·lic capaç de l'olefinació de carbonil.[32]
Referències
[modifica]- ↑ Roessler, Kleinhenza i Seppelt, 2000, p. 1039-1040.
- ↑ Poli, 2008, p. 1592-1612.
- ↑ Green, 1995, p. 439-473.
- ↑ Ellis, 2003, p. 3322-3338.
- ↑ 5,0 5,1 Flower, 2007, p. 513-595.
- ↑ Stephan et al., 2013, p. 5931-5942.
- ↑ Templeton, 1989, p. 1-100.
- ↑ Komiya i Hurano, 1997.
- ↑ Kuehn, Santos i Herrmann, 2005, p. 2483-2491.
- ↑ 10,0 10,1 Schrock, 1986, p. 342-348.
- ↑ McCullough, 1985, p. 5987.
- ↑ Tsai i Cummis, 2000, p. 5260.
- ↑ Cummis, 1998, p. 177-1786.
- ↑ Fürstner, 1999, p. 9453.
- ↑ Agapie, 2002, p. 2412-2413.
- ↑ Zhang i Moore, 2004a, p. 329-335.
- ↑ Zhang i Moore, 2004b, p. 3973.
- ↑ Zhang, 2011, p. 3435-3438.
- ↑ Fürstner, 2009, p. 9468-9470.
- ↑ Fürstner, 2010, p. 11045-11057.
- ↑ Fürstner, 2013, p. 2794-3519.
- ↑ Schrock, 1978, p. 6774.
- ↑ Chisholm, 2007, p. 137-140.
- ↑ Schrock, 1982, p. 4291.
- ↑ Beer, 2007, p. 8890-8894.
- ↑ Haberlag, 2010, p. 8868-8877.
- ↑ Beer, 2009, p. 1534.
- ↑ Wu et al., 2021, p. 4147-4151.
- ↑ Schrock, 2007, p. 475.
- ↑ Zhang, Lu i Moore, 2007, p. 163.
- ↑ Zhang, Mo Cho i Moore, 2007, p. 177.
- ↑ Kauffmann, 1997, p. 1259-1275.
Bibliografia
[modifica]- Agapie, Theodor «Methine (CH) Transfer via a Chlorine Atom Abstraction/Benzene-Elimination Strategy: Molybdenum Methylidyne Synthesis and Elaboration to a Phosphaisocyanide Complex» (en anglès). J. Am. Chem. Soc., 124(11), 2002. DOI: 10.1021/ja017278r. PMID: 11890770.
- Beer, Stephan «Efficient Room-Temperature Alkyne Metathesis with Well-Defined Imidazolin-2-iminato Tungsten Alkylidyne Complexes» (en anglès). Angew. Chem. Int. Ed., 46(46), 2007. DOI: 10.1002/anie.200703184. PMID: 17935104.
- Beer, Stephan «Experimental and Theoretical Investigations of Catalytic Alkyne Cross-Metathesis with Imidazolin-2-iminato Tungsten Alkylidyne Complexes» (en anglès). Organometallics, 28(5), 2009. DOI: 10.1021/om801119t.
- Chisholm, Malcolm H. «Hexakis(Dimethylamido)Ditungsten and Tungsten(IV) Chloride». A: Inorganic Syntheses (en anglès). 29, 2007. DOI 10.1002/9780470132609.ch33. ISBN 9780470132609.
- Cummins, Christopher C «Reductive cleavage and related reactions leading to molybdenum–element multiple bonds: new pathways offered by three-coordinate molybdenum(III)» (en anglès). Chemical Communications, 17, 1998. DOI: 10.1039/A802402B.
- Ellis, J. E «Metal Carbonyl Anions: from [Fe(CO)₄]2− to [Hf(CO)₆]2− and Beyond» (en anglès). Organometallics, 22(17), 2003. DOI: 10.1021/om030105l.
- Flower, K. R. «Molybdenum Compounds without CO or Isonitrile Ligands». A: Comprehensive Organometallic Chemistry III (en anglès). 5, 2007. DOI 10.1016/B0-08-045047-4/00072-8. ISBN 9780080450476.
- Fürstner, Alois «Mo[N(t-Bu)(Ar)₃ Complexes As Catalyst Precursors: In Situ Activation and Application to Metathesis Reactions of Alkynes and Diynes]» (en anglès). J. Am. Chem. Soc., 121(40), 1999. DOI: 10.1021/ja991340r.
- Fürstner, Alois «Molybdenum Nitride Complexes with Ph₃SiO Ligands Are Exceedingly Practical and Tolerant Precatalysts for Alkyne Metathesis and Efficient Nitrogen Transfer Agents» (en anglès). J. Am. Chem. Soc., 131(27), 2009. DOI: 10.1021/ja903259g. PMID: 19534524.
- Fürstner, Alois «Practical New Silyloxy-Based Alkyne Metathesis Catalysts with Optimized Activity and Selectivity Profiles» (en anglès). J. Am. Chem. Soc., 132(32), 2010. DOI: 10.1021/ja104800w. PMID: 20698671.
- Fürstner, Alois «Alkyne Metathesis on the Rise» (en anglès). Angew. Chem. Int. Ed., 52(10), 2013. DOI: 10.1002/anie.201204513. PMID: 23355479.
- Green, M. L. H «Cycloheptatriene and -enyl Complexes of the Early Transition Metals» (en anglès). Chemical Reviews, 95(2), 1995. DOI: 10.1021/cr00034a006.
- Haberlag, Birte «Preparation of Imidazolin-2-iminato Molybdenum and Tungsten Benzylidyne Complexes: A New Pathway to Highly Active Alkyne Metathesis Catalysts» (en anglès). Chem. Eur. J., 16(29), 2010. Arxivat de l'original el 2022-03-06. DOI: 10.1002/chem.201000597. PMID: 20572182 [Consulta: 12 juny 2022].
- Kauffmann, T «Organomolybdenum and organotungsten reagents. 7. Novel reactions of organomolybdenum and organotungsten compounds: additive-reductive carbonyl dimerization, spontaneous transformation of methyl ligands into μ-methylene ligands, and selective carbonylmethylenation» (en anglès). Angew. Chem. Int. Ed. Engl., 36, 1997. DOI: 10.1002/anie.199712581.
- Komiya, S; Hurano, M. Synthesis of Organometallic Compounds: A Practical Guide (en anglès). Sanshiro Komiya Ed, 1997.
- Kuehn, W. A; Santos, A. M; Herrmann «Organorhenium(VII) and Organomolybdenum(VI) Oxides: Syntheses and Application in Olefin Epoxidation» (en anglès). Dalton Trans, 15, 2005. DOI: 10.1039/b504523a. PMID: 16025165.
- McCullough, Laughlin G «Multiple metal-carbon bonds. 38. Preparation of trialkoxymolybdenum(VI) alkylidyne complexes, their reactions with acetylenes, and the x-ray structure of Mo[C₃(CMe₃)₂[OCH(CF₃)₂](C₅H₅N)₂]» (en anglès). J. Am. Chem. Soc., 107(21), 1985, pàg. 5987. DOI: 10.1021/ja00307a025.
- Poli, R «High oxidation state organomolybdenum and organotungsten chemistry in protic environments» (
 PDF) (en anglès). Coord. Chem. Rev., 252(15)-252(17), 2008. DOI: 10.1016/j.ccr.2007.11.029.
PDF) (en anglès). Coord. Chem. Rev., 252(15)-252(17), 2008. DOI: 10.1016/j.ccr.2007.11.029. - Roessler, Beatrice; Kleinhenza, Sven; Seppelt, Konrad «Pentamethylmolybdenum» (en anglès). Chemical Communications, 12, 2000, pàg. 1039–1040. DOI: 10.1039/b000987n.
- Schrock, R «Multiple metal-carbon bonds. 12. Tungsten and molybdenum neopentylidyne and some tungsten neopentylidene complexes» (en anglès). J. Am. Chem. Soc., 100(21), 1978. DOI: 10.1021/ja00489a049.
- Schrock, R «Metathesis of tungsten-tungsten triple bonds with acetylenes and nitriles to give alkylidyne and nitrido complexes» (en anglès). J. Am. Chem. Soc., 104(15), 1982. DOI: 10.1021/ja00379a061.
- Schrock, R. R «High-oxidation-state molybdenum and tungsten alkylidene complexes» (en anglès). Acc. Chem. Res, 19(11), 1986. DOI: 10.1021/ar00131a003.
- Schrock, R. R «Facile Synthesis of a Tungsten Alkylidyne Catalyst for Alkyne Metathesis» (en anglès). Organometallics, 26(3), 2007. DOI: 10.1021/om0610647.
- Stephan, G. C; Naether, C; Peters, G; Tuczek, F «Molybdenum 17- and 18-Electron Bis- and Tris(Butadiene) Complexes: Electronic Structures, Spectroscopic Properties, and Oxidative Ligand Substitution Reactions» (en anglès). Inorg. Chem, 52(10), 2013. DOI: 10.1021/ic400145f. PMID: 23627292.
- Templeton, Joseph L. «"Four-Electron Alkyne Ligands in Molybdenum(II) and Tungsten(II) Complexes" Advances» (en anglès). Organometallic Chemistry, 29, 1989. DOI: 10.1016/S0065-3055(08)60352-4.
- Tsai, Yi-Chou; Cummins, Christopher C «Facile Synthesis of Trialkoxymolybdenum(VI) Alkylidyne Complexes for Alkyne Metathesis» (en anglès). Organometallics, 19(25), 2000. DOI: 10.1021/om000644f.
- Wu, Xian; Daniliuc, Constantin G; Hrib, Cristian G; Tamm, Matthias «Phosphoraneiminato tungsten alkylidyne complexes as highly efficient alkyne metathesis catalysts» (en anglès). Journal of Organometallic Chemistry, 696(25), 2011. DOI: 10.1016/j.jorganchem.2011.06.047. ISSN: 0022-328X. OCLC: 4925450605.
- Zhang, Wei; Moore, Jeffrey «Highly Active Trialkoxymolybdenum(VI) Alkylidyne Catalysts Synthesized by a Reductive Recycle Strategy» (en anglès). J. Am. Chem. Soc., 126(1), 2004a. DOI: 10.1021/ja0379868. PMID: 14709099.
- Zhang, Wei; Moore, Jeffrey «Synthesis of Poly(2,5-thienyleneethynylene)s by Alkyne Metathesis» (en anglès). Macromolecules, 37(11), 2004b. Bibcode: 2004MaMol..37.3973Z. DOI: 10.1021/ma049371g.
- Zhang, Wei; Lu, Yunyi; Moore, Jeffrey S «Preparation of a Trisamidomolybdenum(VI) Propylidyne Complex» (en anglès). Org. Synth., 84, 2007. DOI: 10.15227/orgsyn.084.0163.
- Zhang, Wei; Mo Cho, Hyeon; Moore, Jeffrey S «Preparation of a Carbazole-Based Macrocycle via Precipitation-driven Alkyne Metathesis» (
 PDF) (en anglès). Org. Synth., 84, 2007. Arxivat de l'original el 2020-02-19. DOI: 10.15227/orgsyn.084.0177 [Consulta: 12 juny 2022].
PDF) (en anglès). Org. Synth., 84, 2007. Arxivat de l'original el 2020-02-19. DOI: 10.15227/orgsyn.084.0177 [Consulta: 12 juny 2022]. - Zhang, Wei «Introducing A Podand Motif to Alkyne Metathesis Catalyst Design: A Highly Active Multidentate Molybdenum(VI) Catalyst that Resists Alkyne Polymerization» (en anglès). Angew. Chem. Int. Ed., 50(15), 2011, pàg. 3435–3438. DOI: 10.1002/anie.201007559. PMID: 21394862.

![Estructura de Mo(CH₃)₅, un compost organomolibdè simple.[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/85/DOSBIWoneRotamer.png/300px-DOSBIWoneRotamer.png)