Beri-beri
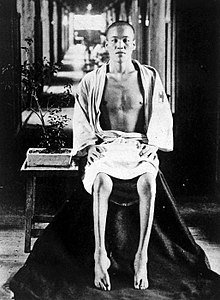 Pacient de beri-beri | |
 | |
| Tipus | deficiència de tiamina, carència alimentària, malaltia, malnutrició i deficiència vitamínica |
|---|---|
| Especialitat | endocrinologia, neurologia i cardiologia |
| Clínica-tractament | |
Medicació | |
| Classificació | |
| CIM-11 | 5B5A.0 |
| CIM-10 | E51.1 |
| CIM-9 | 265.0 |
| Recursos externs | |
| DiseasesDB | 14107 |
| MedlinePlus | 000339 |
| eMedicine | 984721 i 116930 |
| Patient UK | beriberi |
| MeSH | D001602 |
| UMLS CUI | C0005122 |
| DOID | DOID:13725 |
El beri-beri és el nom popular que comprèn un conjunt de trastorns relacionats amb la deficiència de la tiamina (vitamina B1), responsables d'un ampli espectre clínic que es coneix com a trastorns per deficiència de tiamina.[1] La tiamina intervé en processos cel·lulars d'obtenció d'energia, en la generació de pentoses emprades en la síntesi d'àcids nucleics i en la formació de neurotransmissors, entre altres processos biològics.[2] La malaltia resultant d'aquest dèficit nutricional pot afectar tant el sistema nerviós com el sistema circulatori.[3]
L'origen etimològic del mot beri-beri resulta d'un préstec lingüístic de la paraula singalesa beri que es tradueix com a «debilitat». La duplicació de la paraula beri per a referir-se a la malaltia voldria indicar-ne la intensitat d'aquesta.[4] Altres termes sinònims per a referir-se a la malaltia són beriberia, beriberii, beribery o berri berri, malgrat que actualment tots es consideren obsolets.[5]
El beri-beri va tenir una alta prevalença entre els segles XIX i XX en diversos països asiàtics, va esdevenir endèmica d'aquestes regions i va afectar principalment les poblacions que basaven gran part de la seva alimentació en l'arròs polit.[6]
Història
[modifica]Entre els primers registres que es tenen del beri-beri, destaquen les publicacions xineses del segle VIII, on es tracta una afecció que en aquell moment era coneguda, tant a la Xina com al Japó, com a kakké (paraula que expressa una manca de funció correcta de les cames).[7]
L'any 1804, el doctor japonès Tachibana Nankei va descriure en les seves "Notes sobre diverses malalties" les set característiques principals de la malaltia. D'entre aquests signes, Tachinaba destacava els períodes on hi havia més casos, les prefectures japoneses que acostumaven a veure's afectades (on predominava Tòquio i Kyoto), les classes socials que emmalaltien i la simptomatologia general del kakké.[7]
Cap a mitjans del segle XIX, diversos metges occidentals van començar a establir-se al Japó i, en estudiar el kakké, van trobar moltes similituds amb el beri-beri, una malaltia endèmica descrita en diversos punts del sud-est asiàtic. D'entrada es va descartar que l'afecció fos infecciosa, ja que no s'havien detectat casos transmesos quan una persona malalta anava a una zona sana, pel que es va atribuir la causa a una miasma venenosa que sorgia des del sòl humit.[7]
L'any 1868, el cirurgià de la marina francesa Le Roy de Méricourt, que havia vist els efectes del beri-beri durant els seus viatges, va fer una de les primeres revisions acadèmiques referents a la malaltia, on descrivia diversos casos amb els que s'havia trobat. En aquesta publicació, Méricourt va ser el primer en establir una diferenciació clara entre el beri-beri sec (anteriorment anomenat bar-biers) i el beri-beri humit, arribant a la conclusió que els dos eren manifestacions clíniques diferents de la mateixa malaltia.[7] D'altra banda, Méricourt va determinar que el clima només podia jugar un paper secundari en la malaltia, contràriament al que es pensava anteriorment, ja que s'havien començat a reportar casos en zones com Cuba o àrees temperades de l'Índia, on les condicions climàtiques distaven molt de les presents en països com Japó.[7]
El primer en proposar que el kakké o beri-beri tenia una relació directa amb l'alimentació va ser Albrecht Wernich, un metge que va relacionar aquesta malaltia amb la ingesta d'arròs.[7]
L'any 1883, durant un viatge entre Japó i Nova Zelanda, el metge de la marina japonesa, Kanehiro Takaki, va ser testimoni d'aquesta malaltia. D'entre els 278 homes que viatjaven, 161 van desenvolupar beri-beri i d'aquests en van morir 25.[7] Davant d'aquesta situació, Takaki va demanar tornar a realitzar un viatge de les mateixes característiques un any més tard, però implementant canvis en la dieta que incloïen més carn, verdures, pa i llet condensada a més de l'arròs que ja s'havia portat en el primer viatge, amb l'objectiu d'augmentar la quantitat de nitrogen ingerida. En aquell segon viatge, només hi va haver 14 casos, tots ells entre els homes que s'havien negat als canvis en la dieta, i cap d'ells va morir.[8] D'aquesta manera, Takaki va establir que el beri-beri estava causat per un dèficit proteic, i va aconseguir implementar dietes basades en altres aliments a part de l'arròs en els viatges que realitzava la marina.[7]
Al 1885, les autoritats de l'exèrcit japonès van decidir substituir part de l'arròs de la dieta dels soldats per ordi, aconseguint que els casos de beri-beri disminuïssin en gran manera. Tot i així, els metges que formaven part de l'exèrcit van considerar que la disminució de casos no estava relacionada amb el canvi de dieta, sinó que es devia al fet que el beri-beri era una malaltia estacional i que els malalts s'havien reduït gràcies als canvis ambientals que implicaven una regressió de l'afecció.[7] De la mateixa manera, van sostenir que la reducció de casos que s'havia donat en la marina tampoc es devia a causes nutricionals, i que segurament estava lligada a una millora en les condicions higièniques dels vaixells. Seguint aquesta lògica, van decidir implementar canvis en la neteja de les instal·lacions, pensant que d'aquesta manera es donaria una gran minva en la incidència del beri-beri.[7]
L'any 1886, hi va haver un gran increment de casos de beri-beri en la marina holandesa durant una expedició militar, amb afectació tant en mariners com en soldats. Davant d'aquest fet, el govern holandès va decidir enviar una comissió d'experts en bacteriologia, formats a partir dels recents descobriments de Louis Pasteur i Robert Koch, amb l'objectiu de descobrir quina era la causa real del beri-beri.[7] Durant vuit mesos, els membres d'aquesta comissió van estar a les colònies holandeses fent autòpsies i anàlisis histològiques de les víctimes, amb el que van descobrir que durant la malaltia es donava una degeneració dels nervis perifèrics, segurament responsable de la pèrdua de sensibilitat i mobilitat que patien els pacients. Amb aquesta nova informació, van considerar que la causa més probable del beri-beri seria un factor extern, segurament un microorganisme, que actuava directament sobre el sistema nerviós. Tot i això, no van poder trobar cap microorganisme causant de la patologia quan van extreure mostres del sistema nerviós, ni tampoc van veure transmissió de la malaltia fins passades al menys sis setmanes de contacte amb el possible patogen.[7]
Christiaan Ejikman, un dels científics que havia participat en la comissió holandesa de cerca del patogen, va voler estudiar els efectes que el beri-beri podia tenir en altres animals, amb l'objectiu d'aïllar l'agent causal. Va treballar amb gallines, que patien una malaltia molt similar al beri-beri, a la que ell va anomenar "polineuritis".[7] Entre els seus experiments, va implementar canvis en la dieta d'aquestes aus, veient que aquelles que consumien arròs cuit provinent d'un hospital emmalaltien, mentre que les que s'havien alimentat a base d'arròs cru provinent de les existències pròpies del laboratori seguien sanes, encara que se'ls hi haguessin injectat bacteris trets de gallines mortes per polineuritis. Aquests resultats primer el van portar a pensar que l'arròs cuit afavoria la presència i el desenvolupament de microorganismes a l'aparell digestiu, però posteriorment va centrar els seus estudis en la manera en què l'arròs era tractat abans de cuinar-se. Va veure que l'arròs blanc que era principalment consumit pels humans passava per un processament en el que es polia, retirant la capa més externa del cereal per fer-lo més agradable a la vista i donar-li una textura més suau. L'arròs vermell, en canvi, era principalment utilitzat en animals i, per tant, no passava per cap processament especial, pel que mantenia totes les capes originals.[7] Aquesta nova informació, sumada a que les gallines amb les que havia estudiat anteriorment només havien adquirit la malaltia quan s'havien alimentat a base d'arròs blanc polit, el va portar a pensar que, o bé la part externa de l'arròs el protegia de l'entrada de microorganismes patògens, o que aquesta capa contenia una sèrie de substàncies indispensables per una bona salut. Després d'experimentar amb arròs recentment polit, que no havia estat emmagatzemat sense la capa externa i, per tant, no havia estat exposat a patògens que hi poguessin entrar, va determinar que la causa del beri-beri havia de ser un dèficit nutricional, ja que les gallines continuaven emmalaltint.[7][9]
Tot i els importants descobriments d'Ejikman, encara no es podia establir una relació directa entre els resultats obtinguts en gallines i la malaltia que afectava als humans. Per aconseguir-ho, va ser molt important la participació d'Adolphe Vorderman, un metge col·lega d'Ejikman que havia estat treballant a les Índies Orientals durant quasi 20 anys, primer a la marina i després com a inspector de presons a l'illa de Java.[7] Es sabia que el beri-beri era un problema en algunes presons però no en altres i, tenint en compte els experiments fets amb gallines, Ejikman i Vorderman volien saber si existia alguna relació amb aquesta incidència i l'arròs inclòs en la dieta dels presoners. Com que no hi havia dades disponibles sobre el tipus d'arròs utilitzat, Vorderman va escriure a totes les presons de la zona, preguntant tant pels casos del beri-beri com per l'arròs que feien servir. Amb les respostes que van obtenir, van veure que aquelles presons que utilitzaven arròs blanc polit eren les que es veien afectades pel beri-beri, mentre que les que utilitzaven arròs bru gairebé no presentaven casos. Per confirmar els seus resultats, van implementar canvis en la dieta de les presons afectades per beri-beri, substituint l'arròs blanc pel bru, amb el que van veure que els casos es reduïen molt.[7]
Per a continuar les investigacions necessaris per poder establir la veritable causa del beri-beri, van ser necessàries les aportacions de Frederick Gowland Hopkins. L'any 1906, Hopkins va postular que, a part de glúcids, lípids i proteïnes, eren necessàries altres molècules o factors accessoris per mantenir la salut de l'individu, que s'incorporaven a través de la dieta. Per determinar-ho, va fer una sèrie d'experiments amb rates i ratolins, que experimentaven dèficits de creixement quan aquests factors accessoris mancaven en la seva dieta. Tot i que els seus experiments no tenien cap relació directa amb el beri-beri, van ser crucials per a dirigir les investigacions posteriors.[7]
L'any 1912, Casimir Funk, un bioquímic polonès, va continuar la línia d'estudis d'Ejikman, intentant analitzar les diferències entre l'arròs blanc i l'arròs integral amb el que s'alimentava a les gallines. A través de diversos experiments, va aconseguir aïllar un compost provinent del segó d'arrós, part que típicament es retirava en aquelles zones amb més incidència del beri-beri. Donada l'estructura química d'aquest compost, el va anomerar "amina vital" o "vitamina", ja que es tractava d'un compost orgànic amb nitrogen. Els seus estudis li van permetre saber que aquest compost estava estretament relacionat amb el beri-beri, i posteriorment va ampliar la seva teoria, suggerint que hi havia altres malalties que també podrien estar causades per molécules similars.[7]
No va ser fins als anys 30 que Robert Runnels Williams, un bioquímic nord-americà, va aconseguir aïllar i sintetitzar la tiamina (vitamina B1) a partir de fonts naturals.[10] L'objectiu de Williams era demostrar que aquest compost té una importància capdalt en la salut i, a més, acabar d'indicar la seva estreta relació amb el desenvolupament del beri-beri.[7] Per realitzar els seus estudis, va començar analitzant la capa més externa de l'arròs integral, que es sabia que prevenia el beri-beri, però va veure que la vitamina només es trobava en concentracions reduïdes en aquest aliment, pel que no era una bona font pel seu aïllament.[7] Per fer l'extracció va utilitzar fonts d'origen vegetal i, després de diversos errors, va aconseguir-ho l'any 1934. Un cop aïllada, Williams la va estudiar exhaustivament, aconseguint determinar-ne l'estructura concreta. El 1936, va aconseguir sintetitzar-la artificialment al laboratori, cosa que va permetre'n una posterior producció per tractar-ne el dèficit, especialment en aquelles zones on el beri-beri tenia més incidència.[7]
Causes i factors de risc
[modifica]
El beri-beri és una malaltia causada per la deficiència de tiamina. La mancança d'aquesta molècula provoca que els enzims necessaris per al cicle de Krebs, no tinguin prou substrat que transportar, cosa que acaba derivant en la deficiència de trifosfat d'adenosina, molècula més coneguda com a ATP.[11]
La tiamina és una molècula essencial en aquelles zones del cos on els requisits metabòlics són elevats, com per exemple el cervell, el cor, els nervis i els músculs. Per això, aquests òrgans són els principals afectats quan el cos pateix una deficiència de tiamina. Quan la deficiència d'aquesta molècula continua durant un considerable període, pot ocórrer una elevada pèrdua de pes lligada a una malnutrició.[11]
Factors genètics
[modifica]La deficiència de la tiamina en els òrgans energèticament demandats, es pot relacionar també amb causes genètiques.[11] S'ha observat, que certes mutacions en diversos gens poden derivar en l'aparició del beri-beri.[12]
| Gen mutat | Proteïna codificant | Malaltia causada |
|---|---|---|
| SLC19A2 | Proteïna transportadora de tiamina de tipus I. | Anèmia megaloblàstica sensible a la tiamina (TRMA).[12][13] |
| SLC19A3 | Proteïna transportadora de tiamina de tipus II. | Malaltia dels ganglis basals sensible a la biotina i tiamina, síndrome de Leigh, acidosi làctica amb espasmes infantils i síndrome similar a la encefalopatia de Wernicke.[13][14] |
| SLC25A19 | Proteïna d'entrada de TPP als mitocondris. | Microcefàlia que afecta sobretot a la població Amish i necrosi estriatal bilateral amb polineuropatia progressiva.[13][14] |
| TPK1 | Proteïna quinasa que transforma la tiamina en la forma activa. | Síndrome de Leigh.[13][14] |
Factors ambientals
[modifica]La dieta
[modifica]La malaltia del beri-beri s'origina, principalment, en regions on hi ha difícil accés a aliments rics en nutrients, per tant, té una estreta relació amb la dieta. Hi ha certs aliments, com l'arròs polit (del qual s'ha eliminat la closca, el segó i el germen) o la iuca, que si són consumits en abundància com a principal font d'aliment poden agreujar els riscos de patir aquesta deficiència.[3][1]


D'altra banda, hi ha certs aliments que són molt habituals a la dieta quotidiana, que contenen molècules antagonistes de la tiamina, que provoquen la seva incorrecta assimilació. Dos exemples d'això són l'Equisetum arvense, col·loquialment conegut com a cua de cavall, o les nous de bètel, aliments que si són consumits en excés incrementen el risc de transformar la tiamina en altres compostos no assimilables. Un exemple d'això, són els tanins, presents en el cafè i al te, que poden reaccionar amb la tiamina, transformant-la en la seva forma no assimilable.[3][2]
Altres aliments com el marisc cru i els peixos d'aigua dolça, contenen tiaminases, que són enzims que poden degradar la tiamina, i que si són consumits en excés poden derivar en una deficiència generalitzada de tiamina.[3][3]
L'arròs polit
[modifica]L'arròs polit és el principal causant del beri-beri. Durant el processament del cereal, es retira la capa més externa, eliminant així el contingut de tiamina de l'aliment, cosa que produeix el dèficit vitamínic en dietes majoritàriament basades en l'arròs.[7] El primer pas del procés ve després de la collita, i consisteix en batre el gra d'arròs per separar-lo de la tija, i posteriorment es ventila per eliminar la palla restant de la recol·lecció.[15]
El gra cru que s'obté, anomenat "paddy" o arròs amb closca, té una capa externa que històricament es retirava per millorar diverses característiques organolèptiques de l'aliment, com ara la textura. Per aconseguir-ho, tradicionalment es posava l'arròs en un morter i es colpejava fins trencar la closca. Finalitzada aquesta part, es requeria d'una segona ventilació per allunyar la closca trencada del gra.[15]
En algunes regions era habitual, abans d'extreure la closca, bullir el paddy. Primerament, el gra es deixava en remull de 12 a 48 hores, a continuació es cuinava lleugerament amb vapor per tal d'estovar la closca i, finalment, es tornava a assecar abans de processar-la amb el morter. Aquest procediment facilitava l'extracció de la closca però, alhora, alterava algunes característiques organolèptiques, com l'olor i la coloració, resultant en efectes desagradables per alguns consumidors.[16]
L'alcoholisme
[modifica]Ha estat observat que hi ha un tipus de beri-beri, el beri-beri humit, que es pot relacionar amb l'alcoholisme, el VIH i certes malalties gastrointestinals greus.[17]
Cal destacar que la deficiència de tiamina en relació amb l'alcoholisme segueix tenint una relació molt estreta amb una dieta pobra en aliments amb tiamina, però és el conjunt d'altres factors el que acaba provocant la malaltia.[17] Però, es va demostrar que els nivells de tiamina baixos a l'organisme es donaven entre un 30-80% dels pacients alcohòlics, ja que depenia de la dieta, la quantitat d'alcohol consumit i l'estat del fetge.[18]
S'ha demostrat que l'elevada presència d'etanol a l'organisme pot provocar que la tiamina no sigui absorbida al tracte gastrointestinal. A més, també provoca la disminució de la reserva de tiamina al fetge, ja que aquest òrgan s'acaba deteriorant per l'elevada concentració alcohòlica.[17] La cirrosi es relaciona amb els baixos nivells de pirofosfat de tiamina i una fosforilació deficient, ja que evita l'activació del pirofosfat de tiamina, forma que requereix l'organisme per produir energia, però l'etanol no té efecte en la concentració dels compostos monofosfat de tiamina.[17][18] També s'ha demostrat que una elevada concentració d'etanol pot tenir un efecte perjudicial en les proteïnes de transport de tiamina que hi ha al tracte gastrointestinal, perquè les inhibeix.[17]
Addicionalment, l'elevat consum d'alcohol augmenta la necessitat d'excreció urinària, cosa que provoca que els nivells de tiamina disminueixin en eliminar-la per l'orina.[19]
Altres factors de risc
[modifica]- Malalties intestinals, com la malaltia celíaca o la diarrea: S'ha observat que una malnutrició por desencadenar una deficiència de tiamina. Per tant, una absorció deficient de nutrients en pacients, provocada per la malaltia celíaca o la diarrea, pot desencadenar aquest dèficit nutricional.[20]
- Operacions bariàtriques: Les cirurgies bariàtriques consisteixen en l'alteració del sistema digestiu per aconseguir una disminució de pes.[21] Per aquesta raó, un pacient que s'ha sotmès a una operació bariàtrica té risc a patir malnutrició i a tenir un dèficit de tiamina. Una revisió realitzada el 2008 va identificar 84 casos d'encefalopatia de Wernicke posteriors a cirurgies bariàtriques (principalment cirurgia de bypass gàstric) realitzades entre els anys 1991 i 2008.[22] Els metges han de tenir en compte que pot produir-se aquesta deficiència nutricional quan tractin amb pacients amb aquest historial d'intervencions quirúrgiques.[20]
- Diabetis: Hi ha alguns estudis que han descobert nivells baixos de tiamina en pacients amb diabetis tipus 1 (fins a un 76% inferior) i diabetis tipus 2 (entre un 50-75% menys). Aquests nivells de tiamina inferiors en pacients amb diabetis poden ser provocats per una major eliminació de tiamina per part dels ronyons.[22]
- Embaràs i lactància materna: Durant la fase d'embaràs i la posterior lactància materna del nadó, es pot desencadenar una deficiència de tiamina, ja que són processos fisiològics que comporten un augment dràstic en la utilització d'aquesta vitamina.[23]
- Avançada edat: Hi ha estudis que suggereixen que entre el 20-30% d'adults d'avançada edat poden tenir deficiència de tiamina en algun grau major o menor. Les raons per les quals això succeeix és degut a una ingesta dietètica baixa, una combinació de malalties cròniques, l'ús concomitant de diversos fàrmacs i una disminució de l'absorció de tiamina com a resultat de l'envelliment. S'ha pogut observar una major incidència en persones d'avançada edat que es troben internades en residències.[22]
- Virus de la immunodeficiència humana (VIH): Les persones amb VIH posseeixen un major risc de patir deficiències de tiamina i les seves seqüeles, incloent-hi les síndromes consegüents com el beri-beri i la síndrome de Wernicke-Korsakov. Es van dur a terme 380 autòpsies amb persones amb VIH i aquestes van revelar que gairebé el 10% d'individus patia encefalopatia de Wernicke-Korsakov. Per aquesta raó, hi ha experts que consideren que la deficiència de tiamina està infradiagnosticada en pacients amb VIH. Es creu que l'associació de la deficiència de tiamina i la infecció pel virus de la immunodeficiència humana és provocada per la desnutrició a conseqüència de l'estat catabòlic que presenten els pacients amb SIDA.[22][19]
Bases bioquímiques
[modifica]
La tiamina, o també coneguda com vitamina B1, químicament està formada per un anell de tiazol i un de pirimidina. És una vitamina hidrosoluble, que es troba majoritàriament en la seva forma activa, el pirofosfat de tiamina (TPP). El TPP fa de cofactor, funcionant com a grup prostètic de tres enzims essencials en diverses reaccions bioquímiques importants pel metabolisme:[24]
Complex de la Piruvat Deshidrogenasa (PDH)
[modifica]
Aquest complex enzimàtic connecta la part de la glicòlisi amb el cicle de Krebs, catalitzant la reacció de descarboxilació oxidativa de la molècula de piruvat fins a acetil-CoA:[24]
Piruvat + CoA-SH + NAD+ → Acetil-CoA + CO₂ + NADH
Aquesta reacció és essencial per a produir energia, com l'ATP, des de la glucosa, en condicions aeròbiques.[24] També l'acetil-CoA és necessari per sintetitzar l'acetilcolina, un neurotransmissor molt important tant pel sistema nerviós central (SNC) com pel sistema nerviós perifèric (SNP).[25][26]
Aquest complex està format per tres enzims:
- E1: La piruvat deshidrogenasa, que requereix el TPP com a cofactor.[24]
- E2: La dihidrolipoil transcetilasa, que requereix ácid lipoic.[24]
- E3: La dihidrolipoil deshidrogenasa, que requereix FAD i NAD+.[24]
Si n'hi ha una falta de tiamina, el PDH no pot funcionar correctament i acabaria en una acumulació de piruvat, ja que no es pot transformar fins acetil-CoA. Això acabaria convertint el piruvat en lactat, amb l'enzim lactat deshidrogenasa. Aquesta via finalitzaria amb un munt de lactat i amb una acidosis làctica.[24][11]

Complex de l'α-Oxoglutarat Deshidrogenasa (OGDH)
[modifica]També conegut com a α-Cetoglutarat Deshidrogenasa, és essencial en el Cicle de Krebs i alhora dependent, com a cofactor, del TPP. El cofactor, els enzims i els mecanismes de reacció són homòlegs al complex de la piruvat deshidrogenasa. La seva funció és catalitzar la conversió de l'α-cetoglutarat, també conegut com a alfa-oxoglutarat, a succinil-CoA.[24][26]
α-Cetoglutarat + CoA-SH + NAD+ → Succinil-CoA + NADH + CO₂
La manca d'aquest cofactor fa que aquesta reacció no sigui catalitzada, i llavors que no es generi energia, l'ATP, ja que no hi haurà producció del NADH per utilitzar-ho a la cadena de transport d'electrons.[24]

Transcetolasa
[modifica]És un enzim, dependent de tiamina, clau en la via de les pentoses fosfat que catalitza el pas de dos carbonis entre sucres fosforilats:[24]
Xilulosa-5-fosfat + Ribulosa-5-fosfat → Gliceraldehid-3-fosfat + Sedoheptulosa-7-fosfat
La via de les pentoses fosfat és important per a la la biosíntesis de nucleòtids i aminoàcids com per a la producció de NADH, molècula necessària per molts processos bioquímics bàsics de les cèl·lules.[24]
Simptomatologia
[modifica]A causa de la deficiència de vitamina B1 es poden desenvolupar un seguit de signes i símptomes que es relacionaran amb el beri-beri, caracteritzat per una afectació als sistemes nerviós i cardiovascular. Els símptomes primerencs per deficiència de tiamina són inespecífics: fatiga, irritabilitat, alteracions de la memòria, trastorn de la son, dolor precordial, anorèxia i malestar a la regió abdominal.[27]
Es desenvolupen diferents simptomatologies en funció de les diferents formes de beri-beri que es poden desenvolupar pel dèficit de tiamina:
Beri-beri sec
[modifica]El beri-beri sec es refereix als dèficits neurològics perifèrics. Són dèficits bilaterals i poden ser simètrics, manifestant-se amb una distribució anomenada en "guant i bota". Les parts del cos més afectades són les extremitats inferiors, començant amb la parestèsia als dits dels peus.[27] La parestèsia es caracteritza per la sensació o conjunt de sensacions anormals, especialment caracteritzada per un formigueig, adormiment o ardor de la pell.[28] Seguidament, es pot experimentar rampes musculars als panxells, dolor a les cames i disestèsies plantars, sigui l'alteració de la sensibilitat i tacte. El dolor a la regió dels panxells, la dificultat per aconseguir aixecar-se i la sensació de formigueig esmentada són els principals signes primerencs del beri-beri sec. També, es pot arribar a presentar atròfia muscular. Si la deficiència de tiamina empitjora, passat un cert temps pot afectar a les extremitats superiors.[27]

Beri-beri humit
[modifica]El beri-beri humit, també anomenat beri-beri cardiovascular, és la malaltia miocardíaca resultant del dèficit de tiamina. Els primers símptomes del beri-beri humit són la vasodilatació, taquicàrdia, pressió diferencial àmplia, sudoració, pell calenta i acidosi làctica. Posteriorment, en etapes tardanes es pot desenvolupar insuficiència cardíaca, amb consegüent ortopnea i edema pulmonar perifèric. Si la vasodilatació persisteix, pot desencadenar un shock.[27]
Beri-beri infantil
[modifica]El dèficit de vitamina B1 en les embarassades pot provocar beri-beri infantil en nadons d'entre 3 i 4 setmanes de vida que reben llet materna en quantitats normals, però amb dèficit de tiamina. Per tant, la mare no necessàriament ha de presentar beri-beri durant la gestació del nadó en qüestió. El beri-beri infantil es caracteritza per una insuficiència cardíaca, que pot aparèixer de forma molt brusca, afonia i manca de reflexos profunds tendinosos.[27]
Shōshin
[modifica]El shōshin beri-beri es descriu com una forma fulminant de beri-beri humit al qual s'associa una insuficiència cardíaca amb fracció d'ejecció conservada, edemes generalitzats de predomini a cames i taquicàrdia. En casos greus, es pot produir insuficiència renal greu i mort.[29]
Signes fisiopatològics
[modifica]El signes fisiopatològics, per aquesta falta de tiamina i energia, són diferents segons el sistema de l'organisme afectat:[1]
Sistema nerviós
[modifica]La deficiència prolongada de tiamina acaba conduint a danys tant en el sistema nerviós central (SNC) com el perifèric (SNP). El fet que hi hagi canvis metabòlics i fa que hi hagi falta d'energia, ja que falta ATP, per a les neurones i augmenti l'estrès oxidatiu. Com la piruvat deshidrogenasa no pot fer la seva funció s'acumula el lactat i aquest cúmul provoca alteracions i anomalies en la barrera hematoencefàlica.[11] Com també hi ha una alteració en la via de les pentoses fosfats acaba havent-hi una menor mielinització en les neurones.[30][31] El fet que les neurones no tinguin aquesta capa de mielina fa que les neurones tinguin problemes amb la senyalització. Alhora si falta tiamina, la transcetolasa no funciona correctament i la síntesi dels aminoàcids es veura afectada. Tot això deriva en què es poden veure greus canvis en els neurotransmissors glutamatèrgics i GABAèrics, que provenen d'aminoàcids, i s'encarreguen de controlar, inhibint, el sistema nerviós, resultant en un estat neuroexcitat tòxic pel sistema.[32] Si tot continua de manera persistent, es pot veure com s'atrofia el teixit del parènquima cerebral i com hi ha una degeneració del nervis i una neuropatia perifèrica.[1]
Sistema respiratori
[modifica]En etapes primerenques en els infants, sobretot, poden presentar hipòxia i irritabilitat sense aparent explicació. Com a resposta de l'acidosi làctica hi ha taquipnea per compensar la falta respiratòria per intentar extreure l'excés del CO2.[33] Havent-hi fins a una hipertensió pulmonar que pot terminar en dispnea i altres condicions respiratòries. Com aquesta falta de tiamina pot afectar el sistema nerviós fins a arribar a una neuropatia perifèrica, aquesta pot afectar el nervi frènic provocant una paràlisi diafragmàtica contribuint més a la insuficiència respiratòria, aquesta fisiopatologia es veu més comunament en el beri-beri sec.[1]
Sistema cardiovascular
[modifica]La tiamina és transportada principalment pels eritròcits cap a les zones on més demanda d'energia hi ha, com el cor, cervell, nervis, pàncrees i músculs. Els cardiomiòcits, les cèl·lules del múscul cardíac, necessiten constantment energia per a que el cor bombegi, que degut aquesta falta de tiamina no reben la necessària, això acaba presentant una insuficiència cardíaca.[1] Com hi ha menys energia pels cardiomiòcits, aquests redueixen la contractilitat cardíaca per gastar menys energia que desencadena en una vasodilatació perifèrica, on es disminueix el flux sanguini i l'aportació d'O2 als òrgans.[34] Per compensar això hi ha una resposta compensatòria amb una alta freqüència cardíaca, taquicàrdia fins a edemes perfèrics. El fet que el sistema circulatori augmenti el volum de sang, amb la vasodilatació, agreuja la insuficiència cardíaca congestiva, donant aquesta característica al beri-beri humit.[35][1]
Sistema gastrointestinal
[modifica]La falta de tiamina afecta greument l'intestí, el fetge i el pàncrees, ja que té molta relació, aquests òrgans, amb el metabolisme de carbohidrats i producció d'energia, l'ATP, entre d'altres. Un dels primers signes de la deficiència d'aquest nutrient és l'anorèxia, perquè el moviment dels intestins que ajuden a la digestió, sigui la motilitat gastrointestinal, i la producció de secrecions com els sucs gàstrics, són controlats per la part autònoma del sistema nerviós, si aquest no té energia suficient, provocarà una falta d'apetit en el malalt.[36][37] De la mateixa manera aquest sistema nerviós entèric, part del sistema nerviós autònom, com no hi ha una bona funció energètica i la motilitat intestinal es redueix fins a provocar estrenyiment crònic i en casos severs fins íleus paralític, on l'intestí es para completament.[1][36]
Relacionat amb el metabolisme de carbohidrats, lípids i proteïnes, el fetge es veu més afectat perquè, sense la suficient tiamina, la producció d'energia que passa en les cèl·lules hepàtiques cau dràsticament fent que el fetge no pugui fer les seves funcions metabòliques normals.[24][36] Aquesta falta d'energia conjuntament amb la incapacitat de metabolitzar els àcids grassos pot portar a una esteatosi hepàtica on el fetge acumula greix. Això pot evolucionar, si no es cura, en la malaltia del fetge greix no alcohòlic i després desenvolupar en problemes encara més greus.[38][39] Com també, al beri-beri humit, pot provocar insuficiència cardíaca, aquesta pot generar una congestió venosa, degut a que no es bombeja prou sang i aquesta s'acumula en les venes, i manifestar-se com a hepatomegàlia, un fetge engrandit, i ascitis, acumulació de líquids en l'abdomen, que acaba en una insuficiència hepàtica i malabsorció de nutrients.[1][40]
No només l'intestí i el fetge, sinó que també el pàncrees es veu afectat. Relacionat amb la seva funció exocrina, on les cèl·lules pancreàtiques secreten enzims per digerir, aquests poden disminuir dràsticament, ja que les cèl·lules no obtenen energia disponible suficient al no poder metabolitzar correctament per la falta de tiamina, això pot exacerbar els signes de malnutrició i perduda de pes.[1][36] Aquest mateix metabolisme defectuós de la glucosa, entre altres carbohidrats per la piruvat deshidrogenasa, pot alterar la regulació de la glucosa, encarregades les cèl·lules β-pancreàtiques de secretar insulina, i així arribar a desenvolupar des d'intolerància a la glucosa fins a la diabetis.[41][40]
Sistema musculoesquelètic
[modifica]Aquest sistema és altament vulnerable perquè necessita grans quantitats d'ATP per funcionar correctament. El fet que no es pugui metabolitzar la glucosa, per la nul·la funció de la piruvat deshidrogenasa i l'α-cetoglutarat deshidrogenasa, fa que els músculs no puguin mantenir-se actius, produint una fatiga extrema i una debilitat muscular.[36] Això progressivament pot portar a una atròfia muscular. A més, a més, la neuropatia perifèrica, provocada també per la falta de tiamina, contribueix a aquesta debilitat i atrofa, tant moviment voluntari com reflexos motors. En el beri-beri sec, es pot arribar a una paràlisi flàccida causada per aquesta neuropatia motora.[1][42]
Diagnòstic
[modifica]Pel fet que els símptomes clínics tendeixen a confondre's amb altres trastorns neurològics o cardíacs, ja que són inespecífics, és clau fer un diagnòstic basat tant en clínica com en proves específiques.[1]
Avaluació clínica
[modifica]La història dietètica és crucial mirar-la ja que pot sospitar-se, el beri-beri, en pacients amb antecedents de malnutrició dietes baixes en tiamina, especialment en regions on l'arròs blanc o aliments processats són la base de la dieta, l'àbus d'alcohol o condicions mèdiques com l'hipermetabolisme, infeccions greus o malalties que puguin augmentar la demanda de tiamina.[1][43][44] Juntament amb una avaluació de la simptomatologia per determinar si és beri-beri humit, amb taquicàrdia, dispnea fins a una insuficiència cardíaca, o beri-beri sec, amb neuropatia perifèrica, debilitat muscular fins a atàxia.[1]
Exàmens bioquímics
[modifica]El marcador més fiable per mesurar si hi ha deficiència és el mesurament de la TPP en sang. Es mesura en els eritròcits amb una cromatografia, uns valors normals es troben entre 74 fins a 222 nmol/L en tota la sang.[44]Una altra opció seria mesurar l'activitat de la transcetolasa en els eritròcits on es veurà reduïda. A més, si es fa una prova d'estimulació, afegint tiamina al medi, i la transcetolasa augmenta la seva activitat significativament suggerirà la deficiència de tiamina.[26] Com a marcador indirecte de la disfunció de les rutes metabòliques es pot mesurar els àcids orgànics en l'orina, ja que com els enzims no funcionen correctament l'àcid làctic o també l'àcid pirúvic, s'acumula i és un marcador indirecte de la disfunció de les rutes metabòliques. Així mateix amb la concentració d'àcids en sang, el lactat, en la sang és un indicador d'una funció anormal del metabolisme.[45][46]
Resposta al tractament
[modifica]Si hi ha una ràpida resposta a l'administració de tiamina, pot ser un punt clau per a confirmar-se com a diagnòstic a llocs on les proves bioquímiques no estan disponibles d'immediat.[1]

Exàmens complementaris
[modifica]Per donar suport al diagnòstic es poden fer diversos exàmens complementaris com la ressonància magnètica (RM) per casos avançats sobretot en el beri-beri amb complicació de l'encefalopatia de Wernicke, on es pot veure si hi ha alguna lesió al tàlem, hipotàlem o a la substància grisa. Encara que, trobar lesions no sigui específics del beri-beri.[1] També unelectrocardiograma (ECG) pot mostrar signes d'insuficiècnia cardíaca, com taquicàrdia sinusal o baix voltatge, sobretot en el beri-beri humit.[1]
Diagnòstic diferencial
[modifica]És clau fer un diagnòstic crucial per abans descartar altres causes dels símptomes:
- Altres deficiències nutricionals: La falta de vitamina B12, o folat o niacina pot presentar alguns símptomes neurològics similars.[47][48]
- Neuropaties per altres causes: Relacionades sobretot amb l'alcoholisme.[47]
- Insuficiència cardíaca d'altres etiologies: Malalties cardíaques tant, estructurals com valvulars, deuen ser descartades si els pacients mostren una insuficiència cardíaca abans de relacionar-la amb el beri-beri humit.[27]
- Acidosi làctica d'altres causes: L'acidosi làctica pot tenir altres orígens, com una sèpsia o fallada hepàtica, que abans de diagnosticar beri-beri s'han de descartar.[49]
Tractament
[modifica]
Els trastorns de dèficit de tiamina es reverteixen amb un tractament de dosis altes d'aquesta vitamina, administrades via oral o per injecció intravenosa o intramuscular. La majoria dels símptomes s'aconsegueixen alleujar amb aquesta subministració, tot i que es poden administrar dosis progressivament més baixes fins a la completa recuperació del pacient.[50]
Segons la simptomatologia:
- Beri-beri sec: Es recomana un repòs absolut del pacient, acompanyat de l'administració de 10 mg de tiamina cada 24 hores via oral. Cal l'aportament d'una dieta rica en tiamina i nutricionalment completa, suplementada amb un complex de vitamines B.[51] El tractament en aquests casos requereix sessions addicionals de fisioteràpia. Això es realitza amb l'objectiu d'aconseguir revertir els efectes de la malaltia i recuperar la forma física del pacient.[50] La resposta al tractament acostuma a ser lenta.[51]
- Beri-beri humit: Es recomana un repòs absolut del pacient, acompanyat de l'administració per injecció intramuscular o intravenosa de 50 a 100 mg de tiamina cada 24 hores fins a observar una millora. Un cop aconseguit aquest estadi, s'atura l'administració injectada de tiamina i es recomana prendre 10 mg de tiamina cada 24 hores via oral. Cal, a més a més, seguir una dieta completa i rica en aliments amb tiamina. Per tractar la insuficiència cardíaca es necessita un tractament amb diürètics que eliminin l'excés de líquid i altres fàrmacs que permeten la recuperació del pacient.[50] La resposta al tractament acostuma a ser ràpida, observant-se diüresi i disminució de la dispnea. Dies més tard, es produeix la desaparició de l'edema.[51]
- Beri-beri infantil: El tractament requereix subministrament per injecció intramuscular o intravenosa de 25 mg de tiamina al nadó quan la malaltia apareix per primera vegada. Cal subministrar a la mare lactant del nadó 10 mg de tiamina dos cops al dia via oral, o bé 5 mg al nadó. També, en cas que la mare no pugui alletar-lo, es recomana que el nadó tingui una dieta rica en tiamina o suplements que continguin aquesta vitamina.[51]
Tractament concomitant
[modifica]Sovint, els pacients es poden sotmetre a un tractament concomitant, és a dir, el subministrament simultani de dos fàrmacs o teràpies mèdiques.[52] En aquest cas, és pertinent la coadministració intramuscular de magnesi (1-2 ml d'una solució al 50%). El magnesi és un cofactor essencial per a convertir la tiamina en la seva forma activa (TPP). Tant el magnesi com la forma activa de la tiamina (TPP) són cofactors per la piruvat deshidrogenasa, un enzim clau en el cicle de Krebs. Per això, la falta de magnesi coneguda com a hipomagnesèmia pot tenir un doble efecte negatiu al metabolisme de la tiamina. S'ha comprovat que, tot i administrar les dosis correctes de tiamina, els símptomes en els pacients no s'aconsegueixen revertir si els nivells de magnesi són baixos.[53]
Si no s'aplica un tractament adient a temps, la malaltia pot provocar greus conseqüències per insuficiència cardíaca i causar efectes irreversibles a nivell neurològic. Sense tractament, l'encefalopatia de Wernicke pot derivar en la síndrome de Wernicke-Korsakov, provocant pèrdues de memòria i de les funcions cognitives. En els casos més greus, la malaltia pot induir el pacient en un estat de coma i, fins i tot, provocar la mort.[53]
Prevenció
[modifica]Per aconseguir prevenir el beri-beri cal mantenir una dieta adequada i completa, rica en tiamina i també en altres vitamines. Especialment, en el cas de les mares lactants és molt important que la seva alimentació sigui variada i proporcioni totes les vitamines necessàries, per evitar el dèficit de vitamina B1 en l'infant alletat i la possible aparició de beri-beri infantil.[54]
A continuació s'exposen un seguit d'aliments rics en la vitamina B1 (tiamina), recomanables per adquirir aquesta suplementació vitamínica per prevenir el beri-beri:
| Aliment | mg de tiamina/100g d'aliment |
|---|---|
| Carn magra de porc | 0.89 |
| Pernil | 0.75 |
| Festucs | 0.69 |
| Fabes | 0.5 |
| Avellanes | 0.45 |
| Bacó | 0.43 |
| Blat | 0.33 |
| Prunes i figues seques | 0.2 |
| Salsitxa | 0.2 |
| Paté | 0.18 |
| All | 0.16 |
| Ostres | 0.15 |
L'alcoholisme s'ha vist que és un factor estretament relacionat amb l'aparició de beri-beri humit. És per això que reduir al màxim el consum de begudes alcohòliques és un mètode de prevenció útil,[54] ja que la presència d'etanol impedeix un bon transport i una correcta absorció de la tiamina en l'organisme.
Finalment, es recomana la ingesta de suplements vitamínics de tiamina a aquells pacients susceptibles, per garantir que l'organisme està absorbint i emmagatzemant la vitamina B1 correctament.[54]
Epidemiologia
[modifica]El beri-beri és una malaltia que es troba a diferents parts del món. Però en certes regions és molt rara d'observar, això és el cas per exemple d'Amèrica del Nord, Europa i Austràlia on el beri-beri és comú (però poc freqüent) en pacients amb alcoholisme, i es manifesta en forma de la síndrome de Wernicke-Korsakov.[55][56]
Fa 100 anys, el beri-beri es trobava sobretot present en regions com la península de Malàisia, el Japó, el Nepal i a Tailàndia. Encara que la seva presència ha estat reportada en zones com l'illa Nauru, Singapur i Hong Kong.[55]
S'ha observat que el beri-beri es manifestava en regions rurals d'Àfrica i Àsia, en dones embarassades que patien complicacions a l'embaràs d'origen desconegut, ja que la despesa que fa el cos de tiamina es veu incrementada.[55]
D'altra banda, els brots de beri-beri eren encara més comuns en les poblacions de refugiats. La malaltia es va reportar a inicis de 1980 en refugiats Cambodjans que van arribar a Tailàndia, així com entre 1993 i 1995 es van reportar en refugiats Bhutanesos al Nepal. Tots aquests brots tenien en comú que els refugiats seguien una dieta que es basava únicament en el consum d'arròs.[55]
Al Brasil, s'havia observat una disminució dels casos de beri-beri, passant dècades sense que hi hagués report de més casos de la malaltia. Però, el 2006 es van reportar 434 casos, que van derivar en 40 morts. A partir d'aquesta data van haver-hi reports de beri-beri l'any 2008, al 2013 i al 2018.[57] Entre aquests dos últims anys, es va fer un estudi, i es va determinar que la població més afectada era l'indígena de la regió, persones provinents de l'Índia, i en menys proporció persones d'origen africà o europeu.[57]
Altres malalties causades pel dèficit de tiamina
[modifica]A banda del beri-beri, el dèficit de tiamina (vitamina B1) pot causar altres malalties greus, que són especialment problemàtiques si aquesta falta vitamínica persisteix.[3]
Síndrome de Wernicke-Korsakov
[modifica]El síndrome de Wernicke-Korsakov és el resultat de la combinació de l'encefalopatia de Wernicke i el síndrome de Korsakov, afeccions que solen estar estretament relacionades.[58] Les causes d'aquesta malaltia són diverses, i en destaquen l'addicció a l'alcohol i el dèficit de tiamina. Altres factors que poden conduir a l'adquisició d'aquesta afecció són l'anorèxia nerviosa, la colitis ulcerosa, la hiperèmesi gravídica la inflamació crònica provocada per la malaltia de Crohn, algunes malalties víriques o bacterianes, i també pot aparèixer com a conseqüència d'una cirurgia bariàtrica.[58] Els símptomes principals inclouen taquicàrdia, mareig, pèrdua de l'apetit, pèrdua de pes i retenció urinària, entre d'altres.[58]
Encefalopatia de Wernicke
[modifica]L'encefalopatia de Wernicke és un trastorn neurològic produït principalment per un dèficit de vitamina B1 (tiamina).[58] Els tres símptomes amb què clàssicament s'associa aquesta malaltia són l'oftalmoplegia (alteracions oculars que acostumen a comportar una paràlisi muscular),[59] l'atàxia (irregularitat en les funcions del sistema nerviós, especialment en aquelles relacionades amb la locomoció)[60] i la confusió.[61] Tot i així, destaquen altres símptomes bastant estesos, com pèrdua d'audició, canvis en les pupil·les, pèrdua de visió, hipotèrmia, psicosi, amnèsia, dolors abdominals, taquicàrdies... Per tant, es tracta d'una patologia amb un quadre clínic molt extens. Inicialment, aquest tipus d'encefalopatia s'associava a l'alcoholisme, però posteriorment es va veure que no existia una relació tan clara com es creia.[61]
Síndrome de Korsakov
[modifica]El síndrome de Korsakov és una patologia molt lligada a l'encefalopatia de Wernicke, especialment en aquells casos en que es dona un abús de les begudes alcohòliques.[62] Entre els símptomes principals hi destaquen disminució de la memòria i l'aprenentatge, al·lucinacions, confabulacions, canvis en la personalitat i, en molts casos, neuropaties perifèriques.[62]
Anèmia megaloblàstica sensible a la tiamina
[modifica]La síndrome d'anèmia megaloblàstica sensible a la tiamina, també conegut com a síndrome de Rogers,[63] és un conjunt de diverses malalties i de símptomes, relacionada amb la mutació del gen SLC19A2, causant una malaltia autosòmica recessiva molt poc freqüent.[12]
Aquesta afectació té una gran varietat de símptomes, ja que afecten a la proteïna que s'expressa en diverses zones del cos, com el pàncrees, el cor, la retina, el cervell i la medul·la òssia.[12] Engloba l'anèmia megaloblàstica, la diabetis mellitus i una pèrdua d'audició progressiva, aquests dos últims apareixen en els primers mesos de vida, o fins i tot des del naixement.[63] A més, en menys proporció es poden observar casos on hi hagi manifestacions d'atròfia oftalmològica, cardiovasculars, neurològiques i la trombocitopènia, condició on el nombre de plaquetes són anormalment inferiors als valors normals.[63]
A banda dels baixos nivells d'hemoglobina en sang, podem observar un augment del volum corpuscular mitjà, on hi ha una grandària anormal dels eritròcits en sang, quan el nivell de folat i tiamina és insuficient.[63]
Els símptomes lligats al sistema cardiovascular són els més destacats per la seva gravetat, ja que poden arribar a ser letals, ja que els pacients poden patir mort sobtada, infart, arrítmies, paralització auricular, defecte septal auricular o defecte septal ventricular; en conjunt amb els lligats al sistema nerviós, ja que pot haver-hi ictus, epilèpsia, retard en el desenvolupament i discapacitat intel·lectual.[63]
En el tractament d'aquesta malaltia es basa en la subministració de tiamina, per millorar l'alteració hematopoètica, la pèrdua auditiva, el retard en l'aparició de la diabetis mellitus. Però, aquest tractament no es contempla per tractar les afectacions oculars, cardiovasculars i neurològiques.[63]
Ja que és una afectació genètica, si hi ha sospita de ser portador d'una variació en el gen SLC19A2, els professionals de la salut recomanen tests genètics abans de la concepció.[63]
Acidosi làctica
[modifica]L'acidosi làctica és l'acumulació d'àcid làctic a la sang com a conseqüència d'una mala activitat metabòlica, un exercici físic massa intens o com a resposta a substàncies com l'adrenalina.[64] Una de les causes menys comuns d'aquesta afecció és el dèficit de tiamina (vitamina B1), ja que juga un paper clau en el metabolisme de carbohidrats i pot comportar un mal funcionament cel·lular. En casos aguts de falta de tiamina, el piruvat s'acumula a la cèl·lula i posteriorment és metabolitzat a lactat, provocant casos d'acidosi làctica.[65]
Donat que el dèficit de vitamina B1 és una de les possibles causes d'aquesta acumulació d'àcid làctic, alguns casos d'acidosi làctica es poden tractar a base d'incorporar tiamina per solucionar carències metabòliques que puguin estar causant l'afecció.[65]
Malaltia dels ganglis basals sensible a la biotina i la tiamina
[modifica]Malaltia autosòmica recessiva causada per la mutació en el gen SLC19A3 que es manifesta durant la infància, en nens d'entre 3 i 10 anys. Causa una gran varietat de símptomes, entre els quals es destaquen l'elevada confusió, convulsions, atàxia, distonia, paràlisi facial supranuclear, oftalmoplegia externa i disfàgia. Quan aquests símptomes no són tractats, poden derivar en un coma i posteriorment en la mort.[66]
Pel diagnòstic d'aquesta malaltia, després de l'observació simptomatològica, es fan servir tècniques d'anàlisi de gens, que poden ser d'un únic gen (SLC19A3) o de diversos gens, que inclou el gen abans esmentat i altres d'interès, per determinar alhora si es pot tractar d'una altra malaltia, com la síndrome de Leigh.[66]
Síndrome de Leigh
[modifica]El Síndrome de Leigh és una malaltia mitocondrial rara amb afectacions al sistema nerviós central, causant una encefalopatia necrosant subaguda. Es caracteritza per la degradació de diverses parts del cervell, d'entre les que destaquen el tàlem, el tronc encefàlic i els ganglis basals.[67]
La simptomatologia d'aquesta afecció és similar a la del beri-beri i, encara que pot presentar variacions segons el pacient particular, acostuma a presentar debilitat muscular, moviments anormals als ulls, atàxia (dificultats en la coordinació dels moviments), problemes cardíacs, contraccions musculars involuntàries i retràs en el desenvolupament. Tot i que generalment només causa problemes en el sistema nerviós, en alguns casos es poden donar afectacions a altres òrgans, que poden anar des del sistema digestiu al hormonal, passant pel circulatori.[67]
Les causes del síndrome de Leigh són genètiques, i poden deure's a mutacions en el ADN mitocondrial (60-90% dels casos) o en el AND nuclear (10-40% dels casos), depenent del cas. En la majoria d'ocasions, aquestes mutacions deriven en la disfunció de la cadena de transport d'electrons. Al ser una malaltia genètica, la seva transmissió es dona verticalment, i pot ser de tres tipus: mutació autosòmica recessiva, recessiva lligada al cromosoma X o lligada al ADN mitocondrial.[67]
Referències
[modifica]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 Smith, Taryn J.; Johnson, Casey R.; Koshy, Roshine; Hess, Sonja Y.; Qureshi, Umar A. «Thiamine deficiency disorders: a clinical perspective». Annals of the New York Academy of Sciences, 1498, 1, 8-2021, pàg. 9–28. DOI: 10.1111/nyas.14536. ISSN: 1749-6632. PMC: 8451766. PMID: 33305487.
- ↑ Fattal-Valevski, Aviva «Thiamine (Vitamin B 1 )» (en anglès). Journal of Evidence-Based Complementary & Alternative Medicine, 16, 1, 1-2011, pàg. 12–20. DOI: 10.1177/1533210110392941. ISSN: 2156-5872 [Consulta: 25 setembre 2024].
- ↑ 3,0 3,1 3,2 3,3 3,4 Whitfield, Kyly C.; Bourassa, Megan W.; Adamolekun, Bola; Bergeron, Gilles; Bettendorff, Lucien «Thiamine deficiency disorders: diagnosis, prevalence, and a roadmap for global control programs». Annals of the New York Academy of Sciences, 1430, 1, 10-2018, pàg. 3–43. DOI: 10.1111/nyas.13919. ISSN: 0077-8923. PMC: 6392124. PMID: 30151974 [Consulta: 25 setembre 2024].
- ↑ Oxford English Dictionary, s.v. “beriberi (n.), Etymology,” July 2023, https://doi.org/10.1093/OED/1161656258.
- ↑ Oxford English Dictionary, s.v. “beriberi (n.), Forms,” July 2023, https://doi.org/10.1093/OED/3340317167.
- ↑ «Beriberi y carencia de tiamina». Depósito de documentos de la FAO. [Consulta: 25 setembre 2024].
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 7,14 7,15 7,16 7,17 7,18 7,19 7,20 7,21 7,22 Carpenter, Kenneth J. Beriberi, White Rice, and Vitamin B: A Disease, a Cause, and a Cure (en anglès). University of California Press, 2023-12-22.
- ↑ Lanska, Douglas J. «Chapter 30: historical aspects of the major neurological vitamin deficiency disorders: the water-soluble B vitamins». Handbook of Clinical Neurology, 95, 2010, pàg. 445–476. DOI: 10.1016/S0072-9752(08)02130-1. ISSN: 0072-9752. PMID: 19892133.
- ↑ Yamashita, Noboru; Aikawa, Tadaomi «Dutch Research on Beriberi: I. Christiaan Eijkman's Research and Evaluation of Kanehiro Takaki's Diet Reforms of the Japanese Navy». Nihon Ishigaku Zasshi. [Journal of Japanese History of Medicine], 63, 1, 3-2017, pàg. 3–21. ISSN: 0549-3323. PMID: 30549780.
- ↑ Carpenter, Kenneth J. «The discovery of thiamin». Annals of Nutrition & Metabolism, 61, 3, 2012, pàg. 219–223. DOI: 10.1159/000343109. ISSN: 1421-9697. PMID: 23183292.
- ↑ 11,0 11,1 11,2 11,3 11,4 Smith, Taryn J.; Johnson, Casey R.; Koshy, Roshine; Hess, Sonja Y.; Qureshi, Umar A. «Thiamine deficiency disorders: a clinical perspective». Annals of the New York Academy of Sciences, 1498, 1, 8-2021, pàg. 9–28. DOI: 10.1111/nyas.14536. ISSN: 0077-8923. PMC: 8451766. PMID: 33305487.
- ↑ 12,0 12,1 12,2 12,3 Odaman-Al, Işık; Gezdirici, Alper; Yıldız, Melek; Ersoy, Gizem; Aydoğan, Gönül «A novel mutation in the SLC19A2 gene in a Turkish male with thiamine-responsive megaloblastic anemia syndrome». The Turkish Journal of Pediatrics, 61, 2, 2019, pàg. 257–260. DOI: 10.24953/turkjped.2019.02.015. ISSN: 2791-6421. PMID: 31951337.
- ↑ 13,0 13,1 13,2 13,3 D. Picó, Sara. Estudio de la enfermedad de Huntington como una deficiencia de tiamina asociada a slc19a3 y sus implicaciones terapéuticas (tesi) (en castellà). Universitat Autònoma de Madrid, 2022, p. 41-46.
- ↑ 14,0 14,1 14,2 Ortigoza-Escobar, Juan Darío; Molero-Luis, Marta; Arias, Angela; Martí-Sánchez, Laura; Rodriguez-Pombo, Pilar «Treatment of genetic defects of thiamine transport and metabolism» (en anglès). Expert Review of Neurotherapeutics, 16, 7, 02-07-2016, pàg. 755–763. DOI: 10.1080/14737175.2016.1187562. ISSN: 1473-7175.
- ↑ 15,0 15,1 Barker, Randolph; Herdt, Robert W.; Rose, Beth. The rice economy of Asia. Washington, DC: Resources for the future [u.a.], 1985. ISBN 978-0-915707-15-7.
- ↑ Rice: origin, history, technology, and production. Hoboken, NJ: John Wiley & Sons, 2003. ISBN 978-0-471-34516-9.
- ↑ 17,0 17,1 17,2 17,3 17,4 Beauchesne, Elizabeth; Desjardins, Paul; Butterworth, Roger F.; Hazell, Alan S. «Up-regulation of caveolin-1 and blood-brain barrier breakdown are attenuated by N-acetylcysteine in thiamine deficiency». Neurochemistry International, 57, 7, 12-2010, pàg. 830–837. DOI: 10.1016/j.neuint.2010.08.022. ISSN: 1872-9754. PMID: 20816907.
- ↑ 18,0 18,1 Thomson, Allan D.; Marshall, E. Jane «THE NATURAL HISTORY AND PATHOPHYSIOLOGY OF WERNICKE'S ENCEPHALOPATHY AND KORSAKOFF'S PSYCHOSIS» (en anglès). Alcohol and Alcoholism, 41, 2, 01-03-2006, pàg. 151–158. DOI: 10.1093/alcalc/agh249. ISSN: 1464-3502.
- ↑ 19,0 19,1 «Understanding How Thiamine (Vitamin B1) Deficiency Causes Beriberi» (en anglès). [Consulta: 29 setembre 2024].
- ↑ 20,0 20,1 Shible, Ahmed A.; Ramadurai, Deepa; Gergen, Daniel; Reynolds, Paul M. «Dry Beriberi Due to Thiamine Deficiency Associated with Peripheral Neuropathy and Wernicke’s Encephalopathy Mimicking Guillain-Barré syndrome: A Case Report and Review of the Literature» (en anglès). American Journal of Case Reports, 20, 13-03-2019, pàg. 330–334. DOI: 10.12659/AJCR.914051. ISSN: 1941-5923. PMC: PMC6429982. PMID: 30862772.
- ↑ «What is weight loss surgery?» (en anglès), 12-02-2024. [Consulta: 9 novembre 2024].
- ↑ 22,0 22,1 22,2 22,3 «Office of Dietary Supplements - Thiamin» (en anglès). [Consulta: 9 novembre 2024].
- ↑ Wiley, Kimberly D.; Gupta, Mohit. Vitamin B1 (Thiamine) Deficiency. Treasure Island (FL): StatPearls Publishing, 2024.
- ↑ 24,00 24,01 24,02 24,03 24,04 24,05 24,06 24,07 24,08 24,09 24,10 24,11 Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. Principios de Bioquímica. 1. 2a. Omega, 1995. ISBN 8428209243.
- ↑ Flores Soto, M. E., & Segura Torres, J. E. Estructura y función de los receptores acetilcolina de tipo muscarínico y nicotínico, 6, 2005.
- ↑ 26,0 26,1 26,2 Linder, Maria C. «Nutrición y metabolismo de las vitaminas». A: Nutrición. Aspectos bioquímicos, metabólicos y clínicos, 1988, p. 101-168.
- ↑ 27,0 27,1 27,2 27,3 27,4 27,5 «Deficiencia de tiamina - Deficiencia de tiamina» (en castellà). [Consulta: 5 novembre 2024].
- ↑ «Parastesia» (en castellà). REAL ACADEMIA ESPAÑOLA: Diccionario de la lengua española, 23.ª ed.. [Consulta: 5 novembre 2024].
- ↑ Shivalkar, B.; Engelmann, I.; Carp, L.; De Raedt, H.; Daelemans, R. «Shoshin syndrome: two case reports representing opposite ends of the same disease spectrum». Acta Cardiologica, 53, 4, 1998, pàg. 195–199. ISSN: 0001-5385. PMID: 9842404.
- ↑ Trostler, N.; Guggenheim, K.; Havivi, E.; Sklan, D. «Effect of thiamine deficiency in pregnant and lactating rats on the brain of their offspring». Nutrition and Metabolism, 21, 5, 1977, pàg. 294–304. DOI: 10.1159/000176075. ISSN: 0029-6678. PMID: 917356.
- ↑ Whitfield, Kyly C.; Bourassa, Megan W.; Adamolekun, Bola; Bergeron, Gilles; Bettendorff, Lucien «Thiamine deficiency disorders: diagnosis, prevalence, and a roadmap for global control programs» (en anglès). Annals of the New York Academy of Sciences, 1430, 1, 10-2018, pàg. 3–43. DOI: 10.1111/nyas.13919. ISSN: 0077-8923. PMC: PMC6392124. PMID: 30151974.
- ↑ Butterworth, R. F. «Effects of thiamine deficiency on brain metabolism: implications for the pathogenesis of the Wernicke-Korsakoff syndrome». Alcohol and Alcoholism (Oxford, Oxfordshire), 24, 4, 1989, pàg. 271–279. DOI: 10.1093/oxfordjournals.alcalc.a044913. ISSN: 0735-0414. PMID: 2675860.
- ↑ Robergs, Robert A.; Ghiasvand, Farzenah; Parker, Daryl «Biochemistry of exercise-induced metabolic acidosis». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 287, 3, 9-2004, pàg. R502–516. DOI: 10.1152/ajpregu.00114.2004. ISSN: 0363-6119. PMID: 15308499.
- ↑ Domenech, Raúl J.; Parra, Víctor M. Contractilidad ventricular. Fisiología y proyección clínica. SciELO, 2016.
- ↑ Méndez Ortiz, Arturo Fisiopatología de la insuficiencia cardíaca. SciELO, 2006.
- ↑ 36,0 36,1 36,2 36,3 36,4 Hall, John E.; Guyton, Arthur C. Guyton and Hall textbook of medical physiology. 12th ed. Philadelphia, Pa: Saunders/Elsevier, 2011. ISBN 978-1-4160-4574-8.
- ↑ Renthal, William; Marin-Valencia, Isaac; Evans, Patricia A. «Thiamine Deficiency Secondary to Anorexia Nervosa: An Uncommon Cause of Peripheral Neuropathy and Wernicke Encephalopathy in Adolescence». Pediatric Neurology, 51, 1, 7-2014, pàg. 100–103. DOI: 10.1016/j.pediatrneurol.2014.03.025. ISSN: 0887-8994.
- ↑ Kalyesubula, Mugagga; Mopuri, Ramgopal; Asiku, Jimmy; Rosov, Alexander; Yosefi, Sara «High-dose vitamin B1 therapy prevents the development of experimental fatty liver driven by overnutrition» (en anglès). Disease Models & Mechanisms, 14, 3, 01-03-2021. DOI: 10.1242/dmm.048355. ISSN: 1754-8403. PMC: PMC7988776. PMID: 33608323.
- ↑ Federico, Alessandro; Dallio, Marcello; Caprio, Giuseppe Gerardo; Gravina, Antonietta Gerarda; Picascia, Desiree «Qualitative and Quantitative Evaluation of Dietary Intake in Patients with Non-Alcoholic Steatohepatitis» (en anglès). Nutrients, 9, 10, 10-2017, pàg. 1074. DOI: 10.3390/nu9101074. ISSN: 2072-6643.
- ↑ 40,0 40,1 Wilson, Robert Beaumont «Pathophysiology, prevention, and treatment of beriberi after gastric surgery». Nutrition Reviews, 78, 12, 10-05-2020, pàg. 1015–1029. DOI: 10.1093/nutrit/nuaa004. ISSN: 0029-6643. PMC: PMC7666909. PMID: 32388553.
- ↑ Donnino, Michael «Gastrointestinal Beriberi: A Previously Unrecognized Syndrome» (en anglès). Annals of Internal Medicine, 141, 11, 07-12-2004, pàg. 898. DOI: 10.7326/0003-4819-141-11-200412070-00035. ISSN: 0003-4819.
- ↑ Keating, Elizabeth M.; Nget, Phot; Kea, Sreng; Kuong, Suy; Daly, Leng «Thiamine deficiency in tachypnoeic Cambodian infants» (en anglès). Paediatrics and International Child Health, 35, 4, 02-10-2015, pàg. 312–318. DOI: 10.1080/20469047.2015.1109226. ISSN: 2046-9047.
- ↑ Pritchard, J. «Was it really beriberi?» (en anglès). Practical Neurology, 9, 4, 01-08-2009, pàg. 225–226. DOI: 10.1136/jnnp.2009.182105. ISSN: 1474-7758. PMID: 19608772.
- ↑ 44,0 44,1 Wilson, Robert Beaumont «Pathophysiology, prevention, and treatment of beriberi after gastric surgery». Nutrition Reviews, 78, 12, 10-05-2020, pàg. 1015–1029. DOI: 10.1093/nutrit/nuaa004. ISSN: 0029-6643. PMC: PMC7666909. PMID: 32388553.
- ↑ Thota, Vihitha; Paravathaneni, Mahati; Konduru, Sudheer; Buragamadagu, Bhanusowymya C; Thota, Manaswitha «Treatment of Refractory Lactic Acidosis With Thiamine Administration in a Non-alcoholic Patient» (en anglès). Cureus, 08-07-2021. DOI: 10.7759/cureus.16267. ISSN: 2168-8184. PMC: PMC8346261. PMID: 34373820.
- ↑ Dhir, Shibani; Tarasenko, Maya; Napoli, Eleonora; Giulivi, Cecilia «Neurological, Psychiatric, and Biochemical Aspects of Thiamine Deficiency in Children and Adults». Frontiers in Psychiatry, 10, 04-04-2019. DOI: 10.3389/fpsyt.2019.00207. ISSN: 1664-0640. PMC: PMC6459027. PMID: 31019473.
- ↑ 47,0 47,1 Dhir, Shibani; Tarasenko, Maya; Napoli, Eleonora; Giulivi, Cecilia «Neurological, Psychiatric, and Biochemical Aspects of Thiamine Deficiency in Children and Adults» (en english). Frontiers in Psychiatry, 10, 04-04-2019. DOI: 10.3389/fpsyt.2019.00207. ISSN: 1664-0640. PMC: PMC6459027. PMID: 31019473.
- ↑ Balcells Riba, Miquel Historia de las enfermedades carenciales del sistema nervioso, 2014.
- ↑ Andersen, Lars W.; Mackenhauer, Julie; Roberts, Jonathan C.; Berg, Katherine M.; Cocchi, Michael N. «Etiology and Therapeutic Approach to Elevated Lactate Levels». Mayo Clinic Proceedings, 88, 10, 10-2013, pàg. 1127–1140. DOI: 10.1016/j.mayocp.2013.06.012. ISSN: 0025-6196. PMC: PMC3975915. PMID: 24079682.
- ↑ 50,0 50,1 50,2 «Medical Library and Physician's Directory, Health Information - Beriberi (Thiamine Deficiency) (B1 Deficiency)», 16-08-2013. Arxivat de l'original el 2013-08-16. [Consulta: 29 setembre 2024].
- ↑ 51,0 51,1 51,2 51,3 «NUTRICIÓN HUMANA EN EL MUNDO EN DESARROLLO». [Consulta: 29 setembre 2024].
- ↑ «Concomitante - Definicion.de» (en castellà). [Consulta: 30 setembre 2024].
- ↑ 53,0 53,1 Smith, Taryn J.; Johnson, Casey R.; Koshy, Roshine; Hess, Sonja Y.; Qureshi, Umar A. «Thiamine deficiency disorders: a clinical perspective». Annals of the New York Academy of Sciences, 1498, 1, 8-2021, pàg. 9–28. DOI: 10.1111/nyas.14536. ISSN: 1749-6632. PMC: 8451766. PMID: 33305487.
- ↑ 54,0 54,1 54,2 «Beriberi: MedlinePlus enciclopedia médica» (en castellà). [Consulta: 5 novembre 2024].
- ↑ 55,0 55,1 55,2 55,3 «Thiamine deficiency and its prevention and control in major emergencies» (en anglès). [Consulta: 28 setembre 2024].
- ↑ Thiamine Deficiency and Associated Clinical Disorders (en anglès). DOI 10.1007/978-1-60761-311-4.
- ↑ 57,0 57,1 Assunção, Anne Karine Martins; Branco, Maria dos Remédios Freitas Carvalho; Santos, Thiago de Sousa; Costa, Silmery da Silva Brito; Júnior, José de Jesus Dias «Beriberi in Brazil: A Disease That Affects Indigenous People» (en anglès). Food and Nutrition Bulletin, 42, 3, 9-2021, pàg. 427–436. DOI: 10.1177/03795721211002057. ISSN: 0379-5721.
- ↑ 58,0 58,1 58,2 58,3 Wijnia, Jan W. «A Clinician’s View of Wernicke-Korsakoff Syndrome» (en anglès). Journal of Clinical Medicine, 11, 22, 1-2022, pàg. 6755. DOI: 10.3390/jcm11226755. ISSN: 2077-0383.
- ↑ «oftalmoplegia - Diccionari d'oftalmologia | TERMCAT». [Consulta: 28 setembre 2024].
- ↑ «Atàxia» (en català). diccionari.cat. [Consulta: 28 setembre 2024].
- ↑ 61,0 61,1 Lough, Mary E. «Wernicke's encephalopathy: expanding the diagnostic toolbox». Neuropsychology Review, 22, 2, 6-2012, pàg. 181–194. DOI: 10.1007/s11065-012-9200-7. ISSN: 1573-6660. PMID: 22577001.
- ↑ 62,0 62,1 Thomson, A. D.; Guerrini, Irene; Marshall, E. Jane «The evolution and treatment of Korsakoff's syndrome: out of sight, out of mind?». Neuropsychology Review, 22, 2, 6-2012, pàg. 81–92. DOI: 10.1007/s11065-012-9196-z. ISSN: 1573-6660. PMC: 3545191. PMID: 22569770.
- ↑ 63,0 63,1 63,2 63,3 63,4 63,5 63,6 Sako, Shuhei; Tsunogai, Toshiki; Oishi, Kimihiko. Thiamine-Responsive Megaloblastic Anemia Syndrome. Seattle (WA): University of Washington, Seattle, 1993.
- ↑ «Acidosis láctica: MedlinePlus enciclopedia médica» (en castellà). [Consulta: 29 setembre 2024].
- ↑ 65,0 65,1 Amrein, Karin; Ribitsch, Werner; Otto, Ronald; Worm, Harald C.; Stauber, Rudolf E. «Severe lactic acidosis reversed by thiamine within 24 hours». Critical Care, 15, 6, 01-12-2011, pàg. 457. DOI: 10.1186/cc10495. ISSN: 1364-8535. PMC: PMC3388689. PMID: 22129138.
- ↑ 66,0 66,1 Tabarki, Brahim; Al-Hashem, Amal; Alfadhel, Majid. Biotin-Thiamine-Responsive Basal Ganglia Disease. Seattle (WA): University of Washington, Seattle, 1993.
- ↑ 67,0 67,1 67,2 «Síndrome de Leigh | Sobre la enfermedad | GARD». [Consulta: 11 novembre 2024].

