Metabolisme

El metabolisme és el conjunt de reaccions químiques que tenen lloc en un organisme per a mantenir-lo viu. Aquests processos permeten als organismes de créixer i reproduir-se, de mantenir les estructures i respondre al seu medi. El metabolisme se sol subdividir en dues categories. El catabolisme descompon matèria orgànica, com per exemple per extreure energia en la respiració cel·lular. L'anabolisme, d'altra banda, utilitza energia per construir components de les cèl·lules com ara proteïnes i àcids nucleics. Aquesta energia lligada al metabolisme és l'energia endosomàtica.
Les reaccions químiques del metabolisme s'organitzen en rutes metabòliques, en què una substància química és transformada en una altra per una seqüència d'enzims. Els enzims són crucials en el metabolisme, car permeten que els organismes duguin a terme reaccions desitjables però termodinàmicament desfavorables acoblades a reaccions favorables. Els enzims també permeten la regulació de les rutes metabòliques en resposta a canvis en el medi de la cèl·lula o senyals d'altres cèl·lules.
El metabolisme d'un organisme determina quines substàncies li són nutritives i quines li són verinoses. Per exemple, alguns procariotes utilitzen sulfur d'hidrogen com a nutrient, però aquest gas és verinós per als animals.[1] La velocitat del metabolisme, el ritme metabòlic, també influencia la quantitat d'aliment que necessita un organisme.
Una característica sorprenent del metabolisme és la semblança de les rutes metabòliques bàsiques fins i tot entre espècies molt diferents. Per exemple, el conjunt d'àcid carboxílics coneguts com a intermedis del cicle de Krebs són presents en tots els organismes i existeixen en espècies tan diverses com l'eubacteri unicel·lular Escherichia coli i els organismes pluricel·lulars més grossos com ara els elefants.[2] Aquestes semblances sorprenents en el metabolisme són probablement el resultat de la gran eficiència d'aquestes rutes i -alhora- la seva aparició primerenca en la història evolutiva.[3][4]
Substàncies bioquímiques clau
[modifica]
La majoria d'estructures que formen els animals, plantes i microbis es componen de tres tipus bàsics de molècula: els aminoàcids, els carbohidrats i els lípids (sovint anomenats greixos). Com que aquestes molècules són essencials per la vida, el metabolisme es concentra en la manufactura d'aquestes molècules, en la construcció de cèl·lules i teixits, o descomponent-les per utilitzar-les com a font d'energia, en la digestió i l'ús d'aliments. Moltes substàncies bioquímiques importants poden ser unides per formar polímers com ara l'ADN i les proteïnes. Aquestes macromolècules són parts essencials de tots els éssers vius. La taula següent llista alguns dels polímers biològics més comuns.
| Tipus de molècula | Nom de les formes de monòmer | Nom de les formes de polímer | Exemples de formes de polímer |
|---|---|---|---|
| Aminoàcids | Aminoàcids | Proteïnes (anomenades també polipèptids) | Proteïnes fibroses i proteïnes globulars |
| Carbohidrats | Monosacàrids | Polisacàrids | Midó, glicogen i cel·lulosa |
| Àcids nucleics | Nucleòtids | Polinucleòtids | ADN i ARN |
Aminoàcids i proteïnes
[modifica]Les proteïnes es componen d'aminoàcids arranjats en una cadena lineal i units per enllaços peptídics. Moltes proteïnes són els enzims que catalitzen les reaccions químiques del metabolisme. Altres proteïnes tenen funcions estructurals o mecàniques, com ara les proteïnes que formen el citoesquelet, una mena de carcassa que manté la forma de la cèl·lula.[5] Les proteïnes també són importants en la senyalització cel·lular, la resposta immunitària, l'adhesió cel·lular, el transport actiu a través de membranes i el cicle cel·lular[6]
Lípids
[modifica]Els lípids són el grup de substàncies bioquímiques més divers. Els seus usos estructurals principals són com a part de membranes com ara la membrana cel·lular, o com a font d'energia.[6] Els lípids solen definir-se com a molècules amfipàtiques o hidròfobes que es dissolen en dissolvents orgànics, com ara el benzè o el cloroform.[7] Els greixos són un gran grup de compostos que contenen àcids grassos i glicerol; una molècula de glicerol unida a tres èsters d'àcids grassos és un triacilglicerol.[8] Existeixen diverses variacions d'aquesta estructura bàsica, incloent-hi nuclis alternatius com ara l'esfingosina en els esfingolípids, i grups hidròfils com ara els fosfats en els fosfolípids. Els esteroides com ara el colesterol són un altre gran grup de lípids manufacturats dins les cèl·lules.[9]
Carbohidrats
[modifica]
Els carbohidrats són aldehids o cetones de cadena recta amb molts grups hidroxils que poden existir com a cadenes rectes o com a anells. Els carbohidrats són les molècules biològiques més abundants, i fan nombroses funcions, com ara l'emmagatzemament i transport d'energia (midó, glicogen) o formar components estructurals (la cel·lulosa en les plantes, la quitina en els animals).[6] Les unitats bàsiques de carbohidrats reben el nom de monosacàrids i inclouen la galactosa, la fructosa i, la més important, la glucosa. Els monosacàrids poden unir-se per formar polisacàrids de manera gairebé il·limitada.[10]
Nucleòtids
[modifica]Els polímers ADN i ARN són llargues cadenes de nucleòtids. Aquestes molècules són essencials per l'emmagatzemament i l'ús de la informació genètica, a través dels processos de transcripció i biosíntesi de proteïnes.[6] Aquesta informació és protegida per mecanismes de reparació de l'ADN i es propaga per mitjà de la replicació de l'ADN. Alguns virus tenen un genoma d'ARN, com ara el VIH, que utilitza la transcripció inversa per crear una plantilla d'ADN a partir del seu genoma víric d'ARN.[11] L'ARN en ribozims com ara els spliceosomes i els ribosomes és similar als enzims, car pot catalitzar reaccions químiques. Es formen nucleòsids individuals per mitjà de la unió d'una base nitrogenada a un sucre ribosa. Aquestes bases són anells heterocíclics que contenen nitrogen, i es classifiquen com a purines o pirimidines. Els nucleòtids també actuen com a coenzims en reaccions metabòliques de transferència de grups.[12]
Coenzims
[modifica]
El metabolisme implica una immensa varietat de reaccions químiques, però la majoria cauen dins uns quants tipus bàsics de reaccions que impliquen la transferència de grups funcionals.[13] Aquesta química comuna permet a les cèl·lules utilitzar un conjunt reduït d'intermedis metabòlics per transportar grups químics d'una reacció a l'altra.[12] Aquests intermedis de transferència de grups reben el nom de coenzims. Cada tipus de transferència de grups correspon a un coenzim determinat, que és el substrat d'un conjunt d'enzims que el produeixen i d'un conjunt d'enzims que el consumeixen. Per tant, aquests coenzims estan sent fabricats, consumits i reciclats contínuament.[14]
Un coenzim essencial és el trifosfat d'adenosina (ATP), la «moneda» universal d'energia de les cèl·lules. Aquest nucleòtid és utilitzat per transferir energia química entre diferents reaccions químiques. Només hi ha una petita quantitat d'ATP dins les cèl·lules, però com que es regenera contínuament, el cos humà pot utilitzar el seu equivalent en pes en ATP cada dia.[14] L'ATP actua com a pont entre el catabolisme i l'anabolisme; les reaccions catabòliques generen ATP i les anabòliques en consumeixen. També serveix com a portador de grups de fosfats en reaccions de fosforilació.
Una vitamina és un compost orgànic requerit en petites quantitats que no pot ser fabricat dins les cèl·lules. En nutrició humana, la majoria de vitamines funcionen com a coenzims després de la modificació; per exemple, totes les vitamines solubles en aigua són fosforitzades o enllaçades a nucleòtids quan se les utilitza a les cèl·lules.[15] El nicotinamida adenina dinucleòtid (NADH), un derivat de la vitamina B₃ (niacina), és un important coenzim que actua com a acceptor d'hidrogen. Centenars de tipus diferents de deshidrogenases retiren electrons del seu substrat i redueixen NAD+ en NADH. Aquesta forma reduïda del coenzim esdevé aleshores un substrat per qualsevol de les reductases de la cèl·lula que necessitin reduir els seus substrats.[16] El nicotinamida adenina dinucleòtid existeix en dues formes relacionades dins una cèl·lula, NADH i NADPH. La forma NAD+/NADH és més important en les reaccions catabòliques, mentre que la forma NADP+/NADPH és utilitzada en reaccions anabòliques.

Minerals i cofactors
[modifica]Els elements inorgànics juguen papers crítics en el metabolisme; alguns són abundants (per exemple, el sodi i el potassi) mentre que d'altres funcionen a concentracions mínimes. Aproximadament el 99% de la massa d'un mamífer es compon dels elements carboni, nitrogen, calci, sodi, clor, potassi, hidrogen, fòsfor, oxigen i sofre.[17] Els compostos orgànics (proteïnes, lípids i carbohidrats) contenen la majoria del carboni i del nitrogen, i la majoria d'hidrogen i oxigen estan presents en forma d'aigua.[17]
Els abundants elements inorgànics actuen com a electròlits iònics. Els ions més importants són el sodi, el potassi, el calci, el magnesi, el clorur, el fòsfor i l'hidrogencarbonat. El manteniment de gradients precisos a través de les membranes cel·lulars manté la pressió osmòtica i el pH.[18] Els ions també són essencials pels nervis i els músculs, car els potencials d'acció en aquests teixits es produeixen per l'intercanvi d'electrolits entre el líquid extracel·lular i el citosol.[19] Els ellectrolits entren i surten de les cèl·lules a través de proteïnes de la membrana cel·lular denominades canals iònics. Per exemple, la contracció muscular depèn del moviment de calci, sodi i potassi a través de canals iònics de la membrana cel·lular i túbuls-T.[20]
Els metalls de transició solen estar presents com a elements traça en els organismes, i el zinc i el ferro són els més abundants.[21][22] Aquests metalls són utilitzats en algunes proteïnes com a cofactors i són essencials per l'activitat d'enzims com ara la catalasa o proteïnes portadores d'oxigen com ara l'hemoglobina.[23] Aquests cofactors estan units fermament a una proteïna específica; tot i que els cofactors enzimàtics poden ser modificats durant la catàlisi, els cofactors sempre tornen al seu estat original quan s'ha completat la catàlisi. Els micronutrients metàl·lics són portats als organismes per transportadors específics, i units a proteïnes d'emmagatzemament com ara la ferritina o la metal·lotioneïna quan no se les utilitza.[24][25]
Catabolisme
[modifica]El catabolisme és el conjunt de processos metabòlics que descomponen molècules grans. Això inclou la descomposició i oxidació de molècules d'aliments. L'objectiu de les reaccions catabòliques és proveir l'energia i els components que necessiten les reaccions anabòliques. La naturalesa exacta d'aquestes reaccions catabòliques varia entre un organisme i l'altre; els organòtrofs utilitzen molècules orgàniques com a font d'energia, mentre que els litòtrofs utilitzen substrats inorgànics i els fotòtrofs capturen la llum solar com a energia química. Tanmateix, totes aquestes formes de metabolisme depenen de reaccions redox que impliquen la transferència de molècules donadores reduïdes (per exemple, molècules orgàniques, aigua, amoníac, sulfur d'hidrogen o ions ferrosos) a molècules acceptores com ara l'oxigen, un nitrat o un sulfat.[26] En els animals, aquestes reaccions impliquen la descomposició de complexes molècules orgàniques en molècules més senzilles, com ara el diòxid de carboni o l'aigua. En els organismes fotosintètics com ara les plantes i els cianobacteris, aquestes reaccions de transferència d'electrons no alliberen energia, sinó que són utilitzades com un mode d'emmagatzemament de l'energia absorbida de la llum solar.[27]
El conjunt més comú de reaccions catabòliques en els animals es pot separar en tres fases principals. En la primera, molècules orgàniques grans com ara les proteïnes, els polisacàrids o els lípids són digerides en components més petits a l'exterior de les cèl·lules. Després, aquestes molècules més petites són absorbides per les cèl·lules encara més petites, sovint acetil coenzim A (CoA), que allibera una mica d'energia. Finalment, el grup acetil del CoA és oxidat en aigua i diòxid de carboni en el cicle de Krebs i la cadena de transport d'electrons, alliberant l'energia que està emmagatzemada per mitjà de la reducció del coenzim nicotinamida adenina dinucleòtid (NAD+) en NADH.
Digestió
[modifica]Macromolècules com ara el midó, la cel·lulosa o les proteïnes no poden ser absorbides ràpidament per les cèl·lules i cal descompondre-les en unitats més petites abans que puguin ser utilitzades en el metabolisme cel·lular. Diversos tipus comuns d'enzims digereixen aquests polímers. Aquests enzims digestius inclouen proteases que digereixen proteïnes en aminoàcids, així com glicòsid hidrolases que digereixen polisacàrids en monosacàrids.
Els microbis simplement secreten enzims digestius al medi que els envolta,[28][29] mentre que els animals només secreten aquests enzims de cèl·lules especialitzades al seu intestí.[30] Els aminoàcids o sucres alliberats per aquests enzims extracel·lulars són posteriorment bombats dins les cèl·lules per proteïnes específiques del transport actiu.[31][32]

Energia a partir de compostos orgànics
[modifica]El catabolisme dels carbohidrats és la descomposició de carbohidrats en unitats més petites. Els carbohidrats solen ser portats a les cèl·lules un cop han estat digerits en monosacàrids.[33] Un cop a dins, la ruta principal de descomposició és la glicòlisi, en què sucres com ara la glucosa i la fructosa són transformats en piruvat i es genera una mica d'ATP.[34] El piruvat és un intermedi en diverses rutes metabòliques, però la majoria és convertit en acetil-CoA i injectat al cicle de Krebs. Tot i que es genera més ATP en el cicle de Krebs, el producte més important és el NADH, que es forma a partir del NAD+ quan s'oxida l'acetil-CoA. Aquesta oxidació allibera diòxid de carboni com a residu. En condicions anaeròbiques, la glicòlisi produeix lactat quan l'enzim lactat deshidrogenasa reoxida el NADH en NAD+ per reutilitzar-lo en la glicòlisi. Una ruta alternativa per la descomposició de la glucosa és la ruta de la pentosa fosfat, que redueix el coenzim NADPH i produeix sucres pentosa com ara la ribosa, el component sucrós dels àcids nucleics.
La hidròlisi catabolitza els lípids en àcids grassos lliures i glicerol. El glicerol entra en glicòlisi i els àcids grassos són descomposts per mitjà d'oxidació ß per alliberar acetil-CoA, que és posteriorment injectat al cicle de Krebs. Els àcids grassos alliberen més energia en oxidar-se que els carbohidrats perquè aquests últims contenen més oxigen a la seva estructura.
Els aminoàcids o bé es fan servir per sintetitzar proteïnes i altres biomolècules, o bé són oxidats en urea i diòxid de carboni com a font d'energia.[35] La ruta de l'oxidació comença amb la retirada del grup amino per una transaminasa. El grup amino és injectat al cicle de la urea, deixant un esquelet de carboni deaminat en format de cetoàcid. Alguns d'aquests cetoàcids són intermedis en el cicle de Krebs; per exemple, la deaminació del glutamat forma α-cetoglutarat.[36] Els aminoàcids glucogènics també es poden transformar en glucosa per mitjà de la gluconeogènesi (explicada més avall).[37]
Transformacions energètiques
[modifica]Fosforilació oxidativa
[modifica]En la fosforilació oxidativa, els electrons retirats de molècules d'aliment en rutes com ara el cicle de Krebs són transferits a l'oxigen i l'energia alliberada és utilitzada per crear ATP. En els eucariotes, això ho fan una sèrie de proteïnes de les membranes dels mitocondris anomenades la cadena de transport d'electrons. En els procariotes, aquestes proteïnes es troben a la membrana interior de la cèl·lula.[38] Aquestes proteïnes utilitzant l'energia alliberada pels electrons que passen de molècules reductores com el NADH en oxigen per bombar protons a través d'una membrana.[39]
El bombament de protons a l'exterior dels mitocondris crea una diferència de concentració protònica a la membrana i genera un gradient electroquímic.[40] Això empeny els protons de nou dins els mitocondris a través de la base d'un enzim anomenat ATP sintasa. El flux de protons fa que la subunitat de la tija roti, fent que la zona activa del domini de la sintasa canviï de forma i fosforilitzi difosfat d'adenosina – convertint-lo en ATP.[14]
Energia a partir de compostos inorgànics
[modifica]La quimiolitotròfia és un tipus de metabolisme, observat en els procariotes, en què s'obté energia de l'oxidació de compostos inorgànics. Aquests organismes poden utilitzar hidrogen,[41] compostos reduïts de sofre (com ara sulfur, sulfur d'hidrogen i tiosulfat),[1] ferro ferrós (FeII)[42] o amoníac[43] com a fonts de poder reductor, i obtenen energia de l'oxidació d'aquests compostos amb acceptors d'electrons com ara l'oxigen o el nitrit.[44] Aquests processos microbians són importants en cicles biogeoquímics globals com ara l'acetogènesi, la nitrificació i la desnitrificació, i són essencials per la fertilitat del sòl.[45][46]
Energia a partir de la llum solar
[modifica]L'energia de la llum solar és utilitzada per les plantes, els cianobacteris, els bacteris porpra, bacteris verds del sofre i alguns protists. Aquest procés està unit sovint a la conversió de diòxid de carboni en compostos orgànics, com a part de la fotosíntesi, que és tractada més avall. Tanmateix, els sistemes de captura d'energia i de fixació de carboni poden funcionar per separat en els procariotes, car els bacteris púrpura i els bacteris verds del sofre poden utilitzar la llum solar com a font d'energia, tot alternant entre la fixació del carboni i la fermentació de compostos orgànics.[47][48]
La captura de l'energia solar és un procés que és similar en principi a la fosforilació oxidativa, car implica l'emmagatzemament d'energia en forma de gradient de concentració de protons, i l'ús d'aquesta força mecànica dels protons per alimentar la síntesi d'ATP.[14] Els electrons requerits per fer funcionar aquesta cadena de transport d'electrons venen de proteïnes recol·lectores de llum anomenades centres de reacció fotosintètics. Aquestes estructures es classifiquen en dos tipus segons el tipus de pigment fotosintètic; la majoria d'eubacteris fotosintètics només tenen un tipus de centre de reacció, mentre que les plantes i els cianobacteris en tenen dos.[49]
En les plantes, el fotosistema II utilitza l'energia lumínica per treure electrons de l'aigua, alliberant oxigen com a residu. Aleshores, els electrons flueixen vers el complex del citocrom b6f, que n'utilitza l'energia per bombar protons a través de la membrana de tilacoide del cloroplast.[50] Aquests protons tornen a travessar la membrana, alimentant la síntesi d'ATP, com abans. Aleshores, els electrons flueixen a través del fotosistema I, i poden servir o bé per reduir el coenzim NADP+, per utilitzar-lo en el cicle de Calvin que és tractat més avall; o bé per generar encara més ATP.[51]
Anabolisme
[modifica]L'anabolisme és el conjunt de processos metabòlics constructius en què l'energia alliberada pel catabolisme s'utilitza per sintetitzar molècules complexes. En general, les molècules complexes que formen les estructures cel·lulars són produïdes pas a pas a partir de precursors petits i senzills. L'anabolisme inclou tres fases bàsiques:
- La producció de precursors com ara aminoàcids, monosacàrids, isoprenoides i nucleòtids.
- La seva activació en formes reactives utilitzant energia de l'ATP.
- Per acabar, l'assemblatge d'aquests precursors en molècules complexes com ara proteïnes, polisacàrids, lípids i àcids nucleics.
Els organismes presenten diferències en la quantitat de molècules de les cèl·lules poden produir ells mateixos. Els autòtrofs com ara les plantes poden produir les molècules orgàniques complexes com ara els polisacàrids i les proteïnes a partir de molècules senzilles com el diòxid de carboni i l'aigua. Els heteròtrofs, en canvi, requereixen una font de substàncies més complexes, com ara monosacàrids i aminoàcids, per produir aquestes molècules complexes. Els organismes també es poden classificar segons la font última de l'energia; els fotoautòtrofs i els fotoheteròtrofs obtenen energia de la llum, mentre que els quimioautòtrofs i els quimioheteròtrofs obtenen energia de reaccions oxidatives inorgàniques.
Fixació del carboni
[modifica]
La fotosíntesi és la síntesi de carbohidrats a partir de la llum solar, el diòxid de carboni (CO₂) i l'aigua, produint oxigen com a residu. Aquest procés utilitza l'ATP i la NADPH produïts pels centres de reacció fotosintètics, com es descriu més amunt, per transformar CO₂ en 3-fosfoglicerat, que després potser transformat en glucosa. Aquesta reacció de fixació del carboni és catalitzada per l'enzim RuBisCO com a part del cicle de Calvin–Benson.[52] Existeixen tres tipus de fotosíntesi en les plantes: la fixació del carboni C3, la fixació del carboni C4 i la fotosíntesi MAC. Es diferencien en la ruta que pren el diòxid de carboni per arribar al cicle de Calvin; les plantes C3 fixen el CO₂ directament, mentre que la C4 i la fotosíntesi MAC incorporen primer el CO₂ en altres compostos, com a adaptacions per afrontar una intensa llum solar i condicions àrides.[53]
En els procariotes fotosintètics, els mecanismes de fixació del carboni són més diversos. Poden fixar el carboni per mitjà del cicle de Calvin–Benson, un cicle de Krebs invers,[54] o la carboxilació d'acetil-CoA.[55][56] Els quimioautòtrofs procariotes també fixen CO₂ per mitjà del cicle de Calvin–Benson, però utilitzen energia de compostos inorgànics per alimentar la reacció.[57]
Carbohidrats i glicans
[modifica]En l'anabolisme dels carbohidrats, es poden convertir àcids orgànics senzills en monosacàrids com ara la glucosa, i després es poden fer servir per produir polisacàrids com ara el midó. La generació de glucosa a partir de compostos com ara el piruvat, el lactat, el glicerol, el 3-fosfoglicerat i els aminoàcids rep el nom de gluconeogènesi. La gluconeogènesi transforma el piruvat en glucosa-6-fosfat per mitjà d'una sèrie d'intermedis, molts dels quals també es troben en la glicòlisi.[34] Tanmateix, aquesta ruta no és simplement una glicòlisi conduïda en sentit invers, car alguns passos estan catalitzats per enzims no glicolítics. Això és important, car permet que la formació i descomposició de la glucosa siguin regulades per separat i evita que ambdues rutes funcionin alhora en un cicle fútil.[58][59]
Tot i que el greix és una manera habitual d'emmagatzemar energia, en els vertebrats com per exemple els humans, els àcids grassos així emmagatzemats no es poden transformar en glucosa per mitjà de la gluconeogènesi, car aquests organismes no són capaços de transformar acetil-CoA en piruvat; les plantes poden, però els animals manquen de la maquinària enzimàtica necessària.[60] Com a resultat d'això, després d'un període llarg de fam, els vertebrats necessiten produir cossos de cetona a partir d'àcids grassos per substituir la glucosa en teixits com ara el cervell, que no poden metabolitzar els àcids grassos.[61] En altres organismes, com les plantes i els eubacteris, aquest problema metabòlic és solucionat per mitjà del cicle del glioxilat, que se salta el pas de la descarboxilació del cicle de Krebs i permet la transformació d'acetil-CoA en oxaloacetat, on pot ser utilitzat per produir glucosa.[62][60]
Els polisacàrids i glicans es formen per l'addició seqüencial de monosacàrids per la glicosiltransferasa des d'un donador sucre-fosfat reactiu com ara la uridina difosfat glucosa (UDP-glucosa) a un grup hidroxil acceptor al polisacàrid creixent. Com que qualsevol dels grups hidroxil de l'anell del substrat poden ser acceptors, els polisacàrids produïts poden tenir una estructura recta o ramificada.[63] Els polisacàrids formats així poden tenir funcions estructurals o metabòliques per si mateixos, o poden ser transferits a lípids i proteïnes per enzims anomenats oligosacariltransferases.[64][65]
Àcids grassos, isoprenoides i esteroides
[modifica]
Els àcids grassos són formats per àcid gras sintases que polimeritzen i després redueixen unitats d'acetil-CoA. Les cadenes acil dels àcids grassos són esteses per un cicle de reaccions que afegeixen el grup actil, el redueixen a un alcohol, el deshidraten en un grup alquè i el tornen a reduir en un grup alcà. Els enzims encarregats de la biosíntesi d'àcids grassos es divideixen en dos grups; en els animals i els fongs, totes aquestes reaccions de les àcid gras sintases són fetes per una única proteïna multifuncional de tipus I,[66] mentre que en els plastidis de les plantes i en els eubacteris, cada pas de la ruta és dut a terme per un enzim de tipus II diferent.[67][68]
Els terpens i isoprenoides són una gran classe de lípids que inclou els carotenoides i forma la classe més gran de productes naturals de les plantes.[69] Aquests compostos es formen per l'assemblatge i modificació d'unitats d'isoprè donades pels precursors reactius isopentenil pirofosfat i dimetilal·lil pirofosfat.[70] Aquests precursors es poden produir de diferents maneres. En els animals i els arqueus, la ruta del mevalonat produeix aquests compostos a partir d'acetil-CoA,[71] mentre que en les plantes i els eubacteris, la ruta del no-mevalonat utilitza piruvat i gliceraldehid 3-fosfat com a substrats.[72][70] Una reacció important que utilitza aquests donadors d'isoprè activats és la biosíntesi dels esteroides. En aquest cas, les unitats d'isoprè són fusionades per crear esqualè i posteriorment plegades i arranjades en un conjunt d'anells per produir lanosterol.[73] El lanosterol pot ser transformat posteriorment en altres esteroides com ara colesterol o ergosterol.[74][73]
Proteïnes
[modifica]Els organismes varien en la seva capacitat de sintetitzar els vint aminoàcisds comuns. La majoria d'eubacteris i plantes poden sintetitzar-los tots, però els mamífers només poden sintetitzar els deu aminoàcids no essencials.[6] Per tant, han d'obtenir els aminoàcids essencials del seu aliment. Tots els aminoàcids són sintetitzats a partir d'intermedis en la glicòlisi, el cicle de Krebs, o la ruta de la pentosa-fosfat. El nitrogen és subministrat pel glutamat i la glutamina. La síntesi dels aminoàcids depèn de la formació de l'àcid alfa-ceto apropiat, que després és transaminat per formar un aminoàcid.[75]
Els aminoàcids són transformats en proteïnes quan són units en una cadena per enllaços peptídics. Cada proteïna diferent té una seqüència diferent de residus d'aminoàcids; es tracta de la seva estructura primària. Igual que les lletres de l'alfabet poden ser combinades per formar una varietat gairebé infinita de paraules, els aminoàcids poden ser units en seqüències variables per formar una enorme varietat de proteïnes. Les proteïnes estan formades per aminoàcids que han estat activats per unió a una molècula d'ARN de transferència per un enllaç èster. Aquests precursors d'aminoacil-ARNt és produït en una reacció dependent de l'ATP realitzada per una aminoacil ARNt sintetasa.[76] Aquest aminoacil-RNAt esdevé aleshores un substrat pel ribosoma, que enganxa l'aminoàcid a la cadena proteica creixent, utilitzant la informació seqüencial continguda a l'ARN missatger.[77]
Síntesi i salvament de nucleòtids
[modifica]Els nucleòtids són formats d'aminoàcids, diòxid de carboni i àcid fòrmic en rutes que requereixen grans quantitats d'energia metabòlica.[78] Per consegüent, la majoria d'organismes tenen mecanismes eficients per salvar nucleòtids ja formats.[78][79] Les purines són sintetitzades com a nucleòsids (bases unides a una ribosa). Tant l'adenina com la guanina es formen a partir del nucleòsid precursor inosina monofosfat, que és sintetitzat mitjançant l'ús d'àtoms dels aminoàcids glicina, glutamina i àcid aspàrtic, així com metanoat transferit del coenzim tetrahidrofolat. Les pirimidines, d'altra banda, són sintetitzades a partir de la base orotat, que es forma a partir de glutamina i aspartat.[80]
Xenobiòtics i metabolisme redox
[modifica]Tots els organismes estan constantment exposats a compostos que no poden utilitzar com a aliment i que serien perjudicials si s'acumulessin dins les cèl·lules, car no tenen cap funció metabòlica. Aquests compostos potencialment perjudicials reben el nom de xenobiòtics.[81] Els xenobiòtics com ara les drogues sintètiquess, els verins i els antibiòtics són desintoxicats per un conjunt d'enzims metabolitzadors dels xenobiòtics. En els humans, aquests enzims inclouen citocrom P450 oxidases,[82] UDP-glucuronosiltransferases,[83] i glutatió S-transferases.[84] Aquest conjunt d'enzims actua en tres fases, començant per l'oxidació del xenobiòtic (fase I), conjugant grups solubles en aigua a la molècula (fase II). El xenobiòtic, modificat perquè sigui soluble en aigua, pot ser bombat aleshores a l'exterior de les cèl·lules, i els organismes pluricel·lulars poden metabolitzar-lo encara més abans d'excretar-lo. En ecologia, aquestes reaccions són especialment importants en la biodegradació microbiana de contaminants i la bioremediació de terres contaminades i vessaments de petroli.[85] Moltes d'aquestes reaccions microbianes es troben també en els organismes pluricel·lulars, però a causa de la seva increïble diversitat, els microbis poden actuar sobre una varietat molt més gran de xenobiòtics que els organismes pluricel·lular, i degradar fins i tot contaminants orgànics persistents com ara compostos d'organoclòrids.[86]
Un problema relacionat pels organismes aeròbics és l'estrès oxidatiu.[87] Processos com ara la fosforilació oxidativa i la formació d'enllaços disulfurs durant el plegament proteic produeixen espècies reactives de l'oxigen com ara el peròxid d'hidrogen.[88] Aquests oxidants perjudicials són eliminats per metabòlits antioxidants com ara el glutatió i enzims com ara les catalases i peroxidases.[89][90]
Termodinàmica dels organismes
[modifica]Els organismes han d'obeir les lleis de la termodinàmica, que descriuen la transferència de calor i de treball. La segona llei de la termodinàmica estableix que en qualsevol sistema tancat, la quantitat d'entropia (desordre) tendeix a créixer. Tot i que la fascinant complexitat dels éssers vius sembla contradir aquesta llei, la vida és possible perquè tots els organismes són sistemes oberts que intercanvien matèria i energia amb el seu medi. Així doncs, els sistemes vivents no es troben en un equilibri, sinó que són sistemes dissipatius que mantenen el seu estat d'alta complexitat causant un major increment en l'entropia del seu medi.[91] El metabolisme d'una cèl·lula fa això acoblant els processos espontanis del catabolisme als processos no espontanis de l'anabolisme. En termes termodinàmics, el metabolisme manté l'ordre per mitjà de la creació de desordre.[92]
Regulació i control
[modifica]Com que els medis de molts organismes estan en canvi constant, les reaccions del metabolisme han de ser regulades amb precisió per mantenir un conjunt de condicions constants dins les cèl·lules, anomenat homeòstasi.[93] [94] La regulació metabòlica també permet als organismes respondre a senyals i interaccionar activament amb el seu medi.[95] Dos conceptes estretament relacionats són importants per comprendre com són controlades les rutes metabòliques. Primerament, la regulació enzimàtica en una ruta és la manera en què la seva activitat augmenta i disminueix en resposta a senyals. Segonament, el control exercit per aquest enzim és l'efecte que tenen aquests canvis en la seva activitat sobre el ritme general de la ruta (el flux per la ruta).[96] Per exemple, un enzim pot presentar grans canvis en l'activitat (està altament regulat), però si aquests canvis tenen poc efecte sobre el flux d'una ruta metabòlica, aleshores aquest enzim no està implicat en el control de la ruta.[97]

Hi ha múltiples nivells de regulació metabòlica. En la regulació intrínseca, la ruta metabòlica s'autoregula en resposta a canvis en els nivells de substrats o productes; per exemple, una disminució en la quantitat d'un producte pot augmentar el flux per la ruta per compensar-ho.[96] Aquest tipus de regulació sol implicar una regulació al·lostèrica de l'activitat de diversos enzims de la ruta.[98] El control extrínsec implica que una cèl·lula d'un organisme pluricel·lular canviï el seu metabolisme en resposta a senyals d'altres cèl·lules. Aquests senyals venen sovint en forma de missatgers solubles com ara hormones i factors de creixement, i són detectats per receptors específics de la superfície cel·lular.[99] Aquests senyals són posteriorment transmesos a l'interior de la cèl·lula per sistemes de segons missatgers que sovint impliquen la fosforilació de proteïnes.[100]
Un exemple molt ben comprès de control extrínsec és la regulació del metabolisme de la glucosa per l'hormona insulina.[101] La insulina és produïda en resposta a augments en el nivell de glucosa a la sang. La unió de l'hormona amb receptors d'insulina de les cèl·lules activa una cascada de proteïna cinases que fa que les cèl·lules prenguin glucos i la transformin en molècules d'emmagatzemament com ara àcids grassos i glicogen.[102] El metabolisme del glicogen és controlat per l'activitat de la fosforilasa, l'enzim que descompon el glicogen, i la glicogen sintetasa, l'enzim que el fabrica. Aquests enzims són regulats de manera recíproca; la fosforilació inhibeix la glicogen sintasa, però activa la fosforilasa. La insulina causa la síntesi de glicogen activant proteïna fosfatases i provocant una reducció en la fosforilació d'aquests enzims.[103]
Evolució
[modifica]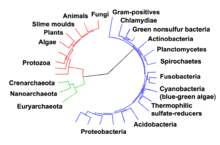
Les rutes metabòliques essencials descrites més amunt, com ara la glicòlisi i el cicle de Krebs, estan presents en els tres dominis de la vida, i es trobaven en l'últim avantpassat universal.[104][2] Aquesta cèl·lula ancestral universal era un procariota i probablement un metanogen que tenia un extens metabolisme dels aminoàcids, nucleòtids, carbohidrats i lípids.[105][106] La conservació d'aquestes rutes antigues durant l'evolució posterior podria ser la conseqüència del fet que aquestes reaccions són una solució òptima al seu problema metabòlic particular, car rutes com ara la glicòlisi i el cicle de Krebs produeixen els seus productes finals molt eficientment i en un nombre mínim de passos.[3][4] Les primeres rutes del metabolisme basat en els enzims podrien haver estat parts del metabolisme de nucleòtids de purina, i les rutes anteriors haurien format part de l'antic món d'ARN.[107]
S'han proposat molts models per descriure els mecanismes pels quals evolucionen noves rutes metabòliques. Aquests models inclouen l'addició seqüencial de nous enzims a una ruta ancestral curta, la duplicació i posterior divergència de rutes senceres, o el reclutament d'enzims preexistents i el seu assemblatge en una nova ruta de reacció.[108] La importància relativa d'aquests mecanismes és incerta, però estudis genòmics han demostrat que els enzims d'una mateixa ruta comparteixen probablement una descendència comuna, suggerint que moltes rutes han evolucionat pas a pas, amb la creació de noves funcions a partir de passos ja existents de la ruta.[109] Un model alternatiu ve d'estudis que segueixen l'evolució de l'estructura de les proteïnes en xarxes metabòliques; aquest model suggereix que els enzims són reclutats de manera invasiva, manllevant enzims perquè duguin a terme funcions similars en rutes metabòliques diferents (evident a la MANET Database).[110] Aquests processos de reclutament resulten en un mosaic enzimàtic evolutiu.[111] Una tercera possibilitat és que algunes parts del metabolisme existeixin com a «mòduls» que poden ser reutilitzats en rutes diferents i que duen a terme funcions similars en molècules diferents.[112]
A més de l'evolució de noves rutes metabòliques, l'evolució també pot causar la pèrdua de funcions metabòliques. Per exemple, en alguns paràsits, els processos metabòlics que no són essencials per a la supervivència han desaparegut, i el paràsit pot robar aminoàcids, nucleòtids i carbohidrats ja formats del seu hoste.[113] En els organismes endosimbiòtics s'observen unes capacitats metabòliques reduïdes de manera similar.[114]
Investigació i manipulació
[modifica]
Tradicionalment, el metabolisme és estudiat amb un mètode reduccionista que es concentra en una única ruta metabòlica. És especialment útil l'ús de traçadors radioactius als nivells d'organisme, de teixit i de cèl·lula, que determinen les rutes des dels precursors fins als productes finals per mitjà de la identificació d'intermedis i de productes etiquetats radioactivament.[115] Els enzims que catalitzen aquestes reaccions químiques poden ser purificats i les seves cinètica i respostes davant d'inhibidors poden ser investigades. Un procés paral·lel és la identificació de les petites molècules d'una cèl·lula o un teixit; el conjunt complet d'aquestes molècules rep el nom de metaboloma. En general, aquests estudis ofereixen una bona visió de l'estructura i la funció de rutes metabòliques senzilles, però no són apropiats a l'hora d'aplicar-los a sistemes més complexos com ara el metabolisme d'una cèl·lula completa.[116]
La imatge dona una idea de la complexitat de les xarxes metabòliques en cèl·lules que contenen milers d'enzims diferents. La imatge presenta les interaccions entre només 43 proteïnes i 40 metabòlits (a la dreta); les seqüències genòmiques ofereixen llistes de fins a 45.000 gens.[117] Tanmateix, actualment és possible utilitzar aquestes dades genòmiques per reconstruir xarxes senceres de reaccions bioquímiques i produir models matemàtics més holístics que puguin explicar i predir-ne el comportament.[118] Aquests models són especialment útils quan se'ls utilitza per integrar les dades sobre les rutes i els metabòlits obtingudes pels mètodes clàssics amb les dades sobre l'expressió gènica obtingudes mitjançant estudis de proteòmica i xips d'ADN.[119] Utilitzant aquestes tècniques, s'ha creat un model del metabolisme humà, que guiarà la recerca farmacològica i bioquímica del futur.[120] Aquests models estan sent utilitzats actualment en anàlisi de xarxes per classificar les malalties humanes en grups que comparteixin proteïnes o metabòlits comuns.[121][122]
Un dels principals usos tecnològics d'aquesta informació és l'enginyeria metabòlica. Organismes com ara llevats, plantes o bacteris són genèticament modificats per fer-los més útils en biotecnologia i contribuir a la producció de medicaments com ara antibiòtics o productes químics industrials com ara l'1,3-propanediol o l'àcid siquímic.[123] Aquestes modificacions solen tenir com a objectiu la reducció de la quantitat d'energia utilitzada per produir el producte, l'augment del rendiment i la disminució dels residus produïts.[124]
Història
[modifica]
El terme "metabolisme" deriva del grec Μεταβολισμός – metabolismós, que significa 'canvi', o 'enderrocament'.[125] La història de l'estudi científic del metabolisme abasta diversos segles i ha passat de l'examinació d'animals sencers en estudis inicials a l'examinació de reaccions metabòliques individuals en la bioquímica moderna. El concepte de metabolisme es remunta a Ibn an-Nafís (1213-1288), que afirmà que "el cos i les seves parts estan en un estat constant de dissolució i nutrició, de manera que inevitablement experimenten un canvi permanent."[126] Els primers experiments controlats sobre el metabolisme humà foren publicats per Santorio Santorio el 1614, a la seva obra Ars de statica medecina.[127] Descrigué com es pesava abans i després de menjar, dormir, treballar, mantenir relacions sexuals, fer dejuni, beure i excrementar. Descobrí que la majoria d'aliments que ingeria desapareixien en el que ell anomenà "perspiració insensible".
En aquests primers estudis, els mecanismes que regien aquests processos metabòlics no havien sigut identificats, i es creia que una força vital animava els teixits vivents.[128] Al segle xix, mentre estudiava la fermentació del sucre en alcohol pel llevat, Louis Pasteur arribà a la conclusió que la fermentació era catalitzada per substàncies de les cèl·lules del llevat que anomenà "ferments". Escrigué que "la fermentació alcohòlica és un acte correlacionat amb la vida i l'organització de les cèl·lules del llevat, no amb la mort o putrefacció de les cèl·lules."[129] Aquest descobriment, juntament amb la publicació el 1828 per part de Fiedrich Wöhler la síntesi química d'urea,[130] demostrà que els compostos orgànics i les reaccions químiques de les cèl·lules no presentaven cap diferència en principi respecte a la resta de processos químics.
Fou el descobriment dels enzims a principis del segle XX per part d'Eduard Buchner el que separà l'estudi de les reaccions químiques del metabolisme de l'estudi biològic de les cèl·lules, i marcà els inicis de la bioquímica;[131] en aquests primers anys el coneixement de la bioquímica augmentà ràpidament. Un dels més prolífics d'aquests bioquímics moderns fou Krebs, que feu grans contribucions a l'estudi del metabolisme.[132] Descobrí el cicle de la urea i més endavant, treballant amb Hans Kornberg, el cicle de Krebs i el cicle del glioxilat.[133][62] La investigació bioquímica moderna ha estat impulsada pel desenvolupament de noves tècniques com ara la cromatografia, la difracció de rajos X, l'espectroscòpia NMR, l'etiquetatge radioisotòpic, la microscòpia electrònica i les simulacions de dinàmica molecular. Aquestes tècniques han permès el descobriment i l'anàlisi de detallada de moltes molècules i rutes metabòliques de les cèl·lules.
Referències
[modifica]- ↑ 1,0 1,1 Friedrich C. «Physiology and genetics of sulfur-oxidizing bacteria». Adv Microb Physiol, 39, 1998, pàg. 235–89. DOI: 10.1016/S0065-2911(08)60018-1. PMID: 9328649.
- ↑ 2,0 2,1 Smith E., Morowitz H. «Universality in intermediary metabolism». Proc Natl Acad Sci USA, 101, 36, 2004, pàg. 13168–73. DOI: 10.1073/pnas.0404922101. PMID: 15340153.
- ↑ 3,0 3,1 Ebenhöh O., Heinrich R. «Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems». Bull Math Biol, 63, 1, 2001, pàg. 21–55. DOI: 10.1006/bulm.2000.0197. PMID: 11146883.
- ↑ 4,0 4,1 Meléndez-Hevia E., Waddell T., Cascante M. «The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution». J Mol Evol, 43, 3, 1996, pàg. 293–303. DOI: 10.1007/BF02338838. PMID: 8703096.
- ↑ Michie K., Löwe J. «Dynamic filaments of the bacterial cytoskeleton». Annu Rev Biochem, 75, 2006, pàg. 467–92. DOI: 10.1146/annurev.biochem.75.103004.142452. PMID: 16756499.
- ↑ 6,0 6,1 6,2 6,3 6,4 Nelson, David L.; Michael M. Cox. Lehninger Principles of Biochemistry. Nova York: W. H. Freeman and company, 2005, p. 841. ISBN 0-7167-4339-6.
- ↑ Fahy E, Subramaniam S., Brown H., Glass C., Merrill A., Murphy R., Raetz C., Russell D., Seyama Y., Shaw W., Shimizu T., Spener F., van Meer G., VanNieuwenhze M., White S., Witztum J., Dennis E. «A comprehensive classification system for lipids». J Lipid Res, 46, 5, 2005, pàg. 839–61. Arxivat de l'original el 2010-08-24. DOI: 10.1194/jlr.E400004-JLR200. PMID: 15722563 [Consulta: 26 octubre 2008]. Arxivat 2010-08-24 a Wayback Machine.
- ↑ «Nomenclature of Lipids». IUPAC-IUB Commission on Biochemical Nomenclature (CBN). [Consulta: 20 agost 2007].
- ↑ Hegardt F. «Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis». Biochem J, 338 (Pt 3), 1999, pàg. 569–82. DOI: 10.1042/0264-6021:3380569. PMID: 10051425.
- ↑ Raman R., Raguram S., Venkataraman G., Paulson J., Sasisekharan R. «Glycomics: an integrated systems approach to structure-function relationships of glycans». Nat Methods, 2, 11, 2005, pàg. 817–24. DOI: 10.1038/nmeth807. PMID: 16278650.
- ↑ Sierra S., Kupfer B., Kaiser R. «Basics of the virology of HIV-1 and its replication». J Clin Virol, 34, 4, 2005, pàg. 233–44. DOI: 10.1016/j.jcv.2005.09.004. PMID: 16198625.
- ↑ 12,0 12,1 Wimmer M., Rose «Mechanisms of enzyme-catalyzed group transfer reactions». Annu Rev Biochem, 47, 1978, pàg. 1031–78. DOI: 10.1146/annurev.bi.47.070178.005123. PMID: 354490.
- ↑ Mitchell P. «The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems». Eur J Biochem, 95, 1, 1979, pàg. 1–20. DOI: 10.1111/j.1432-1033.1979.tb12934.x. PMID: 378655.
- ↑ 14,0 14,1 14,2 14,3 Dimroth P., von Ballmoos C., Meier T. «Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series». EMBO Rep, 7, 3, 2006, pàg. 276–82. DOI: 10.1038/sj.embor.7400646. PMID: 16607397.
- ↑ Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini. Stanford School of Medicine Nutrition Courses. SUMMIT, 2006. «Nutrition Principles and Clinical Nutrition»
- ↑ Pollak N., Dölle C., Ziegler M. «The power to reduce: pyridine nucleotides—small molecules with a multitude of functions». Biochem J, 402, 2, 2007, pàg. 205–18. DOI: 10.1042/BJ20061638. PMID: 17295611.
- ↑ 17,0 17,1 Heymsfield S., Waki M., Kehayias J., Lichtman S., Dilmanian F., Kamen Y., Wang J., Pierson R. «Chemical and elemental analysis of humans in vivo using improved body composition models». Am J Physiol, 261, 2 Pt 1, 1991, pàg. E190–8. PMID: 1872381.
- ↑ Sychrová H. «Yeast as a model organism to study transport and homeostasis of alkali metal cations». Physiol Res, 53 Suppl 1, 2004, pàg. S91–8. PMID: 15119939.
- ↑ Levitan «Modulation of ion channels in neurons and other cells». Annu Rev Neurosci, 11, 1988, pàg. 119–36. DOI: 10.1146/annurev.ne.11.030188.001003. PMID: 2452594.
- ↑ Dulhunty A. «Excitation-contraction coupling from the 1950s into the new millennium». Clin Exp Pharmacol Physiol, 33, 9, 2006, pàg. 763–72. DOI: 10.1111/j.1440-1681.2006.04441.x. PMID: 16922804.
- ↑ Mahan D., Shields R. «Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight». J Anim Sci, 76, 2, 1998, pàg. 506–12. Arxivat de l'original el 2011-04-30. PMID: 9498359 [Consulta: 1r novembre 2008]. Arxivat 2011-04-30 a Wayback Machine.
- ↑ Husted S., Mikkelsen B., Jensen J., Nielsen N. «Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics». Anal Bioanal Chem, 378, 1, 2004, pàg. 171–82. DOI: 10.1007/s00216-003-2219-0. PMID: 14551660.
- ↑ Finney L., O'Halloran T. «Transition metal speciation in the cell: insights from the chemistry of metal ion receptors». Science, 300, 5621, 2003, pàg. 931–6. DOI: 10.1126/science.1085049. PMID: 12738850.
- ↑ Cousins R., Liuzzi J., Lichten L. «Mammalian zinc transport, trafficking, and signals». J Biol Chem, 281, 34, 2006, pàg. 24085–9. Arxivat de l'original el 2008-11-05. DOI: 10.1074/jbc.R600011200. PMID: 16793761 [Consulta: 1r novembre 2008]. Arxivat 2008-11-05 a Wayback Machine.
- ↑ Dunn L., Rahmanto Y., Richardson D. «Iron uptake and metabolism in the new millennium». Trends Cell Biol, 17, 2, 2007, pàg. 93–100. DOI: 10.1016/j.tcb.2006.12.003. PMID: 17194590.
- ↑ Nealson K., Conrad P. «Life: past, present and future». Philos Trans R Soc Lond B Biol Sci, 354, 1392, 1999, pàg. 1923–39. DOI: 10.1098/rstb.1999.0532. PMID: 10670014.
- ↑ Nelson N., Ben-Shem A. «The complex architecture of oxygenic photosynthesis». Nat Rev Mol Cell Biol, 5, 12, 2004, pàg. 971–82. DOI: 10.1038/nrm1525. PMID: 15573135.
- ↑ Häse C., Finkelstein R. «Bacterial extracel·lular zinc-containing metalloproteases». Microbiol Rev, 57, 4, 1993, pàg. 823–37. PMID: 8302217.
- ↑ Gupta R., Gupta N., Rathi P. «Bacterial lipases: an overview of production, purification and biochemical properties». Appl Microbiol Biotechnol, 64, 6, 2004, pàg. 763–81. DOI: 10.1007/s00253-004-1568-8. PMID: 14966663.
- ↑ Hoyle T. «The digestive system: linking theory and practice». Br J Nurs, 6, 22, 1997, pàg. 1285–91. PMID: 9470654.
- ↑ Souba W., Pacitti A. «How amino acids get into cells: mechanisms, models, menus, and mediators». JPEN J Parenter Enteral Nutr, 16, 6, 1992, pàg. 569–78. DOI: 10.1177/0148607192016006569. PMID: 1494216.
- ↑ Barrett M., Walmsley A., Gould G. «Structure and function of facilitative sugar transporters». Curr Opin Cell Biol, 11, 4, 1999, pàg. 496–502. DOI: 10.1016/S0955-0674(99)80072-6. PMID: 10449337.
- ↑ Bell G., Burant C., Takeda J., Gould G. «Structure and function of mammalian facilitative sugar transporters». J Biol Chem, 268, 26, 1993, pàg. 19161–4. PMID: 8366068.
- ↑ 34,0 34,1 Bouché C., Serdy S., Kahn C., Goldfine A. «The cellular fate of glucose and its relevance in type 2 diabetes». Endocr Rev, 25, 5, 2004, pàg. 807–30. Arxivat de l'original el 2012-12-04. DOI: 10.1210/er.2003-0026. PMID: 15466941 [Consulta: 1r novembre 2008].
- ↑ Sakami W., Harrington H. «Amino acid metabolism». Annu Rev Biochem, 32, 1963, pàg. 355–98. DOI: 10.1146/annurev.bi.32.070163.002035. PMID: 14144484.
- ↑ Brosnan J. «Glutamate, at the interface between amino acid and carbohydrate metabolism». J Nutr, 130, 4S Suppl, 2000, pàg. 988S–90S. PMID: 10736367.
- ↑ Young V., Ajami A. «Glutamine: the emperor or his clothes?». J Nutr, 131, 9 Suppl, 2001, pàg. 2449S–59S; discussion 2486S–7S. PMID: 11533293.
- ↑ Hosler J., Ferguson-Miller S., Mills D. «Energy transduction: proton transfer through the respiratory complexes». Annu Rev Biochem, 75, 2006, pàg. 165–87. DOI: 10.1146/annurev.biochem.75.062003.101730. PMID: 16756489.
- ↑ Schultz B., Chan S. «Structures and proton-pumping strategies of mitochondrial respiratory enzymes». Annu Rev Biophys Biomol Struct, 30, 2001, pàg. 23–65. DOI: 10.1146/annurev.biophys.30.1.23. PMID: 11340051.
- ↑ Capaldi R., Aggeler R. «Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor». Trends Biochem Sci, 27, 3, 2002, pàg. 154–60. DOI: 10.1016/S0968-0004(01)02051-5. PMID: 11893513.
- ↑ Friedrich B., Schwartz E. «Molecular biology of hydrogen utilization in aerobic chemolithotrophs». Annu Rev Microbiol, 47, 1993, pàg. 351–83. DOI: 10.1146/annurev.mi.47.100193.002031. PMID: 8257102.
- ↑ Weber K., Achenbach L., Coates J. «Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction». Nat Rev Microbiol, 4, 10, 2006, pàg. 752–64. DOI: 10.1038/nrmicro1490. PMID: 16980937.
- ↑ Jetten M., Strous M., van de Pas-Schoonen K., Schalk J., van Dongen U., van de Graaf A., Logemann S., Muyzer G., van Loosdrecht M., Kuenen J. «The anaerobic oxidation of ammonium». FEMS Microbiol Rev, 22, 5, 1998, pàg. 421–37. DOI: 10.1111/j.1574-6976.1998.tb00379.x. PMID: 9990725.
- ↑ Simon J. «Enzymology and bioenergetics of respiratory nitrite ammonification». FEMS Microbiol Rev, 26, 3, 2002, pàg. 285–309. DOI: 10.1111/j.1574-6976.2002.tb00616.x. PMID: 12165429.
- ↑ Conrad R. «Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)». Microbiol Rev, 60, 4, 1996, pàg. 609–40. PMID: 8987358.
- ↑ Barea J., Pozo M., Azcón R., Azcón-Aguilar C. «Microbial co-operation in the rhizosphere». J Exp Bot, 56, 417, 2005, pàg. 1761–78. DOI: 10.1093/jxb/eri197. PMID: 15911555.
- ↑ van der Meer M., Schouten S., Bateson M., Nübel U., Wieland A., Kühl M., de Leeuw J., Sinninghe Damsté J., Ward D. «Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park». Appl Environ Microbiol, 71, 7, 2005, pàg. 3978–86. DOI: 10.1128/AEM.71.7.3978-3986.2005. PMID: 16000812.
- ↑ Tichi M., Tabita F. «Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism». J Bacteriol, 183, 21, 2001, pàg. 6344–54. DOI: 10.1128/JB.183.21.6344-6354.2001. PMID: 11591679.
- ↑ Allen J., Williams J. «Photosynthetic reaction centers». FEBS Lett, 438, 1–2, 1998, pàg. 5–9. DOI: 10.1016/S0014-5793(98)01245-9. PMID: 9821949.
- ↑ Nelson N., Ben-Shem A. «The complex architecture of oxygenic photosynthesis». Nat Rev Mol Cell Biol, 5, 12, 2004, pàg. 971–82. DOI: 10.1038/nrm1525. PMID: 15573135.
- ↑ Munekage Y., Hashimoto M., Miyake C., Tomizawa K., Endo T., Tasaka M., Shikanai T. «Cyclic electron flow around photosystem i is essential for photosynthesis». Nature, 429, 6991, 2004, pàg. 579–82. DOI: 10.1038/nature02598. PMID: 15175756.
- ↑ Miziorko H., Lorimer G. «Ribulose-1,5-bisphosphate carboxylase-oxygenase». Annu Rev Biochem, 52, 1983, pàg. 507–35. DOI: 10.1146/annurev.bi.52.070183.002451. PMID: 6351728.
- ↑ Dodd A., Borland A., Haslam R., Griffiths H., Maxwell K. «Crassulacean acid metabolism: plastic, fantastic». J Exp Bot, 53, 369, 2002, pàg. 569–80. DOI: 10.1093/jexbot/53.369.569. PMID: 11886877.
- ↑ Hügler M., Wirsen C., Fuchs G., Taylor C., Sievert S. «Evidence for autotrophic CO₂ fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria». J Bacteriol, 187, 9, 2005, pàg. 3020–7. DOI: 10.1128/JB.187.9.3020-3027.2005. PMID: 15838028.
- ↑ Strauss G., Fuchs G. «Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle». Eur J Biochem, 215, 3, 1993, pàg. 633–43. DOI: 10.1111/j.1432-1033.1993.tb18074.x. PMID: 8354269.
- ↑ Wood H. «Life with CO or CO2 and H2 as a source of carbon and energy». Faseb J, 5, 2, 1991, pàg. 156–63. PMID: 1900793.
- ↑ Shively J., van Keulen G., Meijer W. «Something from almost nothing: carbon dioxide fixation in chemoautotrophs». Annu Rev Microbiol, 52, 1998, pàg. 191–230. DOI: 10.1146/annurev.micro.52.1.191. PMID: 9891798.
- ↑ Boiteux A., Hess B. «Design of glycolysis». Philos Trans R Soc Lond B Biol Sci, 293, 1063, 1981, pàg. 5–22. DOI: 10.1098/rstb.1981.0056. PMID: 6115423.
- ↑ Pilkis S, el-Maghrabi M, Claus T «Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics». Diabetes Care, 13, 6, 1990, pàg. 582–99. DOI: 10.2337/diacare.13.6.582. PMID: 2162755.
- ↑ 60,0 60,1 Ensign S. «Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation». Mol Microbiol, 61, 2, 2006, pàg. 274–6. DOI: 10.1111/j.1365-2958.2006.05247.x. PMID: 16856935.
- ↑ Finn P., Dice J. «Proteolytic and lipolytic responses to starvation». Nutrition, 22, 7–8, 2006, pàg. 830–44. DOI: 10.1016/j.nut.2006.04.008. PMID: 16815497.
- ↑ 62,0 62,1 Kornberg H., Krebs H. «Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle». Nature, 179, 4568, 1957, pàg. 988–91. DOI: 10.1038/179988a0. PMID: 13430766.
- ↑ Rademacher T., Parekh R., Dwek R. «Glycobiology». Annu Rev Biochem, 57, 1988, pàg. 785–838. DOI: 10.1146/annurev.bi.57.070188.004033. PMID: 3052290.
- ↑ Opdenakker G., Rudd P., Ponting C., Dwek R. «Concepts and principles of glycobiology». Faseb J, 7, 14, 1993, pàg. 1330–7. PMID: 8224606.
- ↑ McConville M, Menon A «Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)». Mol Membr Biol, 17, 1, 2000, pàg. 1–16. DOI: 10.1080/096876800294443. PMID: 10824734.
- ↑ Chirala S., Wakil S. «Structure and function of animal fatty acid synthase». Lipids, 39, 11, 2004, pàg. 1045–53. DOI: 10.1007/s11745-004-1329-9. PMID: 15726818.
- ↑ White S., Zheng J., Zhang Y. «The structural biology of type II fatty acid biosynthesis». Annu Rev Biochem, 74, 2005, pàg. 791–831. DOI: 10.1146/annurev.biochem.74.082803.133524. PMID: 15952903.
- ↑ Ohlrogge J., Jaworski J. «Regulation of fatty acid synthesis». Annu Rev Plant Physiol Plant Mol Biol, 48, 1997, pàg. 109–136. DOI: 10.1146/annurev.arplant.48.1.109. PMID: 15012259.
- ↑ Dubey V., Bhalla R., Luthra R. «An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants». J Biosci, 28, 5, 2003, pàg. 637–46. DOI: 10.1007/BF02703339. PMID: 14517367.
- ↑ 70,0 70,1 Kuzuyama T., Seto H. «Diversity of the biosynthesis of the isoprene units». Nat Prod Rep, 20, 2, 2003, pàg. 171–83. DOI: 10.1039/b109860h. PMID: 12735695.
- ↑ Grochowski L., Xu H., White R. «Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate». J Bacteriol, 188, 9, 2006, pàg. 3192–8. DOI: 10.1128/JB.188.9.3192-3198.2006. PMID: 16621811.
- ↑ Lichtenthaler H. «The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants». Annu Rev Plant Physiol Plant Mol Biol, 50, 1999, pàg. 47–65. DOI: 10.1146/annurev.arplant.50.1.47. PMID: 15012203.
- ↑ 73,0 73,1 Schroepfer G. «Sterol biosynthesis». Annu Rev Biochem, 50, 1981, pàg. 585–621. DOI: 10.1146/annurev.bi.50.070181.003101. PMID: 7023367.
- ↑ Lees N., Skaggs B., Kirsch D., Bard M. «Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review». Lipids, 30, 3, 1995, pàg. 221–6. DOI: 10.1007/BF02537824. PMID: 7791529.
- ↑ Guyton, Arthur C.; John E. Hall. Textbook of Medical Physiology. Philadelphia: Elsevier, 2006, p. 855–6. ISBN 0-7216-0240-1.
- ↑ Ibba M., Söll D. «The renaissance of aminoacyl-tRNA synthesis». EMBO Rep, 2, 5, 2001, pàg. 382-7. PMID: 11375928.
- ↑ Lengyel P., Söll D. «Mechanism of protein biosynthesis». Bacteriol Rev, 33, 2, 1969, pàg. 264–301. PMID: 4896351.
- ↑ 78,0 78,1 Rudolph F. «The biochemistry and physiology of nucleotides». J Nutr, 124, 1 Suppl, 1994, pàg. 124S–127S. PMID: 8283301. Zrenner R., Stitt M., Sonnewald U., Boldt R. «Pyrimidine and purine biosynthesis and degradation in plants». Annu Rev Plant Biol, 57, 2006, pàg. 805–36. DOI: 10.1146/annurev.arplant.57.032905.105421. PMID: 16669783.
- ↑ Stasolla C., Katahira R., Thorpe T., Ashihara H. «Purine and pyrimidine nucleotide metabolism in higher plants». J Plant Physiol, 160, 11, 2003, pàg. 1271–95. DOI: 10.1078/0176-1617-01169. PMID: 14658380.
- ↑ Smith J. «Enzymes of nucleotide synthesis». Curr Opin Struct Biol, 5, 6, 1995, pàg. 752–7. DOI: 10.1016/0959-440X(95)80007-7. PMID: 8749362.
- ↑ Testa B., Krämer S. «The biochemistry of drug metabolism—an introduction: part 1. Principles and overview». Chem Biodivers, 3, 10, 2006, pàg. 1053–101. DOI: 10.1002/cbdv.200690111. PMID: 17193224.
- ↑ Danielson P. «The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans». Curr Drug Metab, 3, 6, 2002, pàg. 561–97. DOI: 10.2174/1389200023337054. PMID: 12369887.
- ↑ King C., Rios G., Green M., Tephly T. «UDP-glucuronosyltransferases». Curr Drug Metab, 1, 2, 2000, pàg. 143–61. DOI: 10.2174/1389200003339171. PMID: 11465080.
- ↑ Sheehan D., Meade G., Foley V., Dowd C. «Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily». Biochem J, 360, Pt 1, 2001, pàg. 1–16. DOI: 10.1042/0264-6021:3600001. PMID: 11695986.
- ↑ Galvão T., Mohn W., de Lorenzo V. «Exploring the microbial biodegradation and biotransformation gene pool». Trends Biotechnol, 23, 10, 2005, pàg. 497–506. DOI: 10.1016/j.tibtech.2005.08.002. PMID: 16125262.
- ↑ Janssen D., Dinkla I., Poelarends G., Terpstra P. «Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities». Environ Microbiol, 7, 12, 2005, pàg. 1868–82. DOI: 10.1111/j.1462-2920.2005.00966.x. PMID: 16309386.
- ↑ Davies K. «Oxidative stress: the paradox of aerobic life». Biochem Soc Symp, 61, 1995, pàg. 1–31. PMID: 8660387.
- ↑ Tu B., Weissman J. «Oxidative protein folding in eukaryotes: mechanisms and consequences». J Cell Biol, 164, 3, 2004, pàg. 341–6. DOI: 10.1083/jcb.200311055. PMID: 14757749.
- ↑ Sies H. «Oxidative stress: oxidants and antioxidants». Exp Physiol, 82, 2, 1997, pàg. 291–5. PMID: 9129943.
- ↑ Vertuani S., Angusti A., Manfredini S. «The antioxidants and pro-antioxidants network: an overview». Curr Pharm Des, 10, 14, 2004, pàg. 1677–94. DOI: 10.2174/1381612043384655. PMID: 15134565.
- ↑ von Stockar U., Liu J. «Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth». Biochim Biophys Acta, 1412, 3, 1999, pàg. 191–211. DOI: 10.1016/S0005-2728(99)00065-1. PMID: 10482783.
- ↑ Demirel Y., Sandler S. «Thermodynamics and bioenergetics». Biophys Chem, 97, 2–3, 2002, pàg. 87–111. DOI: 10.1016/S0301-4622(02)00069-8. PMID: 12050002.
- ↑ Albert R. «Scale-free networks in cell biology». J Cell Sci, 118, Pt 21, 2005, pàg. 4947–57. DOI: 10.1242/jcs.02714. PMID: 16254242.
- ↑ Brand M. «Regulation analysis of energy metabolism». J Exp Biol, 200, Pt 2, 1997, pàg. 193–202. PMID: 9050227.
- ↑ Soyer O., Salathé M., Bonhoeffer S. «Signal transduction networks: topology, response and biochemical processes». J Theor Biol, 238, 2, 2006, pàg. 416–25. PMID: 16045939.
- ↑ 96,0 96,1 Salter M., Knowles R., Pogson C. «Metabolic control». Essays Biochem, 28, 1994, pàg. 1–12. PMID: 7925313.
- ↑ Westerhoff H., Groen A., Wanders R. «Modern theories of metabolic control and their applications (review)». Biosci Rep, 4, 1, 1984, pàg. 1–22. DOI: 10.1007/BF01120819. PMID: 6365197.
- ↑ Fell D, Thomas S «Physiological control of metabolic flux: the requirement for multisite modulation». Biochem J, 311 (Pt 1), 1995, pàg. 35–9. PMID: 7575476.
- ↑ Hendrickson W «Transduction of biochemical signals across cell membranes». Q Rev Biophys, 38, 4, 2005, pàg. 321–30. DOI: 10.1017/S0033583506004136. PMID: 16600054.
- ↑ Cohen P. «The regulation of protein function by multisite phosphorylation—a 25 year update». Trends Biochem Sci, 25, 12, 2000, pàg. 596–601. DOI: 10.1016/S0968-0004(00)01712-6. PMID: 11116185.
- ↑ Lienhard G, Slot J, James D, Mueckler M «How cells absorb glucose». Sci Am, 266, 1, 1992, pàg. 86–91. PMID: 1734513.
- ↑ Roach P. «Glycogen and its metabolism». Curr Mol Med, 2, 2, 2002, pàg. 101–20. DOI: 10.2174/1566524024605761. PMID: 11949930.
- ↑ Newgard C., Brady M., O'Doherty R., Saltiel A. «Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1». Diabetes, 49, 12, 2000, pàg. 1967–77. DOI: 10.2337/diabetes.49.12.1967. PMID: 11117996.
- ↑ Romano A., Conway T. «Evolution of carbohydrate metabolic pathways». Res Microbiol, 147, 6–7, 1996, pàg. 448–55. DOI: 10.1016/0923-2508(96)83998-2. PMID: 9084754.
- ↑ Koch A. «How did bacteria come to be?». Adv Microb Physiol, 40, 1998, pàg. 353–99. DOI: 10.1016/S0065-2911(08)60135-6. PMID: 9889982.
- ↑ Ouzounis C., Kyrpides N. «The emergence of major cellular processes in evolution». FEBS Lett, 390, 2, 1996, pàg. 119–23. DOI: 10.1016/0014-5793(96)00631-X. PMID: 8706840.
- ↑ Caetano-Anolles G., Kim H. S., Mittenthal J. E. «The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture». Proc Natl Acad Sci USA, 104, 22, 2007, pàg. 9358–63. DOI: 10.1073/pnas.0701214104. PMID: 17517598.
- ↑ Schmidt S., Sunyaev S., Bork P., Dandekar T. «Metabolites: a helping hand for pathway evolution?». Trends Biochem Sci, 28, 6, 2003, pàg. 336–41. DOI: 10.1016/S0968-0004(03)00114-2. PMID: 12826406.
- ↑ Light S., Kraulis P. «Network analysis of metabolic enzyme evolution in Escherichia coli». BMC Bioinformatics, 5, 2004, pàg. 15. DOI: 10.1186/1471-2105-5-15. PMID: 15113413. Alves R., Chaleil R., Sternberg M. «Evolution of enzymes in metabolism: a network perspective». J Mol Biol, 320, 4, 2002, pàg. 751–70. DOI: 10.1016/S0022-2836(02)00546-6. PMID: 12095253.
- ↑ Kim H. S., Mittenthal J. E., Caetano-Anolles G. «MANET: tracing evolution of protein architecture in metabolic networks». BMC Bioinformatics, 19, 7, 2006, pàg. 351. DOI: 10.1186/1471-2105-7-351. PMID: 16854231.
- ↑ Teichmann S. A., Rison S. C., Thornton J. M., Riley M., Gough J., Chothia C «Small-molecule metabolism: an enzyme mosaic». Trends Biotechnol, 19, 12, 2001, pàg. 482–6. DOI: 10.1016/S0167-7799(01)01813-3. PMID: 11711174.
- ↑ Spirin V., Gelfand M., Mironov A., Mirny L. «A metabolic network in the evolutionary context: multiscale structure and modularity». Proc Natl Acad Sci USA, 103, 23, 2006, pàg. 8774–9. DOI: 10.1073/pnas.0510258103. PMID: 16731630.
- ↑ Lawrence J. «Common themes in the genome strategies of pathogens». Curr Opin Genet Dev, 15, 6, 2005, pàg. 584–8. DOI: 10.1016/j.gde.2005.09.007. PMID: 16188434. Wernegreen J «For better or worse: genomic consequences of intracellular mutualism and parasitism». Curr Opin Genet Dev, 15, 6, 2005, pàg. 572–83. DOI: 10.1016/j.gde.2005.09.013. PMID: 16230003.
- ↑ Pál C., Papp B., Lercher M., Csermely P., Oliver S., Hurst L. «Chance and necessity in the evolution of minimal metabolic networks». Nature, 440, 7084, 2006, pàg. 667–70. DOI: 10.1038/nature04568. PMID: 16572170.
- ↑ Rennie M. «An introduction to the use of tracers in nutrition and metabolism». Proc Nutr Soc, 58, 4, 1999, pàg. 935–44. DOI: 10.1017/S002966519900124X. PMID: 10817161.
- ↑ Phair R. «Development of kinetic models in the nonlinear world of molecular cell biology». Metabolism, 46, 12, 1997, pàg. 1489–95. DOI: 10.1016/S0026-0495(97)90154-2. PMID: 9439549.
- ↑ Sterck L., Rombauts S., Vandepoele K., Rouzé P., Van de Peer Y. «How many genes are there in plants (... and why are they there)?». Curr Opin Plant Biol, 10, 2, 2007, pàg. 199–203. DOI: 10.1016/j.pbi.2007.01.004. PMID: 17289424.
- ↑ Borodina I., Nielsen J. «From genomes to in silico cells via metabolic networks». Curr Opin Biotechnol, 16, 3, 2005, pàg. 350–5. DOI: 10.1016/j.copbio.2005.04.008. PMID: 15961036.
- ↑ Gianchandani E., Brautigan D., Papin J. «Systems analyses characterize integrated functions of biochemical networks». Trends Biochem Sci, 31, 5, 2006, pàg. 284–91. DOI: 10.1016/j.tibs.2006.03.007. PMID: 16616498.
- ↑ Duarte N. C., Becker S. A., Jamshidi N. i cols «Global reconstruction of the human metabolic network based on genomic and bibliomic data». Proc. Natl. Acad. Sci. U.S.A., 104, 6, Febrer 2007, pàg. 1777–82. DOI: 10.1073/pnas.0610772104. PMID: 17267599.
- ↑ Goh K. I., Cusick M. E., Valle D., Childs B., Vidal M., Barabási A. L. «The human disease network». Proc. Natl. Acad. Sci. U.S.A., 104, 21, maig 2007, pàg. 8685–90. DOI: 10.1073/pnas.0701361104. PMC: 1885563. PMID: 17502601.
- ↑ Lee D. S., Park J., Kay K. A., Christakis N. A., Oltvai Z. N., Barabási A. L. «The implications of human metabolic network topology for disease comorbidity». Proc. Natl. Acad. Sci. U.S.A., 105, 29, juliol 2008, pàg. 9880–9885. DOI: 10.1073/pnas.0802208105. PMID: 18599447.
- ↑ Thykaer J., Nielsen J. «Metabolic engineering of beta-lactam production». Metab Eng, 5, 1, 2003, pàg. 56–69. DOI: 10.1016/S1096-7176(03)00003-X. PMID: 12749845. González-Pajuelo M., Meynial-Salles I., Mendes F., Andrade J., Vasconcelos I., Soucaille P. «Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol». Metab Eng, 7, 5–6, 2005, pàg. 329–36. DOI: 10.1016/j.ymben.2005.06.001. PMID: 16095939. Krämer M., Bongaerts J., Bovenberg R., Kremer S., Müller U., Orf S., Wubbolts M., Raeven L. «Metabolic engineering for microbial production of shikimic acid». Metab Eng, 5, 4, 2003, pàg. 277–83. DOI: 10.1016/j.ymben.2003.09.001. PMID: 14642355.
- ↑ Koffas M., Roberge C., Lee K., Stephanopoulos G. «Metabolic engineering». Annu Rev Biomed Eng, 1, 1999, pàg. 535–57. DOI: 10.1146/annurev.bioeng.1.1.535. PMID: 11701499.
- ↑ «Metabolism». The Online Etymology Dictionary. [Consulta: 20 febrer 2007].
- ↑ Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (v. Ibnul-Nafees As a Philosopher, Encyclopedia of Islamic World ).
- ↑ Eknoyan G. «Santorio Sanctorius (1561–1636) - founding father of metabolic balance studies». Am J Nephrol, 19, 2, 1999, pàg. 226–33. DOI: 10.1159/000013455. PMID: 10213823.
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volum IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (Nova York) Consultat el 16 de març del 2003
- ↑ Dubos J. «Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822 – 1895)—chance and the prepared mind». Trends Biotechnol, 13, 12, 1951, pàg. 511–515. DOI: 10.1016/S0167-7799(00)89014-9. PMID: 8595136.
- ↑ Kinne-Saffran E., Kinne R. «Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs». Am J Nephrol, 19, 2, 1999, pàg. 290–4. DOI: 10.1159/000013463. PMID: 10213830.
- ↑ Discurs del Premi Nobel d'Eduard Buchner (1907) a http://nobelprize.org Consultat el 20-03-2007
- ↑ Kornberg H. «Krebs and his trinity of cycles». Nat Rev Mol Cell Biol, 1, 3, 2000, pàg. 225–8. DOI: 10.1038/35043073. PMID: 11252898.
- ↑ Krebs H. A., Henseleit K. (1932). "Untersuchungen über die Harnstoffbildung im tierkorper." Z. Physiol. Chem. 210, 33-66. Krebs H., Johnson W. «Metabolism of ketonic acids in animal tissues». Biochem J, 31, 4, 1937, pàg. 645–60. PMID: 16746382.
Bibliografia
[modifica]- Bibliografia general
- Rose, S. i Mileusnic, R., The Chemistry of Life. (Penguin Press Science, 1999), ISBN 0-14-027273-9
- Schneider, E. D. i Sagan, D., Into the Cool: Energy Flow, Thermodynamics, and Life. (University Of Chicago Press, 2005), ISBN 0-226-73936-8
- Lane, N., Oxygen: The Molecule that Made the World. (Oxford University Press, USA, 2004), ISBN 0-19-860783-0
- Bibliografia avançada
- Price, N. i Stevens, L., Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press, 1999), ISBN 0-19-850229-X
- Berg, J., Tymoczko, J. i Stryer, L., Biochemistry. (W. H. Freeman and Company, 2002), ISBN 0-7167-4955-6
- Cox, M. i Nelson, D. L., Lehninger Principles of Biochemistry. (Palgrave Macmillan, 2004), ISBN 0-7167-4339-6
- Brock, T. D., Madigan, M. T., Martinko, J. i Parker J., Brock's Biology of Microorganisms. (Benjamin Cummings, 2002), ISBN 0-13-066271-2
- Da Silva, J.J.R.F. i Williams, R. J. P., The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press, 1991), ISBN 0-19-855598-9
- Nicholls, D. G. i Ferguson, S. J., Bioenergetics. (Academic Press Inc., 2002), ISBN 0-12-518121-3
