Catàlisi
La catàlisi és l'augment de la velocitat d'una reacció química a causa d'una substància afegida coneguda com a catalitzador.[1][2] Els catalitzadors no es consumeixen per la reacció i romanen sense canvis després d'aquesta.[3] Si la reacció és ràpida i el catalitzador es recicla ràpidament, sovint n'hi ha prou amb quantitats molt petites de catalitzador;[4] la barreja, la superfície i la temperatura són factors importants en la velocitat de reacció. Els catalitzadors generalment reaccionen amb un o més reactius per formar intermedis que posteriorment donen el producte de reacció final, en el procés de regeneració del catalitzador.
L'augment de velocitat es produeix perquè el catalitzador permet que la reacció es produeixi mitjançant un mecanisme alternatiu que pot ser molt més ràpid que el mecanisme no catalitzat. Tanmateix, el mecanisme no catalitzat segueix sent possible, de manera que la velocitat total (catalitzada més no catalitzada) només pot augmentar en presència del catalitzador i mai disminuir.[5] La catàlisi es pot classificar com a homogènia, els components de la qual es troben dispersos en la mateixa fase (generalment gasosa o líquida) que el reactiu, o bé heterogènia, els components de la qual no es troben en la mateixa fase. Els enzims i altres biocatalitzadors sovint es consideren una tercera categoria.
La catàlisi és omnipresent a la indústria química de tot tipus.[6] Es calcula que el 90% de tots els productes químics produïts comercialment impliquen catalitzadors en algun moment del procés de fabricació.
El terme «catalitzador» deriva del grec καταλύειν (kataluein), que significa «afluixar» o «deslligar». El concepte de catàlisi va ser inventat per la química Elizabeth Fulhame, basant-se en el seu nou treball en experiments d'oxidació-reducció.[7][8]
Principis generals
[modifica]Catalitzador
[modifica]
En química, un catalitzador és una substància que augmenta la velocitat d'una reacció química; participa en la reacció en un pas, però es regenera en un pas posterior. Per tant, no forma part dels reactius. Si és un dels productes, es diu que la reacció és autocatalitzada. Aquest és el cas, per exemple, de la reacció de l'equació
per a la qual els ions Mn2+ tenen un paper catalitzador.
Quan s'utilitza un catalitzador per accelerar una transformació, es diu que està catalitzat. Els catalitzadors només actuen sobre productes predeterminats. Si un catalitzador accelera la reacció, es diu que és positiva. Si la frena, es diu que és negativa.[9]
Els catalitzadors s'utilitzen àmpliament a la indústria i als laboratoris perquè augmenten significativament la producció de productes alhora que minimitzen els costos de producció. A la natura i en bioquímica, certes proteïnes tenen activitat catalítica; aquestes són els enzims.
El catalitzador augmenta la velocitat de reacció introduint noves vies de reacció (mecanisme) i reduint la seva energia d'activació, o energia lliure d'activació de Gibbs. En fer-ho, permet augmentar la velocitat o baixar la temperatura de la reacció. El catalitzador no modifica l'energia lliure de Gibbs total de la reacció que és una funció d'estat del sistema i, per tant, no té cap efecte sobre la constant d'equilibri.
A més de modificar la velocitat de reacció, l'elecció d'un catalitzador es pot basar en altres paràmetres:
- selectivitat: un catalitzador selectiu afavoreix la formació del producte desitjat sobre els productes secundaris. Per exemple, quan s'utilitza plata metàl·lica per catalitzar la reacció de formació d'òxid d'etilè, a partir d'oxigen i etilè, aquesta reacció va acompanyada de la formació termodinàmicament més favorable de CO2 i H2O;
- vida útil: el catalitzador ha de poder mantenir-se intacte després de diversos cicles de reacció.
La successió de passos que condueixen a la formació d'un producte no és la mateixa en presència i absència d'un catalitzador.
- absència d'un catalitzador: l'energia potencial del sistema químic adquireix un valor significatiu, fent que la reacció sigui lenta (o, per analogia, esgotant la marxa).
- presència d'un catalitzador: permet arribar al mateix estat final però mitjançant una successió de passos, cap dels quals té una energia potencial elevada.
El camí de reacció és doncs diferent en presència i absència del catalitzador; el nombre de passos és generalment més gran amb catàlisi que sense, però tots els passos són ràpids.
Exemple
[modifica]Un exemple il·lustratiu és l'efecte dels catalitzadors per accelerar la descomposició del peròxid d'hidrogen en aigua i oxigen:
Aquesta reacció es produeix perquè els productes de reacció són més estables que el compost inicial, però aquesta descomposició és tan lenta que les solucions de peròxid d'hidrogen estan disponibles comercialment. En presència d'un catalitzador com el diòxid de manganès, aquesta reacció transcorre molt més ràpidament. Aquest efecte es veu fàcilment per l'efervescència de l'oxigen.[10] El catalitzador no es consumeix en la reacció, i es pot recuperar sense canvis i reutilitzar-se indefinidament. En conseqüència, es diu que el diòxid de manganès catalitza aquesta reacció. En els organismes vius, aquesta reacció és catalitzada per enzims (proteïnes que serveixen de catalitzadors) com la catalasa.
Un altre exemple és l'efecte dels catalitzadors sobre la contaminació de l'aire i la reducció de la quantitat de monòxid de carboni. El desenvolupament de catalitzadors actius i selectius per a la conversió de monòxid de carboni en productes desitjables és un dels papers més importants dels catalitzadors. L'ús de catalitzadors per a la hidrogenació del monòxid de carboni ajuda a eliminar aquest gas tòxic i també a aconseguir materials útils.[11]
Unitats
[modifica]La unitat derivada del SI per mesurar l'activitat catalítica d'un catalitzador és el katal, que es quantifica en mols per segon. La productivitat d'un catalitzador es pot descriure pel nombre de rotació (kcat) (o TON) i l'activitat catalítica per la freqüència de rotació (TOF), que és la TON per unitat de temps.
L'equivalent bioquímic és la unitat enzimàtica (U); (per obtenir més informació sobre l'eficiència de la catàlisi enzimàtica, consulteu l'article sobre enzims).
Mecanismes de reacció catalítica
[modifica]En general, les reaccions químiques es produeixen més ràpidament en presència d'un catalitzador perquè el catalitzador proporciona un mecanisme de reacció alternatiu (via de reacció) amb una energia d'activació menor que el mecanisme no catalitzat. En els mecanismes catalitzats, el catalitzador es regenera.[12][13][14]
Com a exemple senzill que ocorre en la fase gasosa, la reacció 2 SO2 + O2 → 2 SO3 es pot catalitzar afegint òxid nítric. La reacció es produeix en dos passos:
El catalitzador NO es regenera. El ritme global és el ritme del pas lent[14]
- v = 2k1[NO]2[O2].
Un exemple de catàlisi heterogènia és la reacció de l'oxigen i l'hidrogen a la superfície del diòxid de titani (TiO2, o titània) per produir aigua. La microscopia d'efecte túnel va demostrar que les molècules pateixen adsorció i dissociació. Els àtoms d'O i H dissociats i units a la superfície es difonen junts. Els estats de reacció intermedis són: HO2, H2O2, després H3O2 (hidròxid monohidratat) i el producte de reacció (dímers de molècules d'aigua), després del qual la molècula d'aigua es desorbeix de la superfície del catalitzador.[15][16]
Reaccions energètiques
[modifica]
Els catalitzadors permeten vies que difereixen de les reaccions no catalitzades. Aquestes vies tenen una menor energia d'activació. En conseqüència, més col·lisions moleculars tenen l'energia necessària per arribar a l'estat de transició. Per tant, els catalitzadors poden permetre reaccions que, d'altra manera, serien bloquejades o alentides per una barrera cinètica. El catalitzador pot augmentar la velocitat de reacció o la selectivitat, o permetre la reacció a temperatures més baixes. Aquest efecte es pot il·lustrar amb un diagrama de perfil energètic.
En la reacció elemental catalitzada, els catalitzadors no canvien l'extensió d'una reacció: no tenen cap efecte sobre l'equilibri químic d'una reacció. La relació entre les velocitats de reacció directa i inversa no es veu afectada (vegeu també termodinàmica). La segona llei de la termodinàmica descriu per què un catalitzador no canvia l'equilibri químic d'una reacció. Suposem que hi hagués un catalitzador que canviés un equilibri. Introduir el catalitzador al sistema donaria lloc a una reacció per passar al nou equilibri, produint energia. La producció d'energia és un resultat necessari, ja que les reaccions són espontànies només si es produeix energia lliure de Gibbs, i si no hi ha barrera energètica, no cal un catalitzador. Aleshores, eliminar el catalitzador també donaria lloc a una reacció, produint energia; és a dir, l'addició i el seu procés invers, l'eliminació, produirien energia. Així, un catalitzador que podria canviar l'equilibri seria una màquina de moviment perpetu, una contradicció amb les lleis de la termodinàmica.[17] Així, els catalitzadors no alteren la constant d'equilibri. (No obstant això, un catalitzador pot canviar les concentracions d'equilibri reaccionant en un pas posterior. Aleshores es consumeix a mesura que avança la reacció i, per tant, també és un reactiu. És il·lustrativa la hidròlisi d'èsters catalitzada per bases, on l'àcid carboxílic produït reacciona immediatament amb el catalitzador de base i, per tant, l'equilibri de la reacció es desplaça cap a la hidròlisi).
El catalitzador estabilitza l'estat de transició més que no estabilitza el material de partida. Disminueix la barrera cinètica en disminuir la diferència d'energia entre el material de partida i l'estat de transició. No modifica la diferència energètica entre les matèries primeres i els productes (barrera termodinàmica), ni l'energia disponible (la proporciona l'entorn en forma de calor o llum).
Conceptes relacionats
[modifica]Alguns anomenats catalitzadors són realment precatalitzadors. Els precatalitzadors es converteixen en catalitzadors en la reacció. Per exemple, el catalitzador de Wilkinson RhCl(PPh3)3 perd un lligand de trifenilfosfina abans d'entrar en el veritable cicle catalític. Els precatalitzadors són més fàcils d'emmagatzemar però s'activen fàcilment in situ. A causa d'aquest pas de preactivació, moltes reaccions catalítiques impliquen un període d'inducció.
En la catàlisi cooperativa, les espècies químiques que milloren l'activitat catalítica s'anomenen cocatalitzadors o promotors.
En la catàlisi en tàndem, dos o més catalitzadors diferents s'acoblen en una reacció d'un sol recipient.
En autocatàlisi, el catalitzador és un producte de la reacció global, en contrast amb tots els altres tipus de catàlisi considerats en aquest article. L'exemple més senzill d'autocatàlisi és una reacció de tipus A + B → 2 B, en un o en diversos passos. La reacció global és només A → B, de manera que B és un producte. Però com que B també és un reactiu, pot estar present a l'equació de velocitat i afectar la velocitat de reacció. A mesura que avança la reacció, la concentració de B augmenta i pot accelerar la reacció com a catalitzador. En efecte, la reacció s'accelera per si mateixa o s'autocatalitza. Un exemple és la hidròlisi d'un èster com l'aspirina en un àcid carboxílic i un alcohol. En absència de catalitzadors àcids afegits, el producte d'àcid carboxílic catalitza la hidròlisi.
La catàlisi commutable es refereix a un tipus de catàlisi on el catalitzador es pot alternar entre diferents estats fonamentals que posseeixen una reactivitat diferent, normalment aplicant un estímul extern.[18] Aquesta capacitat de canviar el catalitzador de manera reversible permet un control espaciotemporal de l'activitat i la selectivitat catalítica. Els estímuls externs utilitzats per canviar el catalitzador poden incloure canvis de temperatura, pH, llum,[19] camps elèctrics o l'addició d'agents químics.
Un veritable catalitzador pot funcionar conjuntament amb un catalitzador de sacrifici. El veritable catalitzador es consumeix en la reacció elemental i es converteix en una forma desactivada.
El catalitzador de sacrifici regenera el veritable catalitzador per a un altre cicle. El catalitzador de sacrifici es consumeix en la reacció i, com a tal, no és realment un catalitzador, sinó un reactiu. Per exemple, el tetròxid d'osmi (OsO4) és un bon reactiu per a la dihidroxilació, però és altament tòxic i car. En la dihidroxilació d'Upjohn, el catalitzador de sacrifici N-òxid de N-metilmorfolina (NMMO) regenera OsO4 i només es necessiten quantitats catalitzadores d'OsO4.
Classificació
[modifica]La catàlisi es pot classificar com a homogènia o heterogènia. Una catàlisi homogènia és aquella els components de la qual es troben dispersos en la mateixa fase (generalment gasosa o líquida) que les molècules del reactiu. Una catàlisi heterogènia és aquella en què els components de la reacció no es troben en la mateixa fase.
Els enzims i altres biocatalitzadors sovint es consideren una tercera categoria. Principis mecanicistes similars s'apliquen a la catàlisi heterogènia, homogènia i biocatàlisi.
Catàlisi heterogènia
[modifica]
Els catalitzadors heterogenis actuen en una fase diferent de la dels reactius. La majoria dels catalitzadors heterogenis són sòlids que actuen sobre substrats en una mescla de reacció líquida o gasosa. Els catalitzadors heterogenis importants inclouen zeolites, alúmina,[20] òxids d'ordre superior, carboni grafític, òxids de metalls de transició, metalls com el níquel de Raney per a la hidrogenació i l'òxid de vanadi (V) per a l'oxidació del diòxid de sofre en triòxid de sofre pel procés de contacte.[21]
Es coneixen diversos mecanismes de reaccions de superfície, depenent de com es produeixi l'adsorció (Langmuir-Hinshelwood, Eley-Rideal i Mars-van Krevelen).[22] La superfície total d'un sòlid té un efecte important sobre la velocitat de reacció. Com més petita sigui la mida de les partícules del catalitzador, més gran serà la superfície per a una massa determinada de partícules.
Un catalitzador heterogeni té llocs actius, que són els àtoms o les cares de cristall on realment s'uneix el substrat. Els llocs actius són àtoms, però sovint es descriuen com una faceta (vora, superfície, pas, etc.) d'un sòlid. La major part del volum, però també la major part de la superfície d'un catalitzador heterogeni, poden estar catalíticament inactius. Esbrinar la naturalesa del lloc actiu és un repte tècnic.

Per exemple, el catalitzador del procés Haber per a la síntesi d'amoníac a partir de nitrogen i hidrogen es descriu sovint com ferro. Però estudis detallats i moltes optimitzacions han donat lloc a catalitzadors que són mescles d'òxid de ferro-potassi-calci-alumini.[23] Els gasos que reaccionen s'adsorbeixen als llocs actius de les partícules de ferro. Un cop adsorbits físicament, els reactius es dissocien parcialment o totalment i formen nous enllaços. D'aquesta manera es trenca el triple enllaç especialment fort del nitrogen, que seria extremadament infreqüent en fase gasosa per la seva alta energia d'activació. Així, l'energia d'activació de la reacció global es redueix i la velocitat de reacció augmenta.[24] Un altre lloc on s'aplica un catalitzador heterogeni és en l'oxidació de diòxid de sofre sobre òxid de vanadi (V) per a la producció d'àcid sulfúric.[21] Molts catalitzadors heterogenis són de fet nanomaterials.
Els catalitzadors heterogenis solen estar «suportats», el que significa que el catalitzador es dispersa en un segon material que millora l'eficàcia o minimitza el seu cost. Els suports eviten o minimitzen l'aglomeració i la sinterització de petites partícules de catalitzador, exposant més superfície, de manera que els catalitzadors tenen una activitat específica més alta (per gram) sobre el suport. De vegades, el suport és només una superfície sobre la qual s'estén el catalitzador per augmentar la superfície. Més sovint, el suport i el catalitzador interactuen, afectant la reacció catalítica. Els suports també es poden utilitzar en la síntesi de nanopartícules proporcionant llocs per a molècules individuals de catalitzador per unir-se químicament. Els suports són materials porosos amb una gran superfície, més habitualment alúmina, zeolites o diferents tipus de carbó actiu. Els suports especialitzats inclouen diòxid de silici, diòxid de titani, carbonat de calci i sulfat de bari.[25]
Electrocatalitzadors
[modifica]En el context de l'electroquímica, específicament en l'enginyeria de piles de combustible, s'utilitzen diversos catalitzadors que contenen metalls per millorar les velocitats de les semireaccions que componen la pila de combustible. Un tipus comú d'electrocatalitzador de piles de combustible es basa en nanopartícules de platí que es recolzen en partícules de carboni una mica més grans. En contacte amb un dels elèctrodes d'una pila de combustible, aquest platí augmenta la velocitat de reducció d'oxigen a aigua o a hidròxid o peròxid d'hidrogen.
Catàlisi homogènia
[modifica]Els catalitzadors homogenis funcionen en la mateixa fase que els reactius. Normalment, els catalitzadors homogenis es dissolen en un dissolvent amb els substrats. Un exemple de catàlisi homogènia implica la influència de H+ en l'esterificació d'àcids carboxílics, com la formació d'acetat de metil a partir d'àcid acètic i metanol.[26] Els processos de gran volum que requereixen un catalitzador homogeni inclouen la hidroformilació, la hidrosililació i la hidrocianació. Per als químics inorgànics, la catàlisi homogènia és sovint sinònim de catalitzadors organometàl·lics.[27]
No obstant això, molts catalitzadors homogenis no són organometàl·lics, il·lustrat per l'ús de sals de cobalt que catalitzen l'oxidació del p-xilè a àcid tereftàlic.
Organocatàlisi
[modifica]Mentre que els metalls de transició de vegades atrauen la major part de l'atenció en l'estudi de la catàlisi, les molècules orgàniques petites sense metalls també poden presentar propietats catalítiques, com es desprèn del fet que molts enzims no tenen metalls de transició. Normalment, els catalitzadors orgànics requereixen una càrrega més gran (quantitat de catalitzador per unitat de quantitat de reactiu, expressada en mol% de quantitat de substància) que els catalitzadors basats en metalls(-ions) de transició, però aquests catalitzadors solen estar disponibles comercialment al detall, ajudant a reduir costos. A principis de la dècada del 2000, aquests organocatalitzadors es consideraven de «nova generació» i són competitius amb els catalitzadors tradicionals que contenen metalls(-ions). Se suposa que els organocatalitzadors funcionen de manera semblant als enzims lliures de metalls utilitzant, per exemple, interaccions no covalents com els enllaços d'hidrogen. La disciplina organocatàlisi es divideix en l'aplicació d'organocatalitzadors covalents (per exemple, prolina, DMAP) i no covalents (per exemple, organocatàlisi de tiourea) referits a la unió i la interacció preferides catalitzador-substrat, respectivament. El Premi Nobel de Química 2021 es va atorgar conjuntament a Benjamin List i David W.C. MacMillan «per al desenvolupament de l'organocatàlisi asimètrica».[28]
Fotocatàlisi
[modifica]La fotocatàlisi és el fenomen on el catalitzador pot rebre llum per generar un estat excitat que produeix reaccions redox.[29] L'oxigen singlet es produeix normalment per fotocatàlisi. Els fotocatalitzadors són components de cèl·lules fotovoltaiques sensibilitzades per colorant.
Enzims i biocatalitzadors
[modifica]En biologia, els enzims són catalitzadors basats en proteïnes en el metabolisme i el catabolisme. La majoria dels biocatalitzadors són enzims, però altres classes de biomolècules no basades en proteïnes també presenten propietats catalitzadores com els ribozims i els desoxiribozims sintètics.[30]
Els biocatalitzadors es poden considerar un intermediari entre els catalitzadors homogenis i heterogenis, encara que els enzims solubles en sentit estricte són catalitzadors homogenis i els enzims units a la membrana són heterogenis. Diversos factors afecten l'activitat dels enzims (i altres catalitzadors) com la temperatura, el pH, la concentració d'enzims, el substrat i els productes. Un reactiu especialment important en les reaccions enzimàtiques és l'aigua, que és el producte de moltes reaccions de formació d'enllaços i un reactiu en molts processos de trencament d'enllaços.
En la biocatàlisi, s'utilitzen enzims per preparar molts productes químics bàsics, com ara xarop de blat de moro alt en fructosa i acrilamida.
Alguns anticossos monoclonals l'objectiu d'unió dels quals és una molècula estable que s'assembla a l'estat de transició d'una reacció química poden funcionar com a catalitzadors febles per a aquesta reacció química reduint la seva energia d'activació.[31] Aquests anticossos catalítics de vegades s'anomenen «abzims».
Classificació segons el tipus de reacció activada
[modifica]Catàlisi àcid-base
[modifica]En aquestes reaccions, el catalitzador actua com un àcid o una base. Aquest àcid o base són generalment ions H+, HO−, àcids o bases de Lewis, o fins i tot òxids metàl·lics (Al2O3, V2O5, etc.). Distingim dos casos, segons si la reacció és accelerada per tots els àcids (respectivament totes les bases), que s'anomena catàlisi general, o si cal un àcid (o base) determinat, que s'anomena catàlisi específica.
Catàlisi general
[modifica]Perquè una catàlisi sigui àcid-base general, els àcids febles (o bases) també han de catalitzar la reacció. Aquesta catàlisi ha de dependre de la concentració d'àcid feble, i no només del fet que aquest àcid pugui alliberar ions H+.
La constant de velocitat en la catàlisi àcida general és per tant de la forma:
- k = k0 + k1[H3O+] + k2[AH].
- on [AH] és la concentració d'àcid feble.
Per mostrar aquesta propietat de la catàlisi àcida general, cal per exemple determinar la dependència de la velocitat (per tant de k) en funció de la quantitat d'AH afegit, però això en un medi tamponat, de manera que el terme k1[H3O+ ] es manté constant.[32]
Catàlisi específica
[modifica]En alguns casos, un àcid determinat serveix com a catalitzador. Aleshores, el mecanisme passa per un mecanisme que li és específic, i que seria diferent per a un altre àcid. Aquest és el cas de la reacció d'halogenació de la propanona:[33]
- CH3-CO-CH3 + X2 → CH3-CO-CH2X + HX
- X = I o Br
Aquesta reacció és accelerada per H3O+ (o per HO−). La constant de velocitat és de la forma
- k = k0 + k1[H3O+] + k2[HO−].
- amb k0, constant de velocitat de la reacció no catalitzada. El valor de k0 és molt baix en comparació amb k1 i k2 (d'aquí l'efecte notable de l'augment de velocitat dels catalitzadors H3O+ i HO−).
L'addició d'un àcid feble només modifica la velocitat per la variació de la concentració de [H3O+] que permet, i no per la variació de la seva pròpia concentració. Això indica que és específicament H3O+ el catalitzador, i no un àcid qualsevol.
La inversió de la sacarosa també és de tipus de catàlisi específic. La seva equació és:
L'halogénation des nitroalcanes est un exemple de catalyse basique spécifique.
Catàlisi redox
[modifica]Les reaccions redox també es poden catalitzar. Per exemple, la desproporció del peròxid d'hidrogen és catalitzada per ions Fe2+ o Fe3+, la hidrogenació d'alquens pel níquel de Raney, o per metalls nobles suportats.[34] La hidrogenació i la hidrodesoxigenació estan àmpliament estudiades a causa de la seva rellevància per a la valorització de compostos del carboni.[35] Els processos oxidatius s'utilitzen per a la síntesi de productes químics com el formaldehid,[36] l'acetaldehid,[37] l'àcid acrílic,[38][39] l'àcid benzoic.[40] Aquesta catàlisi implica generalment una parella redox el potencial de la qual estarà entre el potencial de l'oxidant i el del reductor.
- Catàlisi nucleòfila
Les reaccions de substitució nucleòfila es poden accelerar fortament en presència de traces d'altres nucleòfils. L'exemple clàssic és el iodur de liti. En aquesta sal, l'ió iodur està molt dèbilment lligat al liti, i és un nucleòfil bastant efectiu. L'ió iodur també és un nucleòfug molt eficaç. Per tant, serà desplaçat pel nucleòfil principal més ràpidament del que hauria tingut lloc la reacció en absència de catalitzador.
- Catàlisi de transferència de fase
Aquí, la idea és posar en contacte espècies que es troben en dues fases diferents. Així, les substitucions nucleòfiles, per exemple
seria assolible si es poguessin trobar la base HO− que es troba en fase aquosa i el substrat RCl que es troba en fase orgànica. Una espècie química que transportés l'ió hidròxid de la fase aquosa a la fase orgànica i després retransportaria el nucleòfug Cl− de la fase orgànica a la fase aquosa sense transformar-se seria un catalitzador, i en aquest cas, un catalitzador per transferència de fase. Una regla essencial és que cada fase ha de respectar l'electroneutralitat, de manera que si un catió canvia de fase, un anió ha de canviar al mateix temps (o un catió ha de passar al mateix temps en l'altra direcció).
Els cations d'amoni substituïts per cadenes alquils, per exemple (C4H9)N+, poden tenir aquest paper catalític. A causa de la seva càrrega positiva, poden ser solvatats en fase aquosa, i a través de les seves cadenes alquils, poden ser solvatats en fase orgànica. El primer pas en aquest cas és la transferència de (C4H9)N+ + HO− (espècie globalment neutra). La reacció de substitució pot tenir lloc en la fase orgànica i produir l'anió Cl−. L'espècie (C4H9)N+ + Cl− (encara generalment neutre) pot passar a la fase aquosa. El catió amoni torna a estar disponible per a una nova transferència d'ions HO−.
Les substitucions nucleòfiles no són les úniques que poden implicar catàlisi de transferència de fase, per exemple l'oxidació de l'estirè per ions permanganat,[41] en presència de (C4H9)N+ + HSO4−.
- Autocatàlisi
En alguns casos, el catalitzador apareix entre els productes de la reacció; llavors la reacció s'autocatalitza. L'efecte de l'autocatàlisi provoca un augment de la velocitat de reacció (mentre que la velocitat sempre disminueix a mesura que avança la reacció) abans de disminuir. L'augment de la velocitat es deu a l'augment de la concentració del catalitzador, i la seva disminució a la important desaparició dels seus reactius.
Importància
[modifica]
Es calcula que el 90% de tots els productes químics produïts comercialment impliquen catalitzadors en algun moment del procés de fabricació. El 2005, els processos catalítics van generar uns 900.000 milions de dòlars en productes a tot el món.[43] La catàlisi és tan generalitzada que les subàrees no es classifiquen fàcilment. A continuació s'estudien algunes àrees de concentració especial.
Processament energètic
[modifica]El refinament del petroli fa un ús intensiu de la catàlisi per a l'alquilació, el craqueig catalític (trencant els hidrocarburs de cadena llarga en trossos més petits), la reformació amb nafta i la reformació amb vapor (conversió d'hidrocarburs en gas de síntesi). Fins i tot l'escapament de la combustió de combustibles fòssils es tracta mitjançant catàlisi; els convertidors catalítics, típicament formats per platí i rodi, descomponen alguns dels subproductes més nocius de l'escapament dels automòbils.
Pel que fa als combustibles sintètics, un procés antic però encara important és la síntesi Fischer-Tropsch d'hidrocarburs a partir del gas de síntesi, que es processa a través de reaccions de desplaçament aigua-gas, catalitzades pel ferro. La reacció de Sabatier produeix metà a partir de diòxid de carboni i hidrogen. El biodièsel i els biocombustibles relacionats requereixen un processament tant amb biocatalitzadors com inorgànics.
Les piles de combustible es basen en catalitzadors tant per a les reaccions anòdiques com catòdiques.
Els escalfadors catalítics generen calor sense flama a partir d'un subministrament de combustible.
Substàncies químiques a granel
[modifica]
Alguns dels productes químics a més gran escala es produeixen mitjançant oxidació catalítica, sovint utilitzant oxigen. Alguns exemples inclouen l'àcid nítric (de l'amoníac), l'àcid sulfúric (del diòxid de sofre al triòxid de sofre pel procés de contacte), l'àcid tereftàlic del p-xilè, l'àcid acrílic del propilè o propà, i l'acrilonitril del propà i l'amoníac.[22]
La producció d'amoníac és un dels processos de major escala i que consumeixen més energia. En el procés Haber, el nitrogen es combina amb hidrogen sobre un catalitzador d'òxid de ferro.[44] El metanol es prepara a partir de monòxid de carboni o diòxid de carboni però utilitzant catalitzadors de coure-zinc.
Els polímers a granel derivats d'etilè i propilè sovint es preparen mitjançant catàlisi de Ziegler-Natta. Els polièsters, poliamides i isocianats es deriven mitjançant catàlisi àcid-base.
La majoria dels processos de carbonilació requereixen catalitzadors metàl·lics, com ara el procés d'àcid acètic de Monsanto i la hidroformilació.
Química fina
[modifica]Molts productes de química fina es preparen mitjançant catàlisi; els mètodes inclouen els de la indústria pesant, així com processos més especialitzats que serien prohibitivament cars a gran escala. Alguns exemples inclouen la reacció de Heck i les reaccions de Friedel-Crafts.
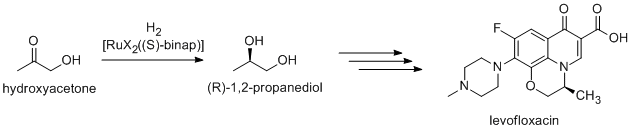
Com que la majoria dels compostos bioactius són quirals, molts productes farmacèutics es produeixen per catàlisi enantioselectiva (síntesi asimètrica catalítica). (R)-1,2-Propandiol, el precursor de la levofloxacina antibacteriana, es pot sintetitzar de manera eficient a partir d'hidroxiacetona mitjançant l'ús de catalitzadors basats en complexos BINAP-ruteni, en hidrogenació asimètrica de Noyori:[45]
-
Síntesi de la levofloxacina
Processament d'aliments
[modifica]Una de les aplicacions més òbvies de la catàlisi és la hidrogenació (reacció amb hidrogen gasós) de greixos utilitzant catalitzadors de níquel per produir margarina.[46] Molts altres aliments es preparen mitjançant biocatàlisi (vegeu més amunt).
Medi ambient
[modifica]La catàlisi afecta el medi ambient augmentant l'eficiència dels processos industrials, però la catàlisi també té un paper directe en el medi ambient. Un exemple notable és el paper catalític dels radicals lliures del clor en la descomposició de l'ozó. Aquests radicals es formen per l'acció de la radiació ultraviolada sobre els clorofluorocarburs (CFC).
- Cl· + O3 → ClO· + O2
- ClO· + O· → Cl· + O2
Història
[modifica]Etapes de la descoberta
[modifica]
Alguns passos notables en el descobriment i la comprensió del concepte de catàlisi s'enumeren aquí en ordre cronològic. Els primers descobriments estan vinculats al camp de la biocatàlisi:
- 6.000 aC, processos tècnics per a la fermentació alcohòlica dels sucres, utilitzats pels sumeris a Mesopotàmia; producció d'àcid acètic a partir d'alcohol mitjançant enzims.
- Acceleració i orientació de les fermentacions de la llet per als formatges: els descobriments relacionats van reduir molt ràpidament els riscos de colonització per patògens i van augmentar significativament la durada del consum de productes lactis (en l'escala temporal del producte bàsic, era una tècnica de màxima importància).
- Els processos d'elaboració de farina permeten la realització del punt de cocció al forn i una modificació de la digestibilitat del component bàsic.
Després d'aquests inicis, es va produir al segle xviii i principis del segle xix:
- A mitjans del segle xviii, el físic britànic John Roebuck va desenvolupar un procés que permetia la formació d'àcid sulfúric per oxidació del diòxid de sofre per l'aire; la reacció es realitza en presència d'un catalitzador, l'àcid nitrosilsulfúric, en un dipòsit de plom.[47]
- Vers 1780, Antoine-Augustin Parmentier, farmacèutic militar, agrònom i nutricionista francès va realitzar múltiples descobertes, com la catàlisi àcida del sucre.
- El 1782, descobriment de Carl Wilhelm Scheele de l'esterificació d'alcohols catalitzada per àcids.
- El 1783, Joseph Priestley va realitzar la transformació de l'etanol a partir d'etilè.
- El terme «catalitzador», definit a grans trets com qualsevol cosa que augmenta la velocitat de reacció d'un procés químic, deriva del grec καταλύειν, que significa «anul·lar», «deslligar» o «recollir». El concepte de «catàlisi» va ser inventat per la química Elizabeth Fulhame i descrit en el seu Assaig sobre la combustió de 1794, basat en el seu nou treball sobre reaccions d'oxidació-reducció,[7][8][48] i la importància de l'aigua en determinades reaccions d'oxidació.[49]
- La primera reacció química en química orgànica que utilitzava conscientment un catalitzador va ser estudiada el 1811 per Gottlieb Kirchhoff, que va descobrir la conversió catalitzada per àcids del midó en glucosa.
- El 1817, Humphry Davy va descobrir que la introducció de platí calent en una barreja d'aire i gas procedent del carbó va provocar que el metall s'escalfes fins a la incandescència.
- El 1824, William Henry va informar de l'enverinament d'un catalitzador: l'etilè va inhibir la reacció entre l'hidrogen i l'oxigen sobre el platí. També va notar una oxidació selectiva en la reacció entre l'oxigen i una barreja de gasos composta d'hidrogen, monòxid de carboni i metà.
- El terme «catàlisi» va ser introduït per Berzelius l'any 1835 (del nom grec: κατάλυσι, katálusis; «dissolució») per descriure les reaccions que s'acceleren per substàncies que romanen sense canvis després de la reacció.[50][51] Aquesta idea no només va tenir adeptes. Liebig, per exemple, es va oposar, en el cas de la fermentació, a la teoria de la catàlisi proposada per Berzelius. Per a Liebig, la causa de la fermentació va ser deguda a la transmissió de vibracions de les partícules de fermentació.[52]
- El 1845, William Grove va demostrar que un filament de platí també era un catalitzador per a la descomposició de l'aigua en hidrogen i oxigen.

Mecanisme de doble descomposició vist per Kekulé el 1850 - A la dècada del 1850, Kekulé va comprendre que la llei d'acció de masses i les forces catalítiques eren importants en les reaccions químiques, i que les forces que unien les molècules també provocaven la seva descomposició, i que els productes intermedis es podien aïllar.[53] Vegeu la representació al costat.
- L'any 1871 es va desenvolupar el procés Deacon, utilitzat per a l'oxidació de l'àcid clorhídric a clor; utilitzava un catalitzador fet de maó d'argila impregnat de sals de coure.
- Poc després, l'any 1877, Clément Georges Lemoine va demostrar que la descomposició del iodur d'hidrogen en dihidrogen i diode arribava al mateix punt d'equilibri a 350 °C tant si la reacció es fes amb catalitzador com sense (platí). Aquesta propietat va ser confirmada dos anys més tard per Claude Louis Berthollet amb l'esterificació d'àcids orgànics i la hidròlisi d'èsters l'equilibri de reacció dels quals es manté idèntic amb o sense catalitzador.
- A la dècada del 1880, Wilhelm Ostwald (de la Universitat de Leipzig) va iniciar una investigació sistemàtica sobre reaccions catalitzades per la presència d'àcids i bases, i va trobar que les reaccions químiques es produeixen a velocitats finites i que aquestes velocitats es poden utilitzar per determinar les forces d'àcids i bases. Per aquest treball, Ostwald va rebre el Premi Nobel de Química l'any 1909.[54] Vladimir Ipatieff va realitzar algunes de les primeres reaccions a escala industrial, incloent el descobriment i la comercialització de l'oligomerització i el desenvolupament de catalitzadors per a la hidrogenació.[55]
- Altres químics del segle xviii que van treballar en catàlisi van ser Eilhard Mitscherlich[56] (que s'hi referia com a processos de contacte), i Johann Wolfgang Döbereiner[57][58] (que parlava d'acció de contacte). Va desenvolupar la làmpada de Döbereiner, un encenedor a base d'hidrogen i una esponja de platí, que es va convertir en un èxit comercial a la dècada del 1820 que perdura avui. Humphry Davy va descobrir l'ús del platí en la catàlisi.[59]
- Al voltant de 1901, Georg Bredig va destacar la importància de la intoxicació per catalitzadors.[60]
La catàlisi durant el desenvolupament de la química
[modifica]El començament del segle xx marca un descobriment que continua tenint repercussions avui en dia.[61] Wilhelm Normann va realitzar la hidrogenació de l'àcid oleic (àcid cis-9-octadecenoic, C17H33COOH), líquid, en àcid esteàric (àcid octadecanoic, C17H35COOH), sòlid, sobre níquel finament dividit. Aquesta hidrogenació encara és molt utilitzada al segle xxi en molts àmbits (alimentació, farmàcia, fabricació de sabó, perfumeria, pintura, etc.) i el níquel continua sent el principal catalitzador.
La síntesi d'amoníac (NH3) a partir de dinitrogen i dihidrogen va ser desenvolupada per Fritz Haber a alta pressió, a temperatura mitjana i catalitzada per ferro (Fe3O4 reduït). Aquest amoníac es pot oxidar a monòxid de nitrogen per oxidació, aquesta vegada catalitzat pel platí, per servir de base per a la fabricació d'àcid nítric (HNO3). El 1923, BASF va ordenar una planta per fabricar metanol a partir de monòxid de carboni i hidrogen mitjançant un catalitzador basat en òxid de zinc i òxid de crom. Durant el mateix període, el procés Fischer-Tropsch va permetre obtenir alcans, alquens i alcohols a partir de monòxid de carboni i hidrogen mitjançant un catalitzador a base de ferro i cobalt. L'oxidació catalítica del diòxid de sofre a triòxid de sofre sobre òxid de vanadi (V) (V2O5) permet la síntesi a gran escala d'àcid sulfúric.
A finals de la dècada del 1930 va aparèixer el craqueig catalític, que oferia la possibilitat de trencar els enllaços C-C. Aquest procés de Houdry utilitza un catalitzador a base d'argila tipus montmoril·lonita tractada amb àcid, i permet dividir les grans molècules de petroli, típicament contingudes en el gasoil, en d'altres més petites, constituint gasolina. Durant la mateixa dècada, Union Carbide va investigar, desenvolupar i comercialitzar l'oxidació selectiva d'etilè a òxid d'etilè en un catalitzador a base de plata. Tots aquests processos permeten l'accés, a escala industrial, a productes químics bàsics, obrint així el camí per al desenvolupament de la química bàsica i d'especialitat.
Just després de la Segona Guerra Mundial, els Trente Glorieuses van beneficiar molt la química amb un gran desenvolupament de tot tipus de processos per a una producció cada cop més diversificada. La catàlisi serà un actor important en aquest desenvolupament. La polimerització es desenvolupa molt aprofitant les molècules de base produïdes.
A la dècada del 1950, el polietilè, el polipropilè i el polibutadiè van aparèixer gràcies, en particular, al procés de polimerització coordinada Ziegler-Natta mitjançant catalitzadors basats en complexos organometàl·lics de titani i alumini. El tractament del petroli s'afirma amb hidrodessulfuració sobre catalitzadors a base de sulfur de cobalt i molibdè, l'hidrotractament de naftes sobre catalitzadors de cobalt-molibdè dipositats sobre alúmina.
La dècada del 1960 va marcar l'aparició de zeolites sintètiques actives i selectives per a la isomerització d'alcans i el craqueig catalític. A partir d'aleshores, aquests materials seran objecte d'estudis intensos per les seves propietats catalítiques i els investigadors estan desenvolupant nombroses zeolites amb propietats adaptades segons les reaccions a catalitzar, però també a la forma de les molècules controlant la mida dels canals. Les reaccions implicades donen lloc a molècules cada cop més diverses: l'amoxidació del propilè sobre catalitzadors a base d'òxids de bismut i molibdè condueix a la fabricació d'acrilonitril, mentre que l'oxicloració d'etilè sobre catalitzadors a base de clorur de coure(II) condueix al clorur de vinil.
La dècada del 1970 va veure l'aparició del convertidor catalític a base de platí, rodi i pal·ladi, mentre que en altres llocs es va desenvolupar industrialment la catàlisi enzimàtica amb la immobilització d'enzims, que va permetre produir penicil·lines semisintètics o la isomerització de la glucosa en fructosa.
El descobriment de zeolites sintètiques va aparèixer industrialment a la dècada del 1980; el procés MTG (methanol to gasoline) va permetre fabricar gasolina a partir de metanol mitjançant la zeolita H-ZSM5, producció de gasoil a partir de CO i H2 mitjançant catalitzadors a base de cobalt. Els productes químics fins no es deixen de banda amb la síntesi de vitamina K4 mitjançant un catalitzador de membrana fet de platí.
La llista encara és molt llarga i les molècules són cada cop més elaborades i s'obren noves perspectives a la dècada del 2010,[62][63][64][65][66][67][68][69] amb l'ús de catalitzadors d'un sol àtom, que s'espera que millorin encara més la catàlisi heterogènia, fins i tot en els camps de la química i l'energia.[70]
Inhibidors, verins i promotors
[modifica]Una substància afegida que redueix la velocitat de reacció s'anomena inhibidor de reacció si és reversible i verí del catalitzador si és irreversible.[1] Els promotors són substàncies que augmenten l'activitat catalítica, encara que no siguin catalitzadors per si mateixos.[71]
Els inhibidors de vegades s'anomenen catalitzadors negatius, ja que disminueixen la velocitat de reacció.[72] Tanmateix, es prefereix el terme inhibidor ja que no funcionen introduint un camí de reacció amb una energia d'activació més alta; això no reduiria la velocitat ja que la reacció continuaria produint-se pel camí no catalitzat. En canvi, actuen desactivant catalitzadors o eliminant intermedis de reacció com els radicals lliures.[5][72] En la catàlisi heterogènia, la coquització inhibeix el catalitzador, que queda cobert per productes secundaris polimèrics.[5]
L'inhibidor pot modificar la selectivitat a més de la velocitat. Per exemple, en la hidrogenació d'alquins a alquens, es pot utilitzar un catalitzador de pal·ladi (Pd) parcialment «enverinat» amb acetat de plom (II) (Pb(CH3CO2)2) (catalitzador de Lindlar).[73] Sense la desactivació del catalitzador, l'alquè produït seria hidrogenat encara més a alcà.[74][75]
L'inhibidor pot produir aquest efecte, per exemple, enverinant selectivament només certs tipus de llocs actius. Un altre mecanisme és la modificació de la geometria de la superfície. Per exemple, en les operacions d'hidrogenació, grans plans de superfície metàl·lica funcionen com a llocs de catàlisi d'hidrogenòlisi, mentre que els llocs que catalitzen la hidrogenació d'insaturats són més petits. Així, un verí que cobreix la superfície de manera aleatòria tendirà a reduir el nombre de grans plans no contaminats però deixarà lliures llocs proporcionalment més petits, canviant així la selectivitat entre la hidrogenació i la hidrogenòlisi. També són possibles molts altres mecanismes.
Els promotors poden cobrir la superfície per evitar la producció d'una estora de carbó de coc, o fins i tot eliminar activament aquest material (per exemple, reni sobre platí en reformat catalític). Poden ajudar a la dispersió del material catalític o unir-se als reactius.
Alguns exemples de reaccions i processos
[modifica]Un gran nombre de processos químics inclouen almenys un pas catalitzat, ja sigui per a la fabricació de fibres sintètiques, fàrmacs o additius alimentaris, sense oblidar totes les reaccions biològiques catalitzades per enzims.
A més, en promoure reaccions poc contaminants, la catàlisi és un dels pilars de la química verda. La resta d'aquesta secció ofereix exemples de reaccions catalitzades en funció dels sectors d'aplicació.
La catàlisi a la vida quotidiana
[modifica]- L'escalfament individual de gas per catàlisi no és perillós perquè pràcticament no emet CO.[76]
- El convertidor catalític és sens dubte l'exemple més conegut de catàlisi.
- L'ús del rent de flequer per fer pa.
-
Convertidor catalític sota un vehicle
Catàlisi en els principals processos industrials
[modifica]
Els processos industrials que utilitzen catalitzadors estalvien productes químics (millors rendiments, síntesi en menys passos), temps (per tant diners) i energia mitjançant l'ús de processos de temperatura més baixa. Alguns exemples de grans processos industrials són:[77]
- síntesi d'amoníac (NH3) a partir dels seus elements H2 i N2, catalitzat pel ferro (procés de Haber-Bosch);
- síntesi d'àcid sulfúric pel procés de contacte (oxidació de SO2 a SO3 catalitzat per V2O5);
- reformat petroquímic (conversió de molècules naftèniques en molècules aromàtiques mitjançant platí i alúmina);
- craqueig en petroquímica per transformar molècules pesades en petites molècules, utilitzant zeolites.
Experiments utilitzats per a l'ensenyament de la catàlisi
[modifica]- Experiment amb làmpades sense flama (oxidació de l'etanol per l'aire en presència de coure).[78]
- Diversa descomposició del peròxid d'hidrogen per ions de ferro, platí, diòxid de manganès, sang, un troç de rave, etc.
- Reaccions en química orgànica (esterificació, hidròlisi, etc.) catalitzades per un àcid fort.
Catàlisi entretinguda
[modifica]- La cendra pot servir com a catalitzador quan es crema sucre. Aquest últim, escalfat amb un encenedor, no produeix flama. Cobert de cendra, pot encendre i cremar amb una flama blava.
- La Lampe Berger elimina les males olors mitjançant la difusió d'una substància activa a l'aire, mitjançant la combustió catalítica del seu substrat.
No són catalitzadors...
[modifica]- La temperatura, encara que augmenta la velocitat de reacció. El catalitzador és una espècie química, que la temperatura no ho és.
- La llum pot iniciar determinades reaccions fotoquímiques, però no és un catalitzador perquè la llum no és una espècie química. A més, la llum no surt il·lesa, ja que una part de la seva energia serà absorbida i, per tant, es modificarà la seva longitud d'ona.
- Un iniciador, tot i que és una espècie química, augmenta la velocitat, i no apareix en el balanç. De fet, l'iniciador es consumeix a l'inici de la reacció. Per exemple, un iniciador radical permet produir els primers radicals que permeten que es produeixi la polimerització radical.
Referències
[modifica]- ↑ 1,0 1,1 «Catalyst». A: IUPAC Compendium of Chemical Terminology (en anglès). Oxford: Blackwell Scientific Publications, 2009. DOI 10.1351/goldbook.C00876. ISBN 978-0-967-85509-7.
- ↑ Masel, 2001.
- ↑ Steinfeld, Francisco i Hase, 1999, p. 147; «Un catalitzador es defineix com una substància química que augmenta la velocitat d'una reacció química sense que es consumeixi en la reacció».
- ↑ Lerner, 2011.
- ↑ 5,0 5,1 5,2 Laidler i Meiser, 1982, p. 425.
- ↑ Carroll i Krischman, 2023, p. 21-28.
- ↑ 7,0 7,1 Laidler i Cornish-Bowden, 1997, p. 123-126.
- ↑ 8,0 8,1 Rayner-Canham i Rayner-Canham, 2001.
- ↑ «Facteurs qui influencent la vitesse d'une réaction» (en francès). Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire, 2005. Arxivat de l'original el 2009-02-07. [Consulta: 9 novembre 2024].
- ↑ «Genie in a Bottle» (en anglès). Universitat de Minnesota, 02-03-2005. Arxivat de l'original el 2008-04-05. [Consulta: 9 novembre 2024].
- ↑ Torkashvand, Sarabadani Tafreshi i de Leeuw, 2023, p. 837.
- ↑ Laidler i Meiser, 1982, p. 424-425.
- ↑ Atkins i de Paula, 2006, p. 839; «El catalitzador redueix l'energia d'activació de la reacció proporcionant un camí alternatiu que evita el pas lent i que determina la velocitat de la reacció no catalitzada».
- ↑ 14,0 14,1 Steinfeld, Francisco i Hase, 1999, p. 147-150; «La concentració del catalitzador [C] apareix en l'expressió de velocitat, però no en la relació d'equilibri».
- ↑ Mitch, 2009, p. 10.
- ↑ Matthiesen et al., 2009, p. 517-526.
- ↑ Robertson, 1970.
- ↑ Vlatković, Collins i Feringa, 2016, p. 17080-17111.
- ↑ Roelz, Butschke i Breit, 2024, p. 13210–13225.
- ↑ Shafiq et al., Hussain, p. 1-86.
- ↑ 21,0 21,1 Housecroft i Sharpe, 2005, p. 805.
- ↑ 22,0 22,1 Knözinger i Kochloefl, 2002.
- ↑ Appl, 2006.
- ↑ «Chemistry of Vanadium» (en anglès). Chemistry LibreTexts, 03-10-2013.
- ↑ Chadha et al., 2022.
- ↑ Behr, 2002.
- ↑ Elschenbroich, 2006.
- ↑ «The Nobel Prize in Chemistry 2021» (en anglès). Premis Nobel.
- ↑ Melchiorre, 2022, p. 1483-1484.
- ↑ Nelson i Cox, 2000.
- ↑ «Catalytic Antibodies Simply Explained» (en anglès). Documentroot, 06-03-2010. Arxivat de l'original el 2013-10-06. [Consulta: 9 novembre 2024].
- ↑ Schuffenecker et al., 1991, p. 566.
- ↑ Schuffenecker et al., 1991, p. 354.
- ↑ Sikora et al., 2019.
- ↑ Alshehri et al., 2019, p. 23-40.
- ↑ Chen et al., 2019, p. 315-329.
- ↑ Parfenov i Pirutko, 2019, p. 1025-1038.
- ↑ «Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid» (en anglès). J. Catal., 285, 2012, pàg. 48-60.
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts» (en anglès). J. Catal., 2014, pàg. 369-385.
- ↑ «Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol» (en anglès). ACS Catal., 3(6), 2013, pàg. 1103-1113.
- ↑ Barbe i Le Maréchal, 2007, p. 39.
- ↑ Solovev et al., 2011, p. 10131-10135.
- ↑ «1.4.3 Industrial Process Efficiency» (
 PDF) (en anglès). Climate Technology, 17-05-2008. Arxivat de l'original el 2008-05-17. [Consulta: 9 novembre 2024].
PDF) (en anglès). Climate Technology, 17-05-2008. Arxivat de l'original el 2008-05-17. [Consulta: 9 novembre 2024].
- ↑ Smil, 2004.
- ↑ Dub i Gordon, 2018, p. 296-408.
- ↑ Clark, 2013.
- ↑ Join, 2007.
- ↑ Lindström i Petterson, 2003, p. 130-138.
- ↑ Crépieux i Pigeard-Micault, 2023.
- ↑ Berzelius, J. J.. Årsberättelsen om framsteg i fysik och kemi [Informe anual sobre el progrés en física i química] (en suec). Estocolm: Reial Acadèmia Sueca de Ciències, 1835. «Després de revisar la investigació d'Eilhard Mitscherlich sobre la formació de l'èter, Berzelius encunya la paraula katalys (catàlisi) a la pàg. 245:
Original: Jag skall derföre, för att begagna en i kemien välkänd härledning, kalla den kroppars katalytiska kraft, sönderdelning genom denna kraft katalys, likasom vi med ordet analys beteckna åtskiljandet af kroppars beståndsdelar medelst den vanliga kemiska frändskapen. Traducció: per emprar una derivació coneguda en química, anomenaré [els] cossos [és a dir, les substàncies] la força catalítica i la descomposició d'[altres] cossos per aquesta força catàlisi, tal com signifiquem amb la paraula anàlisi la separació dels constituents dels cossos per les afinitats químiques habituals» - ↑ Partington, 1998, p. 196, 213.
- ↑ Partington, 1998, p. 230.
- ↑ Partington, 1998, p. 289.
- ↑ Roberts, 2000, p. 1-4.
- ↑ Nicholas, 2018, p. 8531-8539.
- ↑ Mitscherlich, 834, p. 273-282.
- ↑ Döbereiner, 1822, p. 91-92.
- ↑ Döbereiner, 1823, p. 321-326.
- ↑ Davy, 1817, p. 77-85.
- ↑ Partington, 1998, p. 341.
- ↑ «Catalyse» (en francès). Physique et matiere. Arxivat de l'original el 2022-10-18. [Consulta: 9 novembre 2024].
- ↑ Mitchell i Pérez-Ramírez, 2020.
- ↑ Datye i Guo, 2021.
- ↑ Yang et al., 2019.
- ↑ Shang et al., 2020.
- ↑ Fang et al., 2020.
- ↑ Ouyang et al., 2021.
- ↑ Yang et al., 2020.
- ↑ Sun et al., 2018.
- ↑ «Single atom catalysts push the boundaries of heterogeneous catalysis» (en anglès). Nature Communications, 12(1), desembre 2021, pàg. 5884. DOI: 10.1038/s41467-021-26130-0. ISSN: 2041-1723. PMID: 34635653.
- ↑ Dhara i Umare, 2018, p. 66.
- ↑ 72,0 72,1 Laidler, 1978, p. 415-417.
- ↑ Lindlar i Dubius, 2016.
- ↑ Jencks, 1969.
- ↑ Bender, Komiyama i Bergeron, 1984.
- ↑ Gélin, Patrick. «La combustion catalytique» (
 PDF) (en francès). Institut de recherches sur la catalyse et l'environnement de Lyon (IRCELyon). Arxivat de l'original el 2020-11-29. [Consulta: 9 novembre 2024].
PDF) (en francès). Institut de recherches sur la catalyse et l'environnement de Lyon (IRCELyon). Arxivat de l'original el 2020-11-29. [Consulta: 9 novembre 2024].
- ↑ «3 – Grands procédés industriels en catalyse hétérogène» (
 PDF) (en francès). PSL (ESPCI París).
PDF) (en francès). PSL (ESPCI París).
- ↑ «La lampe sans flamme » (en francès). Science amusante.
Bibliografia
[modifica]- Alshehri, Feras; Feral, Clement; Kirkwood, Kathleen; Jackson, S. David «Low temperature hydrogenation and hydrodeoxygenation of oxygen-substituted aromatics over Rh/silica: part 1: phenol, anisole and 4-methoxyphenol» (en anglès). Reaction Kinetics, Mechanisms and Catalysis, 128(1), octubre 2019. DOI: 10.1007/s11144-019-01630-9. ISSN: 1878-5204.
- Appl, Max. «Ammonia». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès), 2006. DOI 10.1002/14356007.a02_143.pub2.
- Atkins, Peter; de Paula, Julio. Atkins' Physical Chemistry (en anglès). W. H. Freeman, 2006.
- Barbe, R.; Le Maréchal, J.F.. La chimie expérimentale (en francès). 2. Dunod: Sciences sup, 2007.
- Behr, Arno. «Organometallic Compounds and Homogeneous Catalysis». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a18_215.
- Bender, Myron L.; Komiyama, Makoto; Bergeron, Raymond J. The Bioorganic Chemistry of Enzymatic Catalysis (en anglès). Hoboken, U.S.: Wiley-Interscience, 1984.
- Carroll, Gregory T.; Kirschman, David L. «Catalytic Surgical Smoke Filtration Unit Reduces Formaldehyde Levels in a Simulated Operating Room Environment» (en anglès). ACS Chemical Health & Safety, 30(1), gener 2023. DOI: 10.1021/acs.chas.2c00071. ISSN: 1871-5532.
- Chadha, Utkarsh; Selvaraj, Senthil Kumaran; Ashokan, Hridya; Hariharan, Sai P. «Complex Nanomaterials in Catalysis for Chemically Significant Applications: From Synthesis and Hydrocarbon Processing to Renewable Energy Applications» (en anglès). Advances in Materials Science and Engineering, 2022, febrer 2022, pàg. e1552334. DOI: 10.1155/2022/1552334. ISSN: 1687-8434.
- Chen, Dan; Shi, Jing; Yao, Yanbin; Wang, Shiwen «Enhanced catalytic activity towards formaldehyde oxidation over Ag catalysts supported on carbon nanotubes» (en anglès). Reaction Kinetics, Mechanisms and Catalysis, 127(1), juny 2019. DOI: 10.1007/s11144-019-01549-1. ISSN: 1878-5204.
- Clark, Jim. «Types of catalysis» (en anglès). Chemguide, octubre 2013.
- Crépieux, Adeline; Pigeard-Micault, Natalie. Petit dictionnaire illustré des femmes scientifiques: 110 noms, d'Hypatie aux récentes nobélisées (en francès). Ellipses, 2023. ISBN 978-2-340-07966-3.
- Datye, Abhaya K.; Guo, Hua «Single atom catalysis poised to transition from an academic curiosity to an industrially relevant technology» (en anglès). Nature Communications, 12(1), febrer 2021. DOI: 10.1038/s41467-021-21152-0. ISSN: 2041-1723.
- Davy, Humphry «Some new experiments and observations on the combustion of gaseous mixtures, with an account of a method of preserving a continued light in mixtures of inflammable gases and air without flame» (en anglès). Philosophical Transactions of the Royal Society of London, 107, 1817. DOI: 10.1098/rstl.1817.0009.
- Dhara, S. S.; Umare, S. S.. A Textbook of Engineering Chemistry (en anglès). Índia: S. Chand Publishing, 2018. ISBN 978-9-352-83068-8.
- Döbereiner, J. W. «Glühendes Verbrennen des Alkohols durch verschiedene erhitzte Metalle und Metalloxyde (Combustió incandescent d'alcohol per diversos metalls escalfats i òxids metàl·lics)» (en alemany). Journal für Chemie und Physik, 34, 1822.
- Döbereiner, J. W. «Neu entdeckte merkwürdige Eigenschaften des Platinsuboxyds, des oxydirten Schwefel-Platins und des metallischen Platinstaubes (Propietats notables recentment descobertes del subòxid de platí, sulfur de platí oxidat i pols metàl·lic de platí)» (en alemany). Journal für Chemie und Physik, 38, 1823.
- Dub, Pavel A.; Gordon, John C. «The role of the metal-bound N–H functionality in Noyori-type molecular catalysts» (en anglès). Nature Reviews Chemistry, 2(12), 2018. DOI: 10.1038/s41570-018-0049-z.
- Elschenbroich, C. Organometallics (en anglès). Weinheim: Wiley-VCH, 2006. ISBN 978-3-527-29390-2.
- Fang, Shi; Zhu, Xiaorong; Liu, Xiaokang; Gu, Jian «Uncovering near-free platinum single-atom dynamics during electrochemical hydrogen evolution reaction» (en anglès). Nature Communications, 11(1), febrer 2020. DOI: 10.1038/s41467-020-14848-2. ISSN: 2041-1723.
- Housecroft, Catherine E.; Sharpe, Alan G. Inorganic Chemistry (en anglès). Pearson/Prentice Hall, 2005. ISBN 0130-39913-2.
- Jencks, W. P.. Catalysis in Chemistry and Enzymology (en anglès). Nova York: McGraw-Hill, 1969.
- Join, Benoît «La catalyse» (en francès). La Recherche, gener 2007.
- Knözinger, Helmut; Kochloefl, Karl. «Heterogeneous Catalysis and Solid Catalysts». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a05_313.
- Laidler, Keith J. Physical Chemistry with Biological Applications (en anglès). Benjamin/Cummings, 1978.
- Laidler, Keith J.; Meiser, John H. Physical Chemistry (en anglès). Benjamin/Cummings, 1982. «Els inhibidors no funcionen introduint un camí de reacció superior; això no reduiria la velocitat, ja que la reacció continuaria produint-se pel mecanisme alternatiu.»
- Laidler, Keith J.; Cornish-Bowden, Athel. «Elizabeth Fulhame and the discovery of catalysis: 100 years before Buchner». A: New beer in an old bottle: Eduard Buchner and the growth of biochemical knowledge (
 PDF) (en anglès). València: Universitat de València, 1997. ISBN 978-8-437-03328-0.
PDF) (en anglès). València: Universitat de València, 1997. ISBN 978-8-437-03328-0. - Lerner, Louise. «7 things you may not know about catalysis» (en anglès). Argonne National Laboratory, 2011.
- Lindlar, H.; Dubuis, R. «Palladium Catalyst for Partial Reduction of Acetylenes» (en anglès). OrgSynth, 5, 2016. DOI: 10.15227/orgsyn.046.0089.
- Lindström, Bård; Petterson, Lars J. «A brief history of catalysis» (
 PDF) (en anglès). Cattech, 7(4), 2003.
PDF) (en anglès). Cattech, 7(4), 2003. - Masel, Richard I. Chemical Kinetics and Catalysis (en anglès). Nova York: Wiley-Interscience, 2001.
- Matthiesen, J.; Wendt, S.; Hansen, JØ; Madsen, G. K. «Observation of All the Intermediate Steps of a Chemical Reaction on an Oxide Surface by Scanning Tunneling Microscopy» (en anglès). ACS Nano, 3(3), 2009. DOI: 10.1021/nn8008245. ISSN: 1520-605X. PMID: 19309169.
- Melchiorre, Paolo «Introduction: Photochemical Catalytic Processes» (en anglès). Chemical Reviews, 122(2), 2022. DOI: 10.1021/acs.chemrev.1c00993. PMID: 35078320.
- Mitch, Jacoby «Making Water Step by Step» (en anglès). Chemical & Engineering News, febrer 2009.
- Mitchell, Sharon; Pérez-Ramírez, Javier «Single atom catalysis: a decade of stunning progress and the promise for a bright future» (en anglès). Nature Communications, 11(1), agost 2020. DOI: 10.1038/s41467-020-18182-5. ISSN: 2041-1723.
- Mitscherlich, E. «Ueber die Aetherbildung» (en alemany). Annalen der Physik und Chemie, 31(18), 1834. Bibcode: 1834AnP...107..273M. DOI: 10.1002/andp.18341071802.
- Nelson, D. L.; Cox, M. M.. Lehninger, Principles of Biochemistry (en anglès). Nova York: Worth Publishing, 2000.
- Nicholas, Christopher P. «Dehydration, Dienes, High Octane, and High Pressures: Contributions from Vladimir Nikolaevich Ipatieff, a Father of Catalysis» (en anglès). ACS Catalysis, 8(9), agost 2018. DOI: 10.1021/acscatal.8b02310.
- Ouyang, Mengyao; Papanikolaou, Konstantinos G.; Boubnov, Alexey; Hoffman, Adam S. «Directing reaction pathways via in situ control of active site geometries in PdAu single-atom alloy catalysts» (en anglès). Nature Communications, 12(1), març 2021. DOI: 10.1038/s41467-021-21555-z. ISSN: 2041-1723.
- Parfenov, Mikhail V.; Pirutko, Larisa V. «Oxidation of ethylene to acetaldehyde by N2O on Na-modified FeZSM-5 zeolite» (en anglès). Reaction Kinetics, Mechanisms and Catalysis, 127(2), agost 2019. DOI: 10.1007/s11144-019-01610-z. ISSN: 1878-5204.
- Partington, J. R.. A Short History of Chemistry (en anglès). Dover, 1989.
- Rayner-Canham, Marelene; Rayner-Canham, Geoffrey William. Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century (en anglès). American Chemical Society, 2001. ISBN 978-0-841-23522-9.
- Roberts, M. W. «Birth of the catalytic concept (1800–1900)» (en anglès). Catalysis Letters, 67(1), 2000. DOI: 10.1023/A:1016622806065.
- Robertson, A. J. B.. Catalysis of Gas Reactions by Metals (en anglès). Londres: Logos Press, 1970.
- Roelz, M.; Butschke, B.; Breit, B. «Azobenzene-Integrated NHC Ligands: A Versatile Platform for Visible-Light-Switchable Metal Catalysis» (en anglès). Journal of the American Chemical Society, 146(19), maig 2024. DOI: 10.1021/jacs.4c01138. PMID: 38709955.
- Schuffenecker, L.; Scacchi, G.; Proust, B.; Foucaut, J. F.. Thermodynamique et cinétique chimiques (en francès). Éd. Tec & doc, 1991 (Info chimie).
- Shafiq, Iqrash; Shafique, Sumeer; Akhter, Parveen; Yang, Wenshu; Hussain, Murid «Recent developments in alumina supported hydrodesulfurization catalysts for the production of sulfur-free refinery products: A technical review» (en anglès). Catalysis Reviews, 64(1), juny 2020. DOI: 10.1080/01614940.2020.1780824. ISSN: 0161-4940.
- Shang, Huishan; Zhou, Xiangyi; Dong, Juncai; Li, Ang «Engineering unsymmetrically coordinated Cu-S1N3 single atom sites with enhanced oxygen reduction activity» (en anglès). Nature Communications, 11(1), juny 2020. DOI: 10.1038/s41467-020-16848-8. ISSN: 2041-1723.
- Sikora, Emőke; Kiss, Adrienn; Pekker, Péter «Fine-tuning the catalytic activity by applying nitrogen-doped carbon nanotubes as catalyst supports for the hydrogenation of olefins» (en anglès). Reaction Kinetics, Mechanisms and Catalysis, desembre 2019. DOI: 10.1007/s11144-019-01705-7. ISSN: 1878-5204.
- Smil, Vaclav. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production (en anglès). Cambridge, MA: MIT, 2004. ISBN 978-0-262-69313-4.
- Solovev, Alexander A.; Sánchez, Samuel; Mei, Yongfeng; Schmidt, Oliver G. «Tunable catalytic tubular micro-pumps operating at low concentrations of hydrogen peroxide» (
 PDF) (en anglès). Physical Chemistry Chemical Physics, 13(21), 2011. Arxivat de l'original el 2019-03-28. Bibcode: 2011PCCP...1310131S. DOI: 10.1039/C1CP20542K. PMID: 21505711 [Consulta: 9 novembre 2024].
PDF) (en anglès). Physical Chemistry Chemical Physics, 13(21), 2011. Arxivat de l'original el 2019-03-28. Bibcode: 2011PCCP...1310131S. DOI: 10.1039/C1CP20542K. PMID: 21505711 [Consulta: 9 novembre 2024]. - Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. Chemical Kinetics and Dynamics (en anglès). Prentice Hall, 1999.
- Sun, Guodong; Zhao, Zhi-Jian; Mu, Rentao; Zha, Shenjun «Breaking the scaling relationship via thermally stable Pt/Cu single atom alloys for catalytic dehydrogenation» (en anglès). Nature Communications, 9(1), octubre 2018. DOI: 10.1038/s41467-018-06967-8. ISSN: 2041-1723.
- Torkashvand, Mostafa; Sarabadani Tafreshi, Saeedeh; de Leeuw, Nora H. «Density Functional Theory Study of the Hydrogenation of Carbon Monoxide over the Co (001) Surface: Implications for the Fischer–Tropsch Process» (en anglès). Catalysts, 13(5), maig 2023. DOI: 10.3390/catal13050837. ISSN: 2073-4344.
- Vlatković, Matea; Collins, Beatrice S. L.; Feringa, Ben L. «Dynamic Responsive Systems for Catalytic Function» (en anglès). Chemistry: A European Journal, 22(48), 2016. DOI: 10.1002/chem.201602453. PMID: 27717167.
- Yang, Hongzhou; Shang, Lu; Zhang, Qinghua; Shi, Run «A universal ligand mediated method for large scale synthesis of transition metal single atom catalysts» (en anglès). Nature Communications, 10(1), octubre 2019. DOI: 10.1038/s41467-019-12510-0. ISSN: 2041-1723.
- Yang, Hengpan; Lin, Qing; Zhang, Chao; Yu, Xinyao «Carbon dioxide electroreduction on single-atom nickel decorated carbon membranes with industry compatible current densities» (en anglès). Nature Communications, 11(1), gener 2020. DOI: 10.1038/s41467-020-14402-0. ISSN: 2041-1723.