Hipòtesi del ciclol
|
|
Aquest article o secció necessita millorar una traducció deficient. |


La hipòtesi del ciclol és una teoria científica obsoleta considerada el primer model estructural creat per descriure el plegament d'una proteïna globular.[1] Va ser proposada per la matemàtica anglesa Dorothy Wrinch a la fi dels anys 1930 basant-se en tres premisses. Primera, la hipòtesi assumeix que dos grups peptídics poden unir-se mitjançant la reacció del ciclol, formant enllaços covalents anàlegs a enllaços d'hidrogen. Aquestes reaccions van ser observades en els ergopéptidos i altres compostos. En segon lloc assumeix que, en determinades condicions, els aminoàcids tendeixen naturalment a formar el màxim nombre possible d'«enllaços ciclol», donant lloc a molècules de cicloles i estructures de cicloles. Ambdues estructures hipotètiques no han estat mai observades. Finalment, la hipòtesi suposa que les proteïnes globulars tenen una estructura terciària que es correspon amb els sòlids platònics i els poliedres semirregulares formats per estructures de ciclol sense vores lliures. Aquests «cicloles tancats» tampoc han estat observats experimentalment.
Encara que les dades experimentals obtingudes en el laboratori van demostrar que aquest model no es correspon amb la realitat, alguns dels seus elements, com la reacció del ciclol i la hipòtesi de la interacció hidròfoba, són part fonamental del plegament de proteïnes. La hipòtesi del ciclol va obrir el camí a la recerca de molts científics entorn de l'estructura de les proteïnes i la seva reactivitat i va ser la precursora dels models hipotètics de la doble hèlix d'ADN i l'estructura secundària de les proteïnes. La proposta de Wrinch i la comprovació del model es consideren, en la literatura científica, un exemple excel·lent d'aplicació del falsacionisme empíric com a part del mètode científic.
Context històric
[modifica]A mitjan anys 1930 els estudis de ultracentrifugación analítica de Theodor Svedberg van mostrar que les proteïnes posseïen una estructura química definida i no eren un conjunt de petites molècules.[2] Els mateixos estudis aparentment mostraven que el pes molecular de les proteïnes podien classificar-se en uns grups ben definits per nombres enters, com Pmolecular = 2p3q uma, on p i q eren sencers i positius.[3][4] No obstant això, resultava complicat determinar el pes molecular exacte i el nombre d'aminoàcids d'una proteïna. Svedberg també va demostrar que un canvi de les condicions de la dissolució podia causar que la proteïna es desintegrés en unitats menors, un fet que no semblava coincidir amb el conegut sobre l'estructura quaternària.[5]
En aquella època encara es discutia sobre l'estructura química de les proteïnes.[6] La hipòtesi més acceptada, i que després es demostraria correcta, és que les proteïnes eren polipèptids lineares, això és, polímers no ramificats d'aminoàcids units per enllaç peptídic.[7][8] No obstant això, una proteïna típica és un polímer molt llarg, format per centenars d'aminoàcids, per la qual cosa bastants científics distingits discutien si una macromolècula tan llarga i lineal podia ser estable en dissolució.[9][10] A més, l'observació experimental que alguns enzims eren capaços de trencar proteïnes però no pèptids, mentre que unes altres dividien pèptids però no proteïnes plegades provocava seriosos dubtes.[11] Els intents de síntesis de proteïnes en tubs d'assaig van ser fallits, deguts principalment a la quiralidad dels aminoàcids, doncs les proteïnes naturals estan compostes exclusivament d'aminoàcids levógiros. Tots aquests dubtes van fer que es consideressin altres models de proteïnes, com la «hipòtesi de la dicetopiperacina» de Emil Abderhalden.[12][13] No obstant això, cap model alternatiu va ser capaç d'explicar per què les proteïnes alliberaven només aminoàcids i pèptids per hidròlisis i proteólisis. Com va aclarir Linderstrøm-Lang, aquestes dades experimentals mostraven que les proteïnes desnaturalitzades eren polipèptids, però no aportaven informació sobre l'estructura o el plegament d'aquestes macromolècules, doncs la desnaturalització podia provocar una transformació química que convertís en polipèptids senzills a les proteïnes.[14]
Els processos de desnaturalització de proteïnes, una vegada diferenciats de la coagulació, van ser descoberts en 1910 per Harriette Chick i Charles Martin, però la seva naturalesa exacta seguia sent un misteri.[15][16][17][18] Tim Anson i Alfred Mirsky van demostrar que la desnaturalització era un «procés reversible en dues fases» que donava com a resultat que molts grups funcionals anteriorment plegats estiguessin disponibles per reaccionar, incloent la possibilitat que un enzim tallés la cadena.[19][20] En 1929, Hsien Wu va proposar correctament que la desnaturalització es produïa pel desplegament de les proteïnes, un canvi purament conformacional que provocava l'exposició de les cadenes d'aminoàcids al dissolvent o a altres reactius.[21] La hipòtesi de Wu va ser també proposada independentment en 1936 per Mirsky i Linus Pauling.[22] No obstant això, els científics no podien encara excloure la possibilitat que la desnaturalització fos un canvi «químic» en l'estructura de la proteïna, una hipòtesi que va ser considerada plausible, encara que remota, fins als anys 1950.[20][23][24]

La cristal·lografia de rajos X va començar com a disciplina en 1911[25] i havia avançat ràpidament des de l'estudi de cristalls de sals senzilles a molècules més complexes, com el colesterol.[26] No obstant això, fins a la proteïna més petita té almenys mil àtoms, la qual cosa fa que la seva determinació estructural sigui molt més complexa. En 1934, Dorothy Crowfoot Hodgkin[27] va obtenir dades cristalográficos de l'estructura d'una proteïna petita, la insulina, encara que la seva estructura final no va ser elucidada fins a finals dels anys 1960.[28] No obstant això, les primeres dades de difracció de fibres amb rajos X de escleroproteínas (proteïnes amb estructura de fibra) naturals com la llana o el pèl van ser obtinguts a principis dels anys 1930 per William Astbury, que va proposar alguns models rudimentaris per a l'estructura secundària, com la presència d'hèlixs alfa i beta-làmines.[29][30]
De la mateixa manera que l'estructura proteica estava poc estudiada en la dècada de 1930, les interaccions físiques responsables de l'estabilització de l'estructura resultaven un misteri. Astbury va proposar que l'estructura de les proteïnes fibroses s'estabilitzava mitjançant enllaços d'hidrogen en les làmines β.[31][32] La idea que les proteïnes globulars també s'estabilitzaven per puntes d'hidrogen va ser proposada per Dorothy Jordan Lloyd[33][34] en 1932, i defensada posteriorment per Mirsky i Pauling.[22] En una conferència de Astbury en 1933 a l'Oxford Junior Scientific Society, el físic Frederick Frank va suggerir que la α-queratina, una escleroproteína, podria estabilitzar-se gràcies a un mecanisme alternatiu, la interacció covalent entre els enllaços peptídics segons la reacció del ciclol.[35] Aquesta estructura de cicloles permet que els dos grups peptídics es col·loquin a prop (els àtoms de nitrogen i carboni se situarien a ~1.5 Å, mentre que mitjançant enllaços d'hidrogen se situen a ~3 Å). Considerant la proposta de Frank, J. D. Bernal va suggerir a la matemàtica Dorothy Wrinch que explorés aquesta possibilitat per entendre l'estructura de les proteïnes.[36]
Teoria
[modifica]
Dorothy Maud Wrinch va proposar un model complet per explicar l'estructura de les proteïnes basat en la hipòtesi del ciclol. El model bàsic del ciclol va aparèixer per primera vegada en un article de 1936.[37] En ell, Wrinch mostra que els polipèptids poden formar cicles (hipòtesi que es va demostrar correcta) i que aquests anells poden presentar interaccions enllaçants internes mitjançant la reacció del ciclol, hipòtesi que és certa, però que després es va demostrar infreqüent en les proteïnes. Assumint que la forma de ciclol de l'enllaç peptídic pot ser més estable que en forma d'amida, Wrinch va concloure que certs pèptids cíclics formaran el màxim nombre possible d'enllaços tipus ciclol (com el ciclol 6, en la figura). Aquestes molècules tipus ciclol tindrien simetria hexagonal si els enllaços químics tenen la mateixa longitud, aproximadament 1,5 Å; en comparació, els enllacis nitrogen-carboni i C-C tenen una longitud d'1,42 Å i 1,54 Å, respectivament.[38]
Aquests anells poden estendre's indefinidament per formar una estructura de cicloles, que mostren un ordre extens i gairebé cristal·lí que Wrinch va proposar com a adequat per englobar centenars de residus d'aminoàcids, com en el cas d'una proteïna.[39] A més, les seves cadenes laterals apunten axialment cap amunt només des d'una cara, és a dir, una de les cares de l'estructura és completament independent de l'estructura primària del pèptid, la qual cosa podria explicar les propietats independents de la seqüència de la cadena que mostren les proteïnes.[37]
En el seu article inicial, Wrinch exposa clarament que el model del ciclol és simplement una «hipòtesi de treball», una hipòtesi potencialment vàlida que havia de contrastar-se amb les dades empíriques. El seu èxit radica a proposar un model ben definit i examinable, de tal manera que es podia utilitzar per predir resultats experimentals.[40] No obstant això, els experiments realitzats en els anys següents van demostrar que la hipòtesi del ciclol no era vàlida per a les proteïnes globulars.[38]
Energia d'estabilització
[modifica]En dues cartes conjuntes al director (1936), Wrinch i Frank contesten a la pregunta de si la forma de ciclol per al grup peptídic és més estable que la forma d'amida.[41][42] Les amidas es formen a partir dels grups amino dels aminoàcids segons els següents mecanismes:

A més, les amidas estan fortament estabilitzades per efecte mesómero: el parell d'electrons lliures del nitrogen es deslocalitza en el carbonil, formant un doble enllaç parcial. L'acetamida resultant és descrita alhora per les dues formes ressonants, col·laborant la primera en un 62% i la segona en un 28%.[43]

Un càlcul relativament simple mostra que la forma de ciclol és significativament menys estable que l'amida, per la qual cosa el model hauria d'haver estat abandonat fins a identificar un efecte que compensés l'energia. Inicialment Frank va proposar que la forma de ciclol podia estabilitzar-se per les seves interaccions amb el dissolvent; posteriorment, Wrinch i Irving Langmuir van presentar la hipòtesi que la interacció hidròfoba de les cadenes laterals, apolares, proporciona la suficient energia d'estabilització per compensar el cost energètic dels cicloles.[44][45]

La labilidad de l'enllaç del ciclol es va considerar un «avantatge» del model, ja que proporcionava una explicació directa per a la desnaturalització: la reversió dels cicloles a les amidas, més estables, obria l'estructura i permetia que els enllaços anessin atacats per proteasas, dades a priori consistents amb els resultats experimentals.[46][47] Els primers estudis van mostrar que les proteïnes desnaturalitzades per pressió es trobaven freqüentment en un estat diferent a les mateixes proteïnes desnaturalitzades per alta temperatura, la qual cosa va ser interpretat com una confirmació del model del ciclol.[48]
La hipòtesi de Langmuir i Wrinch de l'estabilització hidrofòbica va ser desestimada al mateix temps que la hipòtesi del ciclol, hagut de principalment a la influència de Linus Pauling, defensor de l'estabilització per enllaços d'hidrogen.[49] Van haver de passar vint anys perquè les interaccions hidròfobes fossin reconegudes com els agents principals del plegament en les proteïnes.[50]
Complementarietat estérica
[modifica]En el seu tercer article sobre els cicloles, (1936), Wrinch fa notar que moltes substàncies «fisiològicament actives», com els esteroides estaven formades per anells de carboni hexagonals, derivats del benzè, que podien actuar com a complements estéricos de la cara de les estructures de cicloles sense cadenes laterals d'aminoàcids.[51] Wrinch va presentar aquesta complementarietat com un dels factors predominants per determinar si una molècula petita podia enllaçar-se amb molècules semblants formant una proteïna.
En el mateix article especula, encertadament, sobre com les proteïnes havien de ser les responsables de la síntesi de totes les molècules biològiques. Observant que les cèl·lules només digereixen les seves proteïnes en condicions de gana extrema, va proposar que la vida no podria existir sense proteïnes.[38]
Models híbrids
[modifica]Des del principi la reacció del ciclol va ser considerada un anàleg covalent de l'enllaç d'hidrogen, per la qual cosa era normal considerar models híbrids amb tots dos tipus d'enllaços. Aquest va ser el tema del quart article de Wrinch sobre el model del ciclol (1936), escrit conjuntament amb Dorothy Jordan Lloyd, que va proposar al principi que les molècules globulars s'estabilitzaven per enllaços d'hidrogen.[52][33] Li va seguir un nou article, escrit en 1937, que incloïa les recerques sobre l'enllaç d'hidrogen en proteïnes, com les de Maurice Loyal Huggins i Linus Pauling.[53]
Wrinch també va escriure un article amb William Astbury, presentant la possibilitat que la tautomeria ceto-enólica del >CαHα i el carbonil d'un grup amida >C=O, formessin un enllaç mixt >Cα-C(OHα)< deixant lliure un oxigen per al grup hidroxil.[54] El mecanisme general de la tautomeria ceto-enólica és el següent:
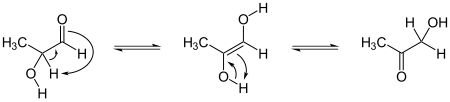
Aquestes reaccions poden produir anells de cinc àtoms, mentre que la hipòtesi del ciclol clàssica els forma sempre de sis baules. Aquesta hipòtesi aviat va caure en l'oblit.[55]
Estructures tridimensionals
[modifica]
En el seu cinquè article sobre els cicloles (1937), Wrinch va identificar les condicions sota les quals dues estructures tipus ciclol planes podien unir-se per formar un nou angle entre els seus plànols respectant els seus angles d'enllaç.[56] En l'article proposa una simplificació matemàtica, en la qual anells de sis baules no plans poden ser assimilats a mitjos hexàgons construïts pels punts mitjans dels enllaços químics. Aquesta representació de «mitjos hexàgons» permet que els plànols d'estructures de cicloles s'uneixin correctament si l'angle diedre entre els plànols s'iguala a l'angle tetraèdric, δ = arccos(-1/3) ≈ 109,47°.
Usant aquest mateix criteri es poden proposar una gran quantitat de poliedres, entre els quals els més simples són el tetraedre truncat, l'octàedre truncat i l'octàedre, que són sòlids platònics i poliedres semirregulares. Considerant la primera sèrie de «cicloles tancats», aquells modelatges a partir del tetraedre truncat, Wrinch va demostrar que el nombre d'aminoàcids creixia de forma quadràtica segons l'expressió 72n2, on n és l'índex del ciclol Cn. D'aquesta forma, el ciclol C1 té 72 residus, el C2 288 residus, etcètera. Els experiments preliminars de Max Bergmann i Carl Niemann semblaven confirmar aquesta hipòtesi, perquè suggerien que les proteïnes estaven compostes per múltiples sencers de 288 aminoàcids (corresponent a n=2).[4] Més generalment, el model del ciclol per a proteïnes globulars era consistent amb les dades experimentals obtingudes per ultracentrifugación per Theodor Svedberg, la qual cosa suggeria que el pes molecular de les proteïnes podia assimilar-se a unes poques classes de nombres enters.[2][3]
El model del ciclol es va mostrar consistent amb les propietats característiques que presenten les proteïnes plegades.[57] En primer lloc, els estudis mitjançant centrifugació van concloure que les proteïnes plegades eren significativament més denses que l'aigua (~1.4 g/ml), per la qual cosa havien d'estar fermament empaquetades; Wrinch va assumir que un empaquetat dens implicava una estructura regular. En segon lloc, malgrat la seva gran grandària, algunes proteïnes cristal·litzaven ràpidament formant cristalls simètrics, un fet consistent amb la idea de cares simètriques capaces d'encaixar entre si. En tercer lloc, algunes proteïnes, com l'hemoglobina, poden formar enllaços organometálicos; com els metalls de transició presenten geometries d'enllaç específiques i regulars (per exemple octaèdriques), es veia plausible que la proteïna globalment tingués una estructura geomètrica similar. En quart lloc, la hipòtesi del ciclol proporciona una explicació químicament simple per a la desnaturalització i la dificultat de trencar proteïnes plegades mitjançant proteasas. En cinquè lloc, se suposava que les proteïnes eren les responsables de la síntesi de totes les molècules biològiques, incloent altres proteïnes. Wrinch va observar que una estructura uniforme podia ser molt útil per a la síntesi d'altres proteïnes, anàlogament al model de autorreplicación de l'ADN proposat per Watson i Crick. Atès que moltes molècules biològiques com els carbohidrats i els esteroles tenen una estructura hexagonal, es podia assumir que les proteïnes que els sintetitzaven també tenien una estructura hexaédrica. Wrinch finalment va resumir el seu model i les dades experimentals que semblaven confirmar-ho en tres articles.[58][59][60]
Predicció d'estructures
[modifica]Després d'haver proposat un model plausible per al plegament de les proteïnes globulars, Wrinch va investigar si era consistent amb les dades estructurals disponibles en aquell temps. Entre 1937 i 1939 va proposar la possibilitat que la proteïna tuberculina bovina (523) fos un ciclol tancat C1 de 72 residus i que la pepsina, un enzim digestiu descobert en 1836 per Theodor Schwann[61] i cristal·litzada en 1929 per John H. Northrop, fora un ciclol tancat C2 de 288 aminoàcids.[62][63][64][65] Amb els mètodes coneguts en la dècada de 1930 resultava altament complicat i inexacte mesurar la massa de les proteïnes, per la qual cosa no es disposava de suficients dades experimentals per contrastar les seves hipòtesis.
Amb el mateix model, Wrinch també va predir que l'estructura de la insulina corresponia a un C2, usant les escasses dades de cristal·lografia de rajos X disponibles llavors per confirmar la seva proposta.[66][67][68][69][70][71] No obstant això, aquesta interpretació va ser molt criticada per prematura.[72][73][74] Estudis exhaustius dels diagrames de Patterson de la insulina realitzats per Dorothy Crowfoot Hodgkin van mostrar que la seva estructura s'ajustava amb certa dificultat al model del ciclol, però no eren prou concloents com per confirmar definitivament la teoria.[75][76][77]
Desestimació
[modifica]
Les estructures de tipus ciclol es van considerar no plausibles per diverses raons. Hans Neurath i Henry Bull van demostrar que el dens empaquetat de les cadenes laterals dels cicloles eren inconsistents amb la densitat experimental observada en pel·lícules proteínicas.[78] Maurice Huggins va calcular que bastants dels àtoms no enllaçats de les estructures de cicloles estaven més prop del que permeten els radis de van der Waals; per exemple, l'Hα interior i el Cα dels espais intramoleculares estarien separats per només 1,68 Å, una longitud lleugerament menor del radi de van der Waals mitjà del carboni, d'1,70 Å.[79] Per la seva banda, Haurowitz va demostrar químicament que l'exterior de les proteïnes no podia albergar un gran nombre de grups hidroxils, una de les claus del model del ciclol, mentre que Meyer i Hohenemser van demostrar que les condensacions de tipus ciclol dels aminoàcids simplement no existien en les proteïnes naturals ni tan sols en els estats de transició.[80][81]
Bergmann i Niemann van proporcionar més arguments químics en contra de la hipòtesi del ciclol, com va fer també Neuberger.[82][83][84] Les dades obtingudes mitjançant espectroscòpia d'infraroig mostraven que el nombre de grups carbonil presents en una proteïna no canviaven després d'una hidròlisi, i que les proteïnes plegades i intactes contenien grups amida-carbonil complementaris; ambdues observacions contradiuen la hipòtesi del ciclol que els carbonils es transformen en hidroxils en les proteïnes plegades.[85][86]
Finalment, es va descobrir que les proteïnes contenen prolina en quantitats significatives (típicament un 5%); ja que la prolina no disposa d'un àtom d'hidrogen en un grup amida i el nitrogen existent forma ja tres enllaços covalents, és incapaç d'actuar segons la reacció del ciclol i, per tant, no pot incorporar-se a una estructura de cicloles. Tots els arguments químics i estructurals en contra de la hipòtesi del ciclol van ser resumits per Pauling i Niemann en 1939.[87] A més, el mateix any es va demostrar que una de les dades experimentals fonamentals per confirmar la hipòtesi del ciclol, l'afirmació que totes les proteïnes contenien un múltiple sencer de 288 aminoàcids, era errònia.[4][88]
Wrinch va respondre a totes aquestes qüestions en diversos articles. Respecte als impediments estéricos per excessiva proximitat dels àtoms, va proposar que petites deformacions en els angles i longituds d'enllaç podien alleujar els impediments o almenys reduir-los a un nivell raonable.[89] També va destacar que les distàncies entre dos grups no enllaçats en una mateixa molècula poden ser menors de l'esperat segons les seves ràdios de van der Waals, com la distància de 2,93 Å entre els grups metil en el hexametilbenceno. Respecte als nivells d'energia, Wrinch es va mostrar en desacord amb els càlculs de Pauling i va recordar que se sabia massa poc sobre les energies intramoleculares en macromolècules com per descartar a priori la hipòtesi del ciclol.[89]
Respecte als arguments químics en contra de la seva hipòtesi, va proposar que les reaccions bimoleculares simples estudiades no havien de correspondre necessàriament amb les estructures de cicloles, doncs els impediments estéricos podrien haver impedit la reactivitat dels grups hidroxil.[90]
Respecte al càlcul del nombre d'aminoàcids per proteïna, Wrinch va ampliar el seu model original per permetre altres nombres enters d'aminoàcids. En particular, va introduir un ciclol tancat mínim de només 48 residus, a partir del qual va predir, incorrectament, que el monòmer d'insulina tindria un pes molecular d'aproximadament 6.000 uma.[91][92][93]
Malgrat totes les crítiques, Wrinch va mantenir que la hipòtesi del ciclol per a proteïnes globulars era potencialment viable i fins i tot va proposar una estructura de cicloles per al citoesquelet.[94][95][96] No obstant això, la majoria dels científics dedicats a l'estudi de les proteïnes van deixar de considerar el model com a plausible i Wrinch es va dedicar a resoldre qüestions matemàtiques relacionades amb la cristal·lografia de rajos X, disciplina en la qual va aconseguir contribucions notables.[97]
Una excepció va ser el metge Gladys Anslow, col·lega de Wrinch en el Smith College, que va estudiar els espectres d'absorció ultraviolada de nombrosos pèptids i proteïnes en la dècada de 1940 considerant el model del ciclol com una de les solucions.[98][99] Quan es va determinar la seqüència de la insulina per part de Frederick Sanger, Anslow va proposar un model tridimensional de cicloles amb cadenes laterals, basat en el «ciclol mínim» descrit per Wrinch en 1948.[100][91]
Redempció parcial
[modifica]
La desestimació de tot el model del ciclol va portar al rebuig de tots els seus elements, excepte la breu acceptació per part de J. D. Bernal de la hipòtesi plantejada per Langmuir i Wrinch que el plegament de les proteïnes es devia a la interacció hidrofòbica.[102] Malgrat això, es van identificar enllaços de cicloles naturals en pèptids cíclics en la dècada de 1950.[38]
Actualment, es considera que la reacció clàssica del ciclol consisteix en l'addició d'un grup amina NH procedent d'un enllaç peptídic que s'uneix a un carbonil C=O d'un altre aminoàcid. El compost resultant es denomina azaciclol. Per analogia, un oxaciclol es forma quan l'OH d'un hidroxil s'uneix al carbonil i un tiociclol quan el grup que s'uneix és un SH.[103]
El oxaciclol alcaloide ergotamina, extret del fong Claviceps purpurea va ser el primer ciclol natural identificat.[104] La serratamilida, un depsipéptido cíclic, també es forma mitjançant la reacció del oxociclol.[105] També s'han obtingut tiocicloles químicament anàlegs, mentre que els clàssics azacicloles han estat observats en petites molècules i tripéptidos.[106][107][108][109][110]
Es poden formar pèptids naturalment per reversió dels azacicloles, un dels aspectes clau en la hipòtesi del ciclol.[111][112][113]
En l'actualitat s'han identificat centenars de molècules de tipus ciclol, malgrat el càlcul de Linus Pauling que aquestes molècules no podrien existir per estar termodinámicamente desfavorides, a l'ésser d'alta energia.[87]
Després d'un llarg període en el qual va treballar principalment en els aspectes matemàtics de la cristal·lografia de rajos X, en 1957 Wrinch va recollir els nous descobriments sobre cicloles i va renovar el model teòric proposat vint anys abans.[114][115][116][117][118] També va publicar dos llibres en els quals va descriure de nou la hipòtesi del ciclol i els petits pèptids en general.[119][97]
Il·lustració del mètode científic
[modifica]La hipòtesi del ciclol per a l'estructura de les proteïnes és un exemple de l'aplicació del falsacionisme empíric com a part del mètode científic. Es proposa una hipòtesi original per explicar observacions experimentals; es desenvolupen les conseqüències d'aquesta hipòtesi i les seves prediccions són comprovades en laboratori. En aquest cas la hipòtesi central era que la forma de ciclol del grup peptídic estava afavorida enfront de l'amida. Aquesta proposta va comportar les prediccions sobre la molècula de ciclol-6 i de l'estructura de cicloles, que al seu torn suggerien el model de poliedres semirregulares per a les proteïnes globulars. L'estudi experimental havia de demostrar si els grups carbonil de la proteïna es transformaven massivament en hidroxils. No obstant això, les dades químiques i espectroscòpics van demostrar que l'estructura era incorrecta.[97] El model del ciclol també predeia una alta densitat lateral d'aminoàcids en les proteïnes plegades i en pel·lícula, que no es va observar experimentalment. A causa d'aquests factors, la hipòtesi va ser desestimada i es van buscar alternatives, com l'estructura d'alfa hèlix proposada en les dècades de 1940 i 1950.[120]
Alguns autors han argumentat que la hipòtesi del ciclol mai va haver de ser considerada a causa dels seus defectes de partida, v.gr. els impediments estéricos, la impossibilitat d'acomodar la prolina i l'energia desfavorable de la reacció en si.[121][38] No obstant això, l'opinió general és que, si bé aquests defectes la feien poc plausible, no la convertien en impossible. El model de cicloles va ser la primera estructura ben definida proposta per a proteïnes globulars i, quan es va presentar, es coneixien massa pocs aspectes de les forces intramoleculares i de l'estructura de macromolècules com per descartar-la immediatament. Era capaç d'explicar la majoria de les propietats generals de les proteïnes i s'ajustava a les dades experimentals, que després es van revelar inexactes. Encara que es va demostrar incorrecta, alguns elements de la teoria del ciclol van ser eventualment verificats, com la pròpia reacció i el paper de les interaccions hidrofòbiques en el plegament de proteïnes. És, en certa manera, comparable al model de Bohr per a l'àtom d'hidrogen, que des del principi se sabia inexacte, fins i tot per part del seu creador, però així i tot va ajudar decisivament al desenvolupament de la mecànica quàntica.[38][122][123][124][125] De manera similar, el model per a l'ADN proposat per Linus Pauling, que, igual que el ciclol, va resultar erroni però va actuar com a al·licient per al treball d'altres investigadors.[126][127][128] La història de tota la hipòtesi del ciclol és un exemple de com el coneixement científic es desenvolupa proposant hipòtesi, comprovant-les i descartant les errònies.
Curiosament, el model del ciclol és un exemple de com una teoria científica de gran simetria i bellesa, dues qualitats que solen caracteritzar a les teories científiques «òbviament certes», es revela errònia. Per exemple, la doble hèlix de Watson i Crick com a model per a l'ADN és un model «obvi» pels seus enllaços d'hidrogen i simetria, mentre que altres estructures molt menys simètriques estan afavorides en condicions diferents.[128][129] També la teoria de la relativitat general va ser considerada una hipòtesi tan «elegant» que para Albert Einstein no semblava necessitar verificació experimental, encara que va haver de revisar-se per fer-la consistent amb la teoria quàntica de camps.[130] L'exemple de la hipòtesi del ciclol il·lustra com totes les teories científiques, fins i tot les més elegants, han de ser verificades empíricament i mai ser considerades certes a priori.[131]
Vegeu també
[modifica]- L'estructura de les revolucions científiques.
- La lògica de la recerca científica, de Karl Popper.
Referències
[modifica]- ↑ Tiselius, A «The Chemistry of Proteins and Amino Acids». Annual Review of Biochemistry, 8, 1939, pàg. 155–184. DOI: 10.1146/annurev.bi.08.070139.001103.
- ↑ 2,0 2,1 Svedberg, T «Mass and size of protein molecules». Nature, 123, 1929, pàg. 871. DOI: 10.1038/123871a0.
- ↑ 3,0 3,1 Svedberg, T «Sedimentation of molecules in centrifugal fields». Chemical Reviews, 14, 1934, pàg. 1–15. DOI: 10.1021/cr60047a001.
- ↑ 4,0 4,1 4,2 Bergmann, M; Niemann C «On the structure of proteins: cattle hemoglobin, egg albumin, cattle fibrin, and gelatin». Journal of Biological Chemistry, 118, 1937, pàg. 301–314.
- ↑ Svedberg, T «The pH Stability Regions of Proteins». Transactions of the Faraday Society, 26, 1930, pàg. 741–744.
- ↑ Fruton, JS «Early theories of protein structure». Ann. N.Y. Acad. Sci., 325, 1979, pàg. 1–18. DOI: 10.1111/j.1749-6632.1979.tb14125.x.
- ↑ Hofmeister, F «Über Bau und Gruppierung der Eiweisskörper». Ergebnisse der Physiologie, 1, 1902, pàg. 759–802.
- ↑ Fischer, E «Über die Hydrolyse der Proteinstoffe». Chemiker Zeitung, 26, 1902, pàg. 939–940.
- ↑ Fischer, E «Synthese von Depsiden, Flechtenstoffen und Gerbstoffen». Berichte der deutschen chemischen Gesellschaft, 46, 1913, pàg. 3253–3289. DOI: 10.1002/cber.191304603109.
- ↑ Sørensen, SPL «The constitution of soluble proteins as reversibly dissociable component systems». Comptes rendus des travaux du Laboratoire Carlsberg, 18, 1930, pàg. 1–124.
- ↑ Fruton, JS. Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology. New Haven, CT: Yale University Press, 1999.
- ↑ Abderhalden, E «Diketopiperazines». Naturwissenschaften, 12, 1924, pàg. 716.
- ↑ Abderhalden, E; Komm E «Über die Anhydridstruktur der Proteine». Zeitschrift für physiologische Chemie, 139, 1924, pàg. 181–204.
- ↑ Linderstrøm-Lang, K; Hotchkiss RD, Johansen G «Peptide Bonds in Globular Proteins». Nature, 142, 1938, pàg. 996. DOI: 10.1038/142996a0.
- ↑ Chick, H; Martin CJ «On the "Heat" Coagulation of Proteins». Journal of Physiology, 40, 1910, pàg. 404–430.
- ↑ Chick, H; Martin CJ «On the "Heat" Coagulation of Proteins. II. The Action of Hot Water upon Egg-albumen and the Influence of Acid and Salts upon Reaction Velocity». Journal of Physiology, 43, 1911, pàg. 1–27.
- ↑ Chick, H; Martin CJ «On the "Heat" Coagulation of Proteins. III. The Influence of Alkali upon Reaction Velocity». Journal of Physiology, 45, 1912, pàg. 61–69.
- ↑ Chick, H; Martin CJ «On the "Heat" Coagulation of Proteins. IV. The Conditions controlling the Agglutination of Proteins already acted upon by Hot Water». Journal of Physiology, 45, 1912, pàg. 261–295.
- ↑ Anson, ML; Mirsky AE «Protein Coagulation and Its Reversal». Journal of General Physiology, 13, 1929, pàg. 121–132.
- ↑ 20,0 20,1 Anson, ML «Protein Denaturation and the Properties of Protein Groups». Advances in Protein Chemistry, 2, 1945, pàg. 361–386. DOI: 10.1016/S0065-3233(08)60629-4.
- ↑ Wu, H «Studies on Denaturation of Proteins. XIII. A Theory of Denaturation». Chinese Journal of Physiology, 5, 1931, pàg. 321–344.
- ↑ 22,0 22,1 Mirsky, AE; Pauling L «On the Structure of Native, Denatured, and Coagulated Proteins». Proceedings of the National Academy of Science USA, 22, 1936, pàg. 439–447. DOI: 10.1073/pnas.22.7.439.
- ↑ Neurath, H; Greenstein JP, Putnam FW, and Erickson JO «The Chemistry of Protein Denaturation». Chemical Reviews, 34, 1944, pàg. 157–265. DOI: 10.1021/cr60108a003.
- ↑ Putnam, F «Protein Denaturation». The Proteins (H. Neurath and K. Bailey, eds.), 1B, 1953, pàg. 807–892.
- ↑ Bragg WH «The nature of γ- and X-rays». Nature, 77, 1908, pàg. 270. DOI: 10.1038/077270a0.
- ↑ Blow D. Outline of Crystallography for Biologists. Oxford: Oxford University Press, 2002. ISBN 0198510519.
- ↑ Glusker, Jenny P., Margaret J. Adams «Dorothy Crowfoot Hodgkin». Physics Today, 48, 1995, pàg. 80–81. DOI: 10.1063/1.2808036.
- ↑ Guy Dodson «Dorothy Mary Crowfoot Hodgkin, O.M. 12 May 1910--29 July 1994». Biographical Memoirs of Fellows of the Royal Society, 48, 2002, pàg. 179–219.
- ↑ Astbury, W.T.; Street A «X-ray studies of the structures of hair, wool and related fibres. I. General» (en anglès). Trans. R. Soc. Lond., A230, 1931, pàg. 75-101.
- ↑ Huggins, M. «The structure of fibrous proteins». Chemical Reviews, 32, 1943, pàg. 195–218. DOI: 10.1021/cr60102a002.
- ↑ Astbury, WT; Woods HJ «The Molecular Weight of Proteins». Nature, 127, 1931, pàg. 663–665. DOI: 10.1038/127663b0.
- ↑ Astbury, WT «Some Problems in the X-Ray Analysis of the Structure of Animal Hairs and Other Protein Fibres». Transactions of the Faraday Society, 29, 1933, pàg. 193–211. DOI: 10.1039/tf9332900193.
- ↑ 33,0 33,1 Jordan Lloyd, D «Colloidal Structure and its Biological Significance». Biological Review, 7, 1932, pàg. 254–273.
- ↑ Jordan Lloyd, D; Marriott «Title unknown». Transactions of the Faraday Society, 29, 1933, pàg. 1228.
- ↑ Astbury, WT «Unknown title». Journal of the Textile Institute, 27, 1936, pàg. 282–?.
- ↑ Abir-Am, P. G.. «Synergy or Clash: Disciplinary and Marital Strategies in the Career of Mathematical Biologist Dorothy Wrinch». A: P. G. Abir-Am y D. Outram. Uneasy Careers and Intimate Lives, Women in Science 1789-1979 (en anglès). New Brunswick: Rutgers University Press, 1987, p. 239-280. ISBN 9780813512563 [Consulta: 12 desembre 2009].
- ↑ 37,0 37,1 Wrinch, DM «The Pattern of Proteins». Nature, 137, 1936, pàg. 411–412. DOI: 10.1038/137411a0.
- ↑ 38,0 38,1 38,2 38,3 38,4 38,5 Tanford, Charles. Nature's Robots: A History of Proteins (en anglès). Oxford: Oxford University Press, 2001. ISBN 9780198606949 [Consulta: 12 desembre 2009].
- ↑ Cohen, Louis A. «Chemical Aspects of the Structure of Small Peptides. An Introduction» (en anglès). J. Am. Chem. Soc., 83, 21, 1961, pàg. 4488. DOI: 10.1021/ja01482a059.
- ↑ Wrinch, DM. Chemical Aspects of Polypeptide Chain Structures and the Cyclol Theory. Nova York: Plenum Press, 1965.
- ↑ Wrinch, DM «Energy of Formation of 'Cyclol' Molecules». Nature, 138, 1936, pàg. 241–242. DOI: 10.1038/138241a0.
- ↑ Frank, FC «Energy of Formation of 'Cyclol' Molecules». Nature, 138, 1936, pàg. 242. DOI: 10.1038/138242a0.
- ↑ Kemnitz, Carl R. «"Amide Resonance" Correlates with a Breadth of C-N Rotation Barriers» (en anglès). J. Am. Chem. Soc., 129, 9, 2007, pàg. 2521 - 2528. DOI: 10.1021/ja0663024.
- ↑ Langmuir, I; Wrinch DM «Nature of the Cyclol Bond». Nature, 143, 1939, pàg. 49–52. DOI: 10.1038/143049a0.
- ↑ Langmuir, I «The Structure of Proteins». Proceedings of the Physical Society of London, 51, 1939, pàg. 592–612. DOI: 10.1088/0959-5309/51/4/305.
- ↑ Wrinch, DM «On the Hydration and Denaturation of Proteins». Philosophical Magazine, 25, 1938, pàg. 705–739.
- ↑ Wrinch, DM «Hydration and Denaturation of Proteins». Nature, 142, 1936, pàg. 260.
- ↑ Dow, RB; Matthews JE, Jr. and Thorp WTS «The Effect of High Pressure Treatment on the Physiological Activity of Insulin». American Journal of Physiology, 131, 1940, pàg. 382–387.
- ↑ Dunitz, Jack D. «Linus Carl Pauling, February 28, 1901–August 19, 1994». Biographical Memoirs of Fellows of the Royal Society, 42, Noviembre 1996, pàg. 316–338. DOI: 10.1098/rsbm.1996.0020.
- ↑ Kauzmann, W «Some Factors in the Interpretation of Protein Denaturation». Advances in Protein Chemistry, 14, 1959, pàg. 1–63. DOI: 10.1016/S0065-3233(08)60608-7.
- ↑ Wrinch, DM «Structure of Proteins and of Certain Physiologically Active Compounds». Nature, 138, 1936, pàg. 651–652. DOI: 10.1038/138651a0.
- ↑ Wrinch, DM; Jordan Lloyd D «The Hydrogen Bond and the Structure of Proteins». Nature, 138, 1936, pàg. 758–759. DOI: 10.1038/138758a0.
- ↑ Wrinch, DM «Nature of the Linkage in Proteins». Nature, 139, 1937, pàg. 718. DOI: 10.1038/139718a0.
- ↑ Astbury, WT; Wrinch DM «The Hydrogen Bond and the Structure of Proteins». Nature, 139, 1937, pàg. 798.
- ↑ Wrinch, D «The Fabric Theory of Protein Structure». Philosophical Magazine, 30, pàg. 64–67.
- ↑ Wrinch, DM «The Cyclol Theory and the 'Globular' Proteins». Nature, 139, 1937, pàg. 972–973. DOI: 10.1038/139972a0.
- ↑ Wrinch, DM «The Native Protein». Science, 106, 1947, pàg. 73–76. DOI: 10.1126/science.106.2743.73.
- ↑ Wrinch, DM «On the Pattern of Proteins». Proceedings of the Royal Society, A160, 1937, pàg. 59–86.
- ↑ Wrinch, DM «The Cyclol Hypothesis and the "Globular" Proteins». Proceedings of the Royal Society, A161, 1937, pàg. 505–524.
- ↑ Wrinch, DM «On the Molecular Weights of the Globular Proteins». Philosophical Magazine, 26, 1938, pàg. 313–332.
- ↑ Florkin M «[Discovery of pepsin by Theodor Schwann.]» (en francès). Rev Med Liege, 12, 5, marzo 1957, pàg. 139–44. PMID: 13432398.
- ↑ Wrinch, DM «The Tuberculin Protein TBU-Bovine (523)». Nature, 144, 1939, pàg. 77. DOI: 10.1038/144077a0.
- ↑ Northrop JH «Crystalline pepsin» (en anglès). Science (journal), 69, 1796, mayo 1929, pàg. 580. DOI: 10.1126/science.69.1796.580. PMID: 17758437.
- ↑ Wrinch, DM «On the structure of pepsin». Philosophical Magazine, 24, 1937, pàg. 940.
- ↑ Wrinch, DM «Structure of Pepsin». Nature, 142, 1938, pàg. 217.
- ↑ Wrinch, DM «On the Structure of Insulin». Science, 85, 1937, pàg. 566–567. DOI: 10.1126/science.85.2215.566.
- ↑ Wrinch, DM «On the Structure of Insulin». Transactions of the Faraday Society, 33, 1937, pàg. 1368–1380. DOI: 10.1039/tf9373301368.
- ↑ Wrinch, DM «The Structure of the Insulin Molecule». Journal of the American Chemical Society, 60, 1938, pàg. 2005–2006. DOI: 10.1021/ja01275a514.
- ↑ Wrinch, DM «The Structure of the Insulin Molecule». Science, 88, 1938, pàg. 148–149. DOI: 10.1126/science.88.2276.148-a.
- ↑ Wrinch, DM; Langmuir I «The Structure of the Insulin Molecule». Journal of the American Chemical Society, 60, 1938, pàg. 2247–2255. DOI: 10.1021/ja01276a062.
- ↑ Langmuir, I; Wrinch DM «A Note on the Structure of Insulin». Proceedings of the Physical Society of London, 51, 1939, pàg. 613–624. DOI: 10.1088/0959-5309/51/4/306.
- ↑ Bragg, WL «Patterson Diagrams in Crystal Analysis». Nature, 143, 1939, pàg. 73–74. DOI: 10.1038/143073a0.
- ↑ Bernal, J. D. «Vector Maps and the Cyclol Hypothesis». Nature, 143, 1939, pàg. 74–75. DOI: 10.1038/143074a0.
- ↑ Robertson, JM «Vector Maps and Heavy Atoms in Crystal Analysis and the Insulin Structure». Nature, 143, 1939, pàg. 75–76. DOI: 10.1038/143075a0.
- ↑ Riley, DP; Fankuchen I «A Derived Patterson Analysis of the Skeleton of the Cyclol C₂ Molecule». Nature, 143, 1939, pàg. 648–649. DOI: 10.1038/143648a0.
- ↑ Wrinch, DM «Patterson Projection of the Skeletons of the Structure proposed for the Insulin Molecule». Nature, 145, 1940, pàg. 1018. DOI: 10.1038/1451018a0.
- ↑ Riley, D «A Patterson Analysis derived from the Cyclol C₂ Skeleton». Nature, 146, 1940, pàg. 231. DOI: 10.1038/146231a0.
- ↑ Neurath, H; Bull HB «The Surface Activity of Proteins». Chemical Reviews, 23, 1938, pàg. 391–435. DOI: 10.1021/cr60076a001.
- ↑ Huggins, M «The Structure of Proteins». Journal of the American Chemical Society, 61, 1939, pàg. 755. DOI: 10.1021/ja01872a512.
- ↑ Haurowitz, F «The arrangement of peptide chains in sphaero protein-molecules». Zeitschrift der physiologischen Chemie, 256, 1938, pàg. 28–32.
- ↑ Meyer, KH; Hohenemser W «Possibility of the Formation of Cyclols from Simple Peptides». Nature, 141, 1938, pàg. 1138–1139. DOI: 10.1038/1411138b0.
- ↑ Bergmann, M; Niemann C «The Chemistry of Amino Acids and Proteins». Annual Reviews in Biochemistry, 7, 1938, pàg. 99–124. DOI: 10.1146/annurev.bi.07.070138.000531.
- ↑ Neuberger, A «Chemical criticism of the cyclol and frequency hypothesis of protein structure». Proceedings of the Royal Society, 170, 1939, pàg. 64–65.
- ↑ Neuberger, A «Chemical Aspects of the Cyclol Hypothesis». Nature, 143, 1939, pàg. 473. DOI: 10.1038/143473a0.
- ↑ Haurowitz, F; Astrup T «Ultraviolet absorption of genuine and hydrolysed protein». Nature, 143, 1939, pàg. 118–119. DOI: 10.1038/143118b0.
- ↑ Klotz, IM; Griswold P «Infrared Spectra and the Amide Linkage in a Native Globular Protein». Science, 109, 1949, pàg. 309–310. DOI: 10.1126/science.109.2830.309.
- ↑ 87,0 87,1 Pauling, L; Niemann C «The Structure of Proteins». Journal of the American Chemical Society, 61, 1939, pàg. 1860–1867. DOI: 10.1021/ja01876a065.
- ↑ Hotchkiss, RD «The Determination of Peptide Bonds in Crystalline Lactoglobulin». Journal of Biological Chemistry, 131, 1939, pàg. 387–395.
- ↑ 89,0 89,1 Wrinch, DM «The Geometrical Attack on Protein Structure». Journal of the American Chemical Society, 63, 1941, pàg. 330–33. DOI: 10.1021/ja01847a004.
- ↑ Wrinch, DM «The Cyclol Hypothesis». Nature, 145, 1940, pàg. 669–670. DOI: 10.1038/145669a0.
- ↑ 91,0 91,1 Wrinch, DM «The Native Proteins as Polycondensations of Amino Acids». Science, 107, 1948, pàg. 445–446. DOI: 10.1126/science.107.2783.445-a.
- ↑ Wrinch, DM «Skeletal Units in Protein Crystals». Science, 115, 1948, pàg. 356–357. DOI: 10.1126/science.115.2987.356.
- ↑ Wrinch, DM «Molecules of the Insulin Structure». Science, 116, 1948, pàg. 562–564. DOI: 10.1126/science.116.3021.562.
- ↑ Wrinch, DM «The Structure of the Globular Proteins». Nature, 143, 1939, pàg. 482–483. DOI: 10.1038/143482a0.
- ↑ Wrinch, DM «The Cyclol Theory and the Structure of Insulin». Nature, 143, 1939, pàg. 763–764. DOI: 10.1038/143763a0.
- ↑ Wrinch, DM «Native Proteins, Flexible Frameworks and Cytoplasmic Organization». Nature, 150, 1939, pàg. 270–271. DOI: 10.1038/150270a0.
- ↑ 97,0 97,1 97,2 Wrinch, DM. Chemical Aspects of Polypeptide Chain Structures and the Cyclol Theory. Nova York: Plenum Press, 1965.
- ↑ Anslow, GA «Bond Energies in Some Protein Fabrics and Side Chains». Physical Review, 61, 1942, pàg. 547.
- ↑ Anslow, GA «Ultraviolet Spectra of Biologically Important Molecules». Journal of Applied Physics, 16, 1945, pàg. 41–49. DOI: 10.1063/1.1707499.
- ↑ Anslow, GA «The Sites of the Amino-Acid Residues on a Cyclol Model of Insulin». Journal of Chemical Physics, 21, 1953, pàg. 2083–2084. DOI: 10.1063/1.1698765.
- ↑ Guedez, T; Núñez A, Tineo E, Núñez O «Ring size configuration effect and the transannular intrinsic rates in bislactam macrocycles». Journal of the Chemical Society, Perkin Transactions 2, 2002, 2002, pàg. 2078–2082. DOI: 10.1039/b207233e.
- ↑ Bernal, JD «Structure of proteins». Nature, 143, 1939, pàg. 663–667. DOI: 10.1038/143663a0.
- ↑ Wieland T and Bodanszky M, The World of Peptides, Springer Verlag, pp.193-198.
- ↑ Hofmann, A; Ott H, Griot R, Stadler PA and Frey AJ «Synthese von Ergotamin». Helvetica Chimica Acta, 46, 1963, pàg. 2306–2336.
- ↑ Shemyakin, MM; Antonov VK, and Shkrob AM «Activation of the amide group by acylation». Peptides, Proc. 6th Europ. Pept. Symp., Athens, 1963, pàg. 319–328.
- ↑ Zanotti, G; Pinnen F, Lucente G, Cerrini S, Fedeli W and Mazza F «Peptide thiacyclols. Synthesis and structural studies». J. Chem. Soc. Perkin Trans., 1, 1984, pàg. 1153–1157. DOI: 10.1039/p19840001153.
- ↑ Griot, RG; Frey AJ «The formation of cyclols from N-hydroxyacyl lactames». Tetrahedron, 19, 1963, pàg. 1661–1673. DOI: 10.1016/S0040-4020(01)99239-7.
- ↑ Lucente, G; Romeo A «Synthesis of cyclols from small peptides via amide-amide reaction». Chem. Commun., ?, 1971, pàg. 1605–1607.
- ↑ Rothe, M; Schindler W, Pudill R, Kostrzewa U, Theyson R, and Steinberger R. «Zum Problem der Cycloltripeptidsynthese». Peptides, Proc. 11th Europ. Pept. Symp., Wien, 1971, pàg. 388–399.
- ↑ Rothe, M; Roser KL «Conformational flexibility of cyclic tripeptides». Abstr. 20th Europ. Pept. Symp. Tübingen, 1988, pàg. 36.
- ↑ Wieland, T.; Mohr H «Diacylamide als energiereiche Verbindungen. Diglycylimid». Liebigs Ann. Chem., 599, 1956, pàg. 222–232.
- ↑ Wieland, T.; Urbach H «Weitere Di-Aminoacylimide und ihre intramolekulare Umlagerung». Liebigs Ann. Chem., 613, 1958, pàg. 84–95.
- ↑ Brenner, M «The aminoacyl insertion». Ciba Foundation Symposium on Amino acids and peptides with antimetabolic activity, 1958.
- ↑ Wrinch, DM «Structure of Bacitracin A». Nature, 179, 1957, pàg. 536–537. DOI: 10.1038/179536a0.
- ↑ Wrinch, DM «An Approach to the Synthesis of Polycyclic Peptides». Nature, 180, 1957, pàg. 502–503. DOI: 10.1038/180502b0.
- ↑ Wrinch, DM «Some Issues in Molecular Biology and Recent Advances in the Organic Chemistry of Small Peptides». Nature, 193, 1962, pàg. 245–247. DOI: 10.1038/193245a0.
- ↑ Wrinch, DM «Recent Advances in Cyclol Chemistry». Nature, 199, 1963, pàg. 564–566. DOI: 10.1038/199564a0.
- ↑ Wrinch, DM «A Contemporary Picture of the Chemical Aspects of Polypeptide Chain Structures and Certain Problems of Molecular Biology». Nature, 206, 1965, pàg. 459–461. DOI: 10.1038/206459a0.
- ↑ Wrinch, DM. Chemical Aspects of the Structures of Small Peptides: An Introduction. Copenhagen: Munksgaard, 1960.
- ↑ Rayner-Canham, Marelene F. Women in chemistry: their changing roles from alchemical times to the mid-twentieth century (en anglès). History of modern chemical sciences. Chemical Heritage Foundation, 2005. ISBN 9780941901277 [Consulta: 13 desembre 2009].
- ↑ Kauzmann, W «Reminiscences from a life in protein physical chemistry». Protein Science, 2, 1993, pàg. 671–691.
- ↑ Pais, A. Inward Bound: Of Matter and Forces in the Physical World. Oxford University Press, 1986.
- ↑ Bohr, Niels «On the Constitution of Atoms and Molecules (Parte 1 de 3)». Philosophical Magazine, 26, 1913, pàg. 1–25.
- ↑ Bohr, N «On the Constitution of Atoms and Molecules, Part III». Philosophical Magazine, 26, 1913, pàg. 857–875.
- ↑ Bohr, N «The spectra of helium and hydrogen». Nature, 92, 1914, pàg. 231–232. DOI: 10.1038/092231d0.
- ↑ Pauling, L; Corey RB «A proposed structure for the nucleic acids». Proceedings of the National Academy of Science, 39, 1953, pàg. 84–97. DOI: 10.1073/pnas.39.2.84.
- ↑ Franklin, RE; Gosling R «Molecular configuration of sodium thymonucleate». Nature, 171, 1953, pàg. 740–741. DOI: 10.1038/171740a0.
- ↑ 128,0 128,1 Watson, JD; Crick F. «Molecular structure of nucleic acids: A structure for deoxyribonucleic acid». Nature, 171, 1953, pàg. 737–738. DOI: 10.1038/171737a0.
- ↑ Saenger, W. Principles of Nucleic Acid Structure. Springer Verlag, 1988.
- ↑ Pais, A. Subtle is the Lord: The Science and the Life of Albert Einstein. Oxford University Press, 1982.
- ↑ Rota, Gian-Carlo «The phenomenology of mathematical beauty». Synthese, 111, 2, 1977, pàg. 171–182. DOI: 10.1023/A:1004930722234.
