Indústria química

La indústria química comprèn les empreses que produeixen industrialment productes químics. Aquestes empreses treballen en l'extracció i processament de les matèries primeres(petroli, gas natural, aire, aigua, metalls i minerals), per a transformar-les en altres substàncies de naturalesa diferent. Actualment a l'economia central del món modern es produeixen uns 70.000 productes diferents.
Característiques de la indústria química
[modifica]L'abast de la indústria química es basa més en la tradició que per la lògica. Així, la indústria del petroli no es considera indústria química, perquè en els seus inicis al segle xx, el petroli cru només era sotmès a una destil·lació simple (separació física). No obstant això, els processos industrials moderns impliquen reaccions químiques, i alguns dels productes són composts químics que no semblen relacionats amb el petroli. La petroquímica engloba aquestes operacions químiques, però, ja que sovint es realitzen a la mateixa planta que la destil·lació primària, la distinció entre la indústria petroliera i la indústria química és difícil de mantenir.[1]

Els metalls, en cert sentit, són productes químics perquè es produeixen mitjançant mètodes químics, i els minerals a vegades requereixen mètodes químics abans de la refinació o refinatge, que també n'empra. Aquests metalls com l'acer, el plom, el coure i el zinc es produeixen en una forma prou pura i més tard es fabriquen en formes útils. No obstant això, la indústria de l'acer, per exemple, no es considera part de la indústria química. En la metal·lúrgia moderna, metalls com el titani, el tàntal i el tungstè produïts mitjançant processos que impliquen una gran habilitat química encara es classifiquen com a metalls primaris.[1]

Així doncs, els límits de la indústria química són confusos. Les seves principals matèries primeres són els combustibles fòssils (carbó, gas natural i petroli), l'aire, l'aigua, la sal comuna, la pedra calcària, el sofre o un equivalent, la roca fosfatada i el mineral fluorita. La indústria química converteix aquestes matèries primeres en productes primaris, secundaris i terciaris, una distinció basada en la distància del producte al consumidor, essent el primari el més remot. Sovint, els productes només són productes finals pel que fa a la mateixa indústria química; una característica de la indústria química és que els seus productes gairebé sempre requereixen un processament addicional abans d'arribar al consumidor final.[1]
Hi ha moltes rutes per arribar al mateix producte i molts usos per al mateix producte. El principal ús de l'etilenglicol, per exemple, és com anticongelant d'automòbils, però també s'utilitza com a fluid de frens hidràulics. El processament addicional porta a molts derivats que s'utilitzen com a additius a les indústries tèxtil, farmacèutica i cosmètica; com emulsionants en l'aplicació d'insecticides i fungicides; i com desemulsionants per a petroli. Els productes químics fonamentals, com el clor o l'àcid sulfúric, es fan servir de tantes maneres que és difícil fer una llista completa.[1]
Aspectes econòmics
[modifica]
A causa de la competitivitat dins de la indústria química i entre els productes químics, aquesta indústria dedica grans quantitats de diners a la recerca, especialment en els països altament industrialitzats. El percentatge de les rendes dedicat a la recerca varia d'una branca a una altra; les empreses que especialitzen en productes de gran volum que s'han utilitzat àmpliament durant molts anys gasten menys, mentre que la competència en camps més nous només es pot satisfer amb esforços de recerca intensius. Els principals exportadors de productes químics el 2021 foren Alemanya (10,9 %), els Estats Units (9,88 %), la Xina (9,85 %), Suissa (5,89 %), Irlanda (5,76 %) i Bèlgica (5,27 %).[2]
La inversió en la indústria química com a percentatge de la inversió total en un país determinat pot variar del 5 al 15 % per als països menys desenvolupats; per als països industrials, la mitjana és d'aproximadament el 6 al 8 %. Per a alguns països en desenvolupament, aquest percentatge pot fluctuar àmpliament; per exemple, la instal·lació d'una fàbrica de fertilitzants important podria canviar significativament el percentatge en un país concret.[1]

A principis del segle xx, hi havia una distinció marcada entre les economies que es basaven en el carbó com a combustible fòssil i les que es basaven en el petroli. El carbó era gairebé la única font d'hidrocarburs aromàtics. Però aquesta situació ha anat canviant perquè ara també es poden obtenir del petroli i perquè el transport modern fa possible enviaments a gran escala per mar no només de petroli, cru o en diverses etapes de refinament, sinó també de gas natural, refrigerat i condensat a líquid.[1]
Les estadístiques de la indústria química en conjunt poden ser enganyoses a causa de la pràctica de reunir productes com l'àcid sulfúric econòmic i els colorants o fibres cars; algunes compilacions inclouen cosmètics i articles de tocador, el valor dels quals pot ser artificialment alt. Les estadístiques de la indústria química de diferents països poden tenir bases de càlcul diferents; de fet, la base pot canviar de vegades al mateix país. Una font addicional de confusió és que, en alguns casos, la producció no se cita en tones del producte mateix, sinó en tones del contingut del component important.[1]
Carbonat de sodi i hidròxid de sodi
[modifica]El procés Leblanc
[modifica]
El 1775, a França l'Académie des Sciences oferí un premi per a un mètode pràctic per convertir la sal comuna, clorur de sodi NaCl, en carbonat de sodi Na2CO3, un producte necessari en grans quantitats per a la fabricació tant de sabó com de vidre. Durant anys no es presentà cap projecte i s'hagué d'incrementar el valor del premi. Finalment l'any 1789 Nicolas Leblanc (1742-1806), un cirurgià afeccionat a la química, dissenyà un procés per a tal fi i guanyà el premi aconseguint una patent per a la seva fabricació l'any 1791. El seu patró, Lluís Felip II, Duc d'Orleans, construí el mateix any una una fàbrica a Saint-Denis (Sena Saint-Denis) per a produir carbonat de sodi, però el treball s'interrompé amb la Revolució Francesa. El procés no es posà finalment en operació industrial fins al 1823 a Anglaterra, després del qual continuà utilitzant-se per preparar carbonat de sodi durant gairebé 100 anys.
El primer pas en el procés Leblanc era tractar el clorur de sodi amb àcid sulfúric H2SO4. Aquest tractament produïa sulfat de sodi Na2SO4 i clorur d'hidrogen HCl.
El sulfat de sodi s'escalfava després amb pedra calcària CaCO3 i carbó per produir cendra negra, que contenia el carbonat de sodi desitjat, barrejat amb sulfur de calci CaS, segons la reacció.
Aviat es s'observà que quan el clorur d'hidrogen HCl s'escapava a l'atmosfera, causava danys importants a la vegetació en una àrea àmplia. Per eliminar el problema de la contaminació, es desenvoluparen mètodes per convertir el clorur d'hidrogen dissolt en clor Cl2. El clor, absorbit en calç (òxid de calci CaO), s'utilitzà per produir clorat de calci Ca(ClO3)2, que tenia una demanda creixent.
Com que el sulfur de calci CaS contingut a la cendra negra tenia un olor molt desagradable, es desenvoluparen mètodes per eliminar-lo recuperant el sofre, proporcionant així almenys part de la matèria primera necessària per a l'àcid sulfúric requerit en la primera part del procés. Així, el procés Leblanc demostrà, al començament, la capacitat típica de la indústria química per desenvolupar nous processos i nous productes, i sovint això es feia convertint una despesa en un actiu.
El procés Solvay
[modifica]
El procés Leblanc fou finalment substituït pel procés d'amoni-soda (anomenat procés Solvay), que s'emprà amb èxit per primera vegada a Bèlgica a la dècada de 1860. Fou descobert pel químic francès Jean Jacques Théophile Schloesing (1824-1919), que no pogué donar-li una aplicació industrial, i després fou optimitzat per l'industrial i filantrop belga Ernest Solvay (1838-1922), de qui pren el nom.[3]
En aquest procés, el clorur de sodi com a salmorra es tracta amb amoníac NH3 i diòxid de carboni CO2 per donar hidrogencarbonat de sodi NaHCO3 i clorur d'amoni NH4Cl.
El carbonat de sodi desitjat s'obté fàcilment a partir de l'hidrogencarbonat en escalfar-lo.
Per altra banda, el clorur d'amoni es tracta amb hidròxid de calci (calç apagada) Ca(OH)2 i dona clorur de calci CaCl2 i amoníac.
Així, el clor que estava en el clorur de sodi original apareix com a clorur de calci, que es descarta en gran part (entre els pocs usos per a aquest compost es troba fondre neu i gel de carreteres i voreres). L'amoníac regenerat d'aquesta manera es torna a injectar a la primera part del procés. La recuperació eficient de gairebé tot l'amoníac és essencial per a l'operació econòmica del procés, la pèrdua d'amoníac en una operació ben dirigida no és més del 0,1 % del pes del producte.
Procés electrolític
[modifica]
Més endavant al segle XIX, el desenvolupament de la generació d'energia elèctrica posà en marxa la indústria electroquímica. Aquesta branca no clarament identificable de la indústria química inclou diverses aplicacions en les quals l'electròlisi, la descomposició d'un compost en solució en els seus elements mitjançant un corrent elèctric, s'utilitza per provocar un canvi químic.[1]
L'electròlisi del clorur de sodi pot conduir a clor i, ja sigui hidròxid de sodi NaOH (si el NaCl estava en solució, procés cloroalcali) o sodi metàl·lic (si el NaCl estava fus). L'hidròxid de sodi, un àlcali com el carbonat de sodi, en alguns casos competeix amb aquest per a les mateixes aplicacions, i en qualsevol cas ambdós es poden convertir mitjançant processos bastant simples. Els processos electrolítics produeixen clor, que té gairebé usos innombrables en la indústria química, incloent la fabricació del plàstic policlorur de vinil, el material plàstic produït en major volum. Per aquest motiu, el procés d'amoni-soda, havent desplaçat el procés Leblanc, s'ha vist desplaçat, amb les antigues plantes d'amoni-soda continuant operant de manera molt eficient però no construint-se noves plantes d'amoni-soda.[1]
Àcid sulfúric i disulfur de carboni
[modifica]
El disulfur de carboni CS2 s'obté per la reacció de carboni i sofre. El carboni prové del gas natural, i el sofre pot subministrar-se en forma elemental, com sulfur d'hidrogen H2S o com diòxid de sofre SO2. Els usos principals del disulfur de carboni són per a la fabricació de raió i per a la pel·lícula de cel·lulosa regenerada. Aquests dos productes es fabriquen en una quantitat tan gran que el disulfur de carboni és un producte químic pesant, en qualsevol estàndard.[1]
L'àcid sulfúric H2SO4 és de llarg el producte únic més important de la indústria química. De la gran producció mundial d'àcid sulfúric, gairebé la meitat s'utilitza per a la fabricació de superfosfat i fertilitzants relacionats. Altres usos de l'àcid són molt diversos, en destaquen els de la fabricació de gasolina d'alt octanatge, de diòxid de titani (un pigment blanc, també un farciment per a alguns plàstics i per al paper), explosius, raió, el processament d'urani i la decapació d'acer.[1]
Procés de les cambres de plom
[modifica]Quan es crema sofre a l'aire, es forma diòxid de sofre SO2, i si aquest es combina amb oxigen s'obté el triòxid de sofre SO3, que es pot fer reaccionar amb aigua per donar àcid sulfúric. La primera tècnica que es desenvolupà per obtenir el triòxid de sofre és el procés de les cambres de plom, que s'hagué de dissenyar per a subministrar la gran quantitat d'àcid sulfúric requerit pel procés Leblanc (la contribució més important a llarg termini d'aquest últim). En aquesta tècnica, la reacció entre diòxid de sofre i oxigen té lloc en presència d'aigua i d'òxids de nitrogen. Com que la reacció és bastant lenta, s'ha de proporcionar prou temps de residència perquè els gasos reaccionin, i s'ha de realitzar en recipients de plom perquè aquesta barreja gasosa és altament corrosiva.[4]
Procés de contacte
[modifica]El plom és un material incòmode d'utilitzar i, a més, el procés de les cambres de plom no pot proporcionar àcid més concentrat que un 78 % sense un tractament especial. Per tant, aquest procés fou substituït pel procés de contacte. Aquest mètode es posà en pràctica el 1901, malgrat havia estat patentat a Anglaterra el 1831 per l'industrial Peregine Phillips, i ha esdevingut el mètode més emprat en l'actualitat. Consta de quatre fases:

1a fase: Comença cremant sofre, o torrant sulfurs, per a produir diòxid de sofre .[4]
2a fase: El diòxid de sofre es neteja d'impureses, que enverinen el catalitzador, fent passar-lo per separadors de pols, mecànics o electroestàtics, i es ruixa amb aigua i després amb àcid sulfúric concentrat.[4]
3a fase: A continuació el diòxid de sofre és oxidat a triòxid de sofre usant aire en presència de mescles d'òxid de ferro(III) amb un poc de d'òxid de coure(II) o mescles amb òxid de vanadi(V) , que fan de catalitzadors.[4]
4a fase: El triòxid de sofre s'absorbeix en 97–98% per formar òleum (), també conegut com a àcid sulfúric fumant. L'òleum es dilueix amb aigua per a formar àcid sulfúric concentrat.[4]
S'ha de dir que no és pràctic dissoldre directament el en aigua pel fet de presentar una reacció altament exotèrmica i perquè, en lloc d'un líquid, forma un aerosol corrosiu molt difícil de separar.
Fonts de sofre
[modifica]
Com que l'àcid sulfúric és indispensable per a moltes indústries, la seva matèria primera principal és de la màxima importància. Originalment, el sofre provenia de dipòsits volcànics a Sicília. A començaments del segle xx la producció augmentà amb sofre del sud dels Estats Units que es recupera mitjançant el procés Frasch, en què el sofre es fon sota terra amb aigua calenta i la barreja es porta a la superfície en forma líquida. Altres fonts de sofre inclouen la pirita FeS2, l'esfalerita ZnS i d'altres, que es poden cremar per produir diòxid de sofre SO2; i alguns gasos naturals que contenen sulfur d'hidrogen H2S. El sofre present en petites concentracions en els combustibles fòssils és una font notòria de contaminació atmosfèrica. L'eliminació del sofre del petroli brut augmenta l'oferta de sofre i redueix la contaminació.[1]
Potassi
[modifica]
Els fertilitzants representen una de les majors matèries primeres del mercat per a la indústria química. És una indústria molt gran en tots els països industrialitzats i, alhora, molt important per a la introducció el més aviat possible als països en desenvolupament. Els elements crucials (macronutrients) que s'han d'afegir al sòl en quantitats considerables són el nitrogen, el fòsfor i el potassi, en cada cas en forma d'un compost adequat. El calci, el magnesi i el sofre es consideren nutrients secundaris; i a vegades és necessari afegir-los. Altres elements són necessaris només en petites quantitats; certs sòls poden ser deficient en bor, coure, zinc o molibdè, cosa que fa necessari afegir-ne petites quantitats. No obstant això, com a gran indústria, els fertilitzants es basen en els tres elements esmentats anteriorment.
El potassi és el setè element químic en ordre d'abundància a l'escorça terrestre, aproximadament al mateix ordre que el sodi, amb el qual es assembla molt. Tot i que el sodi és fàcilment disponible en el clorur de sodi de la mar, la major part del potassi es troba en petites proporcions en un gran nombre de minerals, d'on no es pot extreure econòmicament. Quan es començà a utilitzar sals de potassi com a fertilitzants a la segona meitat del segle xix, es creia que Alemanya tenia un monopoli amb els dipòsits de Stassfurt, però més tard es trobaren molts altres dipòsits explotables a altres parts del món. Les reserves mundials són adequades per a milers d'anys, amb grans dipòsits al Canadà (Manitoba i Saskatchewan), Belarús, Rússia i als Estats Units (Montana, Dakota del Nord, Utah, Arizona i Michigan).[5]
El clorur de potassi KCl és la forma comercial principal. Al voltant del 90 % de la producció es destina als fertilitzants. Per a altres usos, les sals de sodi similars són més econòmiques, però per a algunes utilitzacions especials, el potassi té l'avantatge. Algunes aplicacions ceràmiques requereixen potassi, i l'hidrogencarbonat de potassi KHCO3 és més efectiu que l'hidrogencarbonat de sodi NaHCO3 per apagar focs.
Fòsfor i fosfats
[modifica]
De lluny, la font més gran de fòsfor és la roca fosfàtica. Com amb el potassi, hi ha reserves extenses. Els dipòsits més grans es troben al Nord d'Àfrica (Marroc, Algèria, Tunísia), els Estats Units (principalment Florida) i la Rússia, però també hi ha dipòsits importants en molts altres països. La roca fosfàtica es troba en dipòsits d'origen sedimentari, dipositats originalment en capes al fons oceànic. La roca consisteix principalment en fosfat de calci (conegut com fosfat tricàlcic) Ca3(PO4)2 insoluble, juntament amb altres materials, incloent-hi fluor.

Per utilitzar el fosfat de calci com a fertilitzant, s'ha de convertir a una forma soluble en aigua, encara que sigui lleugerament, com el fosfat monocàlcic (hidrogenfosfat de calci CaHPO4) o altres. La conversió es realitza amb grans quantitats d'àcid sulfúric H2SO4, que converteixen la roca fosfàtica en superfosfat, una barreja aproximadament 1:1 de dihidrogenfosfat de calci Ca(H2PO4)2 i sulfat de calci CaSO4, àmpliament utilitzat com a fertilitzant. El pes del superfosfat és superior al de la roca fosfàtica original pel sulfat de calci que es forma en el procés de fabricació. Aquest pes mort es pot reduir substituint l'àcid sulfúric per àcid fosfòric H3PO4 (obtingut mitjançant l'acció de l'àcid sulfúric sobre la roca fosfàtica, seguida de la separació dels productes; o bé per un procés de forn elèctric). Aquest procés dona com a resultat el superfosfat triple (dihidrogenfosfat de calci Ca(H2PO4)2). El contingut útil del fertilitzant, expressat com a percentatge de pentaòxid de difòsfor P2O5, s'incrementa del 20 % en el superfosfat a aproximadament el 45 % en la varietat triple, resulta en una reducció de més de dues vegades en la quantitat de material que s'ha de distribuir per proporcionar una mateixa quantitat de fòsfor.

En lloc d'utilitzar àcid sulfúric o àcid fosfòric per tractar la roca fosfàtica, es pot emprar àcid nítric, HNO3. Un dels productes resultants, el nitrat de calci Ca(NO3)2, també es pot emprar com a fertilitzant. En lloc de neutralitzar l'àcid fosfòric amb calci, que no contribueix res més que pes mort, es pot utilitzar amoníac, donant fosfat d'amoni (NH4)3PO4, en el qual ambdós constituents aporten elements fertilitzants.
Es fan servir molts altres composts de fòsfor. Un grup està format per àcid fosfòric i diversos fosfats derivats d'ell. L'àcid mateix es fa servir en begudes suaus pel seu gust agradable quan està endolcit i el seu valor nutritiu. Altres aplicacions alimentàries inclouen l'ús de difosfat de sodi en formatge processat; i fosfats en pols de coure, a prova de foc i per al tractament de l'aigua de caldera en instal·lacions de vapor. Un ús important d'alguns dels fosfats és en els detergents.
El fòsfor elemental existeix en moltes formes al·lotròpiques. El fòsfor blanc es fa servir com a verí per a rosegadors i pel militar per a la generació de fum. El fòsfor vermell, comparativament inofensiu, es fa servir en mistos. El ferrofòsfor, una combinació de fòsfor amb ferro, es fa servir com a ingredient en acer de baix allau d'alta resistència. A més, molts composts orgànics de fòsfor tenen usos variats, incloent-hi els additius per a la gasolina i l'oli lubricant, com plastificants per a plàstics que, d'una altra manera, serien incòmodament rígids, i, en alguns casos, com a insecticides poderosos, relacionats amb verins nerviosos.
Hidrogen
[modifica]
L'hidrogen H2 s'obté generalment de la descomposició de l'aigua i s'empra majoritàriament per a produir amoníac (60 %), per a obtenir metanol (30 %) i en la indústria del ferro i acer (10 %).[6] Aquest procés requereix energia, en alguns casos subministrada per electricitat, però més sovint procedent de combustibles fòssils. El carboni del carbó de coc pot cremar tant a diòxid de carboni CO2 com, si la quantitat d'aire és limitada, a monòxid de carboni CO. El producte gasós és una barreja de CO i N2, present a l'aire. El coc al roig també es pot escalfar amb vapor d'aigua a 1 000 °C per produir monòxid de carboni i hidrogen H2, una barreja coneguda com a gas d'aigua o gas blau.[4]
Si es fa passar el gas d'aigua amb més vapor d'aigua a 500 °C sobre un catalitzador de ferro, crom i tori, s'obté més hidrogen i diòxid de carboni.[4]
El diòxid de carboni s'elimina dissolent-lo en aigua a una pressió d'aproximadament deu atmosferes; o es pot utilitzar directament. A partir d'aquí, partint del gas d'aigua i convertint una certa proporció de monòxid de carboni en diòxid de carboni i hidrogen, es pot obtenir una barreja de monòxid de carboni i hidrogen en qualsevol proporció.[4] Aquestes mescles s'anomenen gas de síntesi.[7]
Gas de síntesi
[modifica]
Gas de síntesi és el nom que rep la mescla gasosa d'hidrogen H2 i monòxid de carboni CO, en proporcions variables i amb un 20 % aproximadament de gasos inerts o diòxid de carboni CO2, utilitzada en processos de síntesi orgànica, com ara la síntesi de metanol CH3OH, que es fa reaccionar a 300 °C i 200 atm de pressió.[8] El 30 % de la producció mundial d'hidrogen fou emprat el 2022 en la síntesi de metanol.[6]
Hi ha moltes variacions possibles, depenent principalment del combustible concret que es faci servir. A principis del segle xx s'obtenia en gran part a partir del carbó de coc, però durant el segle xx hi hagué un canvi gradual als productes del petroli com a combustible fòssil. Finalment, la darrera tendència és passar al gas natural. Amb el gas natural, compost majoritàriament per metà CH4, la reacció d'obtenció d'hidrogen és:
Amoníac
[modifica]Durant molt de temps, el fems de les explotacions ramaderes proporcionaven l'adob nitrogenat per a l'agricultura, però a la fi del segle XIX deixà de ser suficient. Una certa quantitat de sulfat d'amoni (NH4)2SO4 s'obtenia com a subproducte de la carbonització del carbó, i grans dipòsits de nitrat de sodi NaNO3 descoberts a Xile permeteren substituir el fems durant un temps. No obstant això, el problema de subministrament a llarg termini no fou resolt fins just abans de la Primera Guerra Mundial, quan el químic alemany Fritz Haber inicià la síntesi comercial d'amoníac NH3 que encara s'empra (procés Haber-Bosch). L'empenta per a aquest mètode fou la necessitat d'Alemanya d'una font autòctona de nitrogen per a explosius militars. L'aire conté un 78 % de nitrogen N2, no obstant això, el nitrogen és un element bastant inert; és difícil fer que es combini amb qualsevol altre element. Haber aconseguí que el nitrogen es combinés amb el hidrogen mitjançant l'ús d'alta pressió, temperatures moderadament altes i un catalitzador. La estreta interrelació entre l'ús del nitrogen per a fertilitzants i per a explosius perdura fins avui dia. La reacció és:

L'enorme augment en la producció de fertilitzants ha portat a la construcció d'immenses plantes d'amoníac. Les plantes han de tenir disponible una font de combustible fòssil, però el petroli i el gas natural es transporten fàcilment, de manera que hi ha una tendència a situar les plantes a prop del destí final del producte. Una planta típica inclou tot l'equipament per a la preparació del gas de síntesi en l'escala necessària, juntament amb l'equip per purificar-lo. En la síntesi de l'amoníac, qualsevol compost d'oxigen enverina del catalitzador, i per tant, les traces de diòxid de carboni i monòxid de carboni s'han de treure amb cura. Comprimir el gas a la pressió desitjada requereix un equipament d'enginyeria extens. Com més alta és la pressió, major és el rendiment, però més alt és el cost real de la compressió. Com més alta és la temperatura, més baix és el rendiment, però la temperatura no es pot baixar indefinidament per obtenir millors rendiments perquè les temperatures més baixes frenen la reacció. La temperatura utilitzada és de l'ordre de 500 °C. L'elecció de la temperatura i la pressió és un compromís per donar resultats òptims. Només una fracció es converteix cada vegada, però després de cada passada, l'amoníac es retira i el gas restant es recicla. El nitrogen atmosfèric conté aproximadament un 1 % d'argó, un gas inert, que s'ha de treure de tant en tant perquè no s'acumuli indefinidament en el sistema. També hi sol haver una fàbrica d'àcid nítric HNO3 propera per produir nitrat d'amoni NH4NO3 que s'empra com a fertilitzant.
Urea
[modifica]
L'amoníac es pot aplicar com a fertilitzant de moltes formes, des de l'aplicació d'amoníac líquid sota la superfície del sòl, o solucions d'amoníac en aigua (que també contenen altres nutrients). El diòxid de carboni eliminat durant la preparació del gas de síntesi pot reaccionar amb l'amoníac, sovint a la mateixa planta, per formar urea, CO(NH2)2. El mètode actual per a la producció d'urea utilitza la reacció de Bazarov, en la qual el diòxid de carboni i l'amoníac es converteixen primer en carbamat d'amoni que després es deshidrata en urea:[9]
La urea és un excel·lent fertilitzant, altament concentrat en nitrogen (46,6 %). Altres usos de la urea són: com a additiu en l'alimentació animal per proporcionar el nitrogen per a la formació de proteines, s'utilitza per a una sèrie important de resines i plàstics mitjançant la reacció amb formaldehid, i és el compost actiu de l'Adblue, dissolució d'urea al 32,5 % utilitzada per reduir les emissions d'òxids de nitrogen NOx causades pels escapaments dels motors dièsel, mitjançant un procés anomenat reducció catalítica selectiva.[10]
Altres
[modifica]L'amoníac també té altres usos dins de la indústria química. La petita quantitat d'amoníac consumida en la producció de carbonat de sodi Na2CO3 pel procés d'amoni-soda abans representava un volum considerable. L'amoníac s'utilitza en un procés per obtenir raió, com a refrigerant en grans establiments de refrigeració comercials, i com a font portàtil convenient d'hidrogen. L'hidrogen pot ser comprimit en cilindres, però l'amoni, que es converteix en líquid en ser comprimit, emmagatzema molt més hidrogen en el mateix volum; es descompon per calor en hidrogen i nitrogen; el nitrogen s'utilitza per proporcionar una atmosfera inerta per a moltes operacions metal·lúrgiques.
Àcid nítric
[modifica]
De molt lluny, l'ús més important de l'amoníac dins de la indústria química és produir àcid nítric HNO3. El nitrogen i l'oxigen només es poden fer combinar directament amb molta dificultat. L'amoníac crema amb aire o oxigen formant aigua i deixant nitrogen lliure N2. Amb l'ajuda d'un catalitzador de platí amb un petit percentatge de rodi, l'amoníac s'oxida a òxids de nitrogen que després es poden fer reaccionar amb aigua per formar àcid nítric, segons les reaccions (procés Ostwald).[4]

Nitrat d'amoni
[modifica]Amb diferència, l'ús principal de l'àcid nítric (80%) és en la fabricació de fertilitzants. D'aquest 96% s'utilitza per fer nitrat d'amoni NH4NO3 i nitrat d'amoni i calci 5Ca(NO3)2•NH4NO3•10H2O. Per reacció de l'àcid nítric HNO3 amb l'amoníac s'obté nitrat d'amoni NH4NO3, un dels fertilitzants més importants:[11]
Explosius
[modifica]Una petita quantitat d'àcid nítric s'empra per a preparar explosius. El nitrat d'amoni és un component important de molts explosius. Tres materials explosius fonamentals s'obtenen nitrant (tractant amb àcid nítric, sovint en una barreja amb àcid sulfúric H2SO4): cel·lulosa, obtinguda del fusta, dona cel·lulosa nitrada (nitrocel·lulosa); la glicerina dona trinitrat de gliceril (nitroglicerina); i el toluè dona trinitrotoluè (TNT). Un altre ingredient explosiu és el picrat d'amoni, derivat de l'àcid pícric o 2,4,6-trinitrofenol. La síntesi de la nitrocel·lulosa és:
Un segment menor de la indústria dels explosius és la producció d'agents detonants, o de composicions d'inflamació com ara l'azida de plom Pb(N3)2, l'azida d'argent AgN3 i el fulminat de mercuri Hg(ONC)2. Aquests no són nitrats ni compostos nitro, tot i que alguns altres detonadors ho són, però tots contenen nitrogen, i àcid nítric està implicat en la seva fabricació.
Relacionats amb els explosius estan els propel·lents de coets. Un míssil propulsat per coet o un vehicle de llançament d'espai ha de portar amb si els components reactius (combustible i oxidant), ja sigui en molècules diferents o en la mateixa molècula. Bàsicament, els propel·lents de coets consisteixen en un oxidant i un reductor. L'oxidant no ha de ser necessàriament un derivat de l'àcid nítric, sinó que també pot ser oxigen líquid, ozó O3, fluor líquid o trifluorur de clor.
Composts orgànics
[modifica]Una mica d'àcid nítric s'utilitza per fabricar productes intermedis a la indústria dels polímers, sobretot en la fabricació d'àcid hexanodioic (àcid adípic) per fer poliamides i TDI (diisocianat de toluè o diisocianat de metilbenzè) i dinitrobenzè dos d'una gamma de reactius utilitzats per fabricar poliuretans.[11]

Nitrant benzè dona nitrobenzè, que es pot reduir a aminobenzè, més conegut com anilina. L'anilina també es pot fer reaccionar amb amoníac amb clorobenzè, obtingut de la benzina. La benzina i l'amoníac són necessaris en tots dos casos. Un tractament similar aplicat al naftalè C10H8 dona naftilanilina. Tant l'anilina com la naftilanilina són els progenitors d'un gran nombre de colorants, però avui en dia els colorants sintètics solen ser de origen petroquímic. L'anilina, la naftilanilina i els altres intermediaris de colorants també porten a productes farmacèutics, productes químics fotogràfics i productes químics utilitzats en el processament de la goma.
Halogens i els seus composts
[modifica]Clor
[modifica]El primer ús a gran escala del clor fou en la fabricació de pols de blanquejar per utilitzar en la producció de paper i teixits de cotó. La pols de blanquejar fou posteriorment substituïda per clor líquid, que també es s'utilitzà àmpliament com a germicida en els subministraments públics d'aigua. Actualment, l'ús principal del clor és en la fabricació de compostos químics. Importants productes químics inorgànics fets per l'acció directa del clor sobre altres substàncies inclouen clorur de sofre, clorur de tionil, fosgé, clorur d'alumini, clorur de ferro(III), clorur de titani(IV), clorur d'estany(IV) i clorat de potassi. Productes químics orgànics fets directament amb clor inclouen derivats del metà (clorur de metil, clorur de metilè, cloroformi i tetraclorur de carboni); clorobenzen i diclorobenzen orto- i para-; clorur d'etil; i clorur d'etilè.
Preparació comercial
[modifica]D'entre diversos processos utilitzats per la fabricació de clor, el més antic utilitzà la reacció de l'àcid clorhídric HCl(aq) amb diòxid de manganès MnO2. El procediment era poc eficient i la seva aplicació comercial fou curta. Un procés introduït cap al 1868 pel químic anglès Henry Deacon es basava en la reacció de l'oxigen atmosfèric amb àcid clorhídric, que estava disponible com a subproducte del procés Leblanc per fer carbonat de sodi Na2CO3; quan el procés Leblanc quedà obsolet, el procés Deacon caigué en desús.[1]

El clor Cl2 s'obté actualment de manera majoritària (més del 95 % de la producció) per mitjà de l'electròlisi de clorur de sodi NaCl en dissolució aquosa (salmorra), denominat procés del clor-àlcali. La salmorra s'obté a partir de l'aigua de mar o de roca salina, mitjançant un procés de lixivació. Aquest producte ha de ser impurificat d'anions sulfat i de cations calci i magnesi. En el cas d'utilitzar el mètode de membrana, la salmorra no ha de tenir més de 2 ppm de catió calci. La reacció es realitza en cel·les electrolítiques formant clor gas hidròxid de sodi i hidrogen:[12]S'empren tres mètodes: electròlisi amb cel·la d'amalgama de mercuri (majoritari a Europa, 54 %), electròlisi amb cel·la de diafragma (majoritari als EUA, 75 %) i electròlisi amb cel·la de membrana (majoritari al Japó, 90 %). En el mètode d'amalgama s'util·litza un càtode de mercuri líquid i un ànode de titani recobert per òxid de ruteni(IV) RuO2. El càtode és de mercuri perquè el catió sodi és explosiu al contacte amb l'aigua, cosa que s'evita dissolvent-lo amb mercuri (una dissolució anomenada amalgama. Les semireaccions que es duen a terme són les següents:[12]
- En el càtode es redueix el catió sodi i es forma l'amalgama:
- En l'ànode s'oxida el clorur per formar clor gas:
Un cop obtinguda l'amalgama, es redirigeix cap a un reactor on es fa reaccionar amb aigua, una reacció catalitzada per diòxid de níquel Ni2O3: . El mercuri, en ser més dens, s'enfonsa i es redirigeix cap a la cel·la electrol·lítica per ser reutilitzat. L'hidròxid de sodi obtingut té una puresa del 50 %.[12]
Fluor
[modifica]Refinament d'alumini
[modifica]
La indústria del fluor està íntimament relacionada amb la producció d'alumini. L'alúmina, òxid d'alumini, Al2O3, pot ser reduïda a alumini metàl·lic per electrolisi quan es fon amb un fluent que consisteix en hexafluorur d'alumini i trisodi Na3AlF6, normalment anomenat criolita. Després d'iniciar el procés, la criolita no s'utilitza en grans quantitats, però es necessita un petit subministrament per compensar les pèrdues inevitables. La criolita és un mineral rar que només es troba en quantitats comercials a Ivittuut, Groenlàndia. El problema de subministrament fou resolt amb l'obtenció de criolita sintètica. Per a aquesta criolita sintètica, no obstant això, era necessari una font de fluor. Fins als anys 60, gairebé l'única font de fluor era la fluorita CaF2, un mineral conegut i utilitzat des de fa temps com a fluent en diverses operacions metal·lúrgiques. Encara es fa servir, en quantitats majors que abans, perquè els processos que s'estan utilitzant més per fer acer, el procés bàsic amb oxigen i el forn elèctric, fan servir dues o tres vegades més fluent que els antics alts forns. La fluorita es distribueix àmpliament, però les reserves de mineral de bona qualitat no són grans; s'ha trobat necessari utilitzar minerals de menor qualitat, el que fa que el processament sigui més car. Una reserva molt gran que es pot aprofitar per al fluor és el 3 % o així que està present en alguna roca fosfàtica. En el passat, aquest contingut de fluor rarament es recuperava; el futur sens dubte veurà un gran canvi.
Refrigerants
[modifica]
La indústria orgànica del fluor s'inicià a finals dels anys 20 del segle XX amb el descobriment dels refrigerants que contenien fluor. Es necessitava un refrigerant nou per als frigorífics domèstics que començaven a produir-se a gran escala. L'amoníac NH3 era inadequat perquè fins i tot una petita fuita donaria una olor desagradable i la descomposició alliberaria quantitats verinoses del gas. Tot i que molts compostos de fluor es coneixien com a verinosos alguns sorprenentment no ho foren i tenien les propietats físiques necessàries per a un refrigerant i eren totalment inodors. El més utilitzat d'aquests fou el freó 12 o diclorodifluorometà CCl2F2. A partir del compliment amb el Protocol de Montreal, la seva fabricació fou prohibida a causa de la destrucció de la capa d'ozó i fou substituït per un hidrofluorocarbur (HCFC-22).[13][14]
Separació d'isòtops
[modifica]Pel desenvolupament de la bomba atòmica durant la Segona Guerra Mundial fou necessari separar la petita proporció de l'isòtop fissible urani-235 d'altres isòtops no fissibles d'urani, especialment l'urani-238. Aquesta separació es podia fer per difusió, treballant amb hexafluorur d'urani UF6, un gas. El fluor en aquell moment es fabricava només ocasionalment i en petita escala de laboratori, i tenia la fama de ser intensament reactiu químicament i difícil de manejar. La solució al problema de la preparació a gran escala de fluor elemental, que requeria el desenvolupament i la introducció de materials de construcció nous i resistents al fluor, posà a disposició fluor a escala industrial.
Altres usos
[modifica]S'han desenvolupat altres usos: com a component en alguns propulsors de coets, per a la preparació de compostos interhalogenads extremadament reactius com el trifluorur de clor ClF3, utilitzat per tallar acer, i per a la preparació d'hexafluorur de sofre SF6, un gas extremadament estable que s'ha utilitzat com a aïllant en aplicacions elèctriques.
Les olles de cuina antiadherents han estat recobertes amb una resina de fluorocarboni, la més coneguda de la qual és el politetrafluoroetilè o tefló. Hi ha diverses altres resines de fluorocarboni i hidrocarburs fluorats; algunes tenen aplicacions altament especialitzades en la indústria aeroespacial.
Els compostos fluorats també s'utilitzen en tractaments tèxtils; alguns són agents de desemmolliment que faciliten el rentat del teixit. El fluoroacetat de sodi és un raticida extremadament potent; s'ha informat que dona un bon control de les rates, però s'ha d'utilitzar amb molta precaució. El bifluorur de sodi s'utilitza com a aigualidor de la roba; també elimina taques de ferro sense debilitar el teixit. Un ús menor però important del fluor en alguns països és la fluorejació de l'aigua de consum en interès de la salut dental.
Brom
[modifica]
Les propietats del brom són significativament diferents de les del fluor i el clor, i és molt menys abundant. El brom adquirí importància industrial amb el desenvolupament del procés fotogràfic modern, en el qual el material fotosensible és una emulsió de petites partícules de bromur d'argent AgBr (juntament amb clorur d'argent AgCl o iodur AgI, o ambdós) en gelatina.
Durant un temps el brom s'obtenia de les salmorres de la regió dels Grans Llacs i del llac Searles als Estats Units, i de la mar Morta, que conté aproximadament un 0,5 % de brom. Per satisfer la demanda creixent s'anà acercar-lo a l'aigua de mar, que conté aproximadament 70 ppm de brom. Per obtenir-lo s'han de processar volums molt grans d'aigua. Un lloc preferit per a l'operació és una punta de terra que es projecti cap a l'oceà de manera que l'aigua es pugui prendre d'un costat i descarregar a l'altre, evitant així el problema de processar la mateixa aigua. L'aigua s'acidifica amb àcid sulfúric H2SO4 i es tracta amb clor, que allibera brom per oxidació dels bromurs:[11]
Un corrent d'aire elimina el brom com a una mescla molt diluïda de brom amb l'aire. El brom s'absorbeix en carbonat de sodi, després el tractament amb àcid sulfúric allibera el brom novament en una forma molt més concentrada. Les reaccions són:[4]
Diversos retardants de flama importants, com el tetrabromobisfenol A, es deriven de brom i compostos de brom, tot i que hi ha preocupacions sobre l'eficàcia d'alguns d'ells. Els retardants de flama, per exemple, s'uneixen (químicament) o s'incorporen físicament als plàstics. Això és especialment important quan s'utilitzen plàstics on hi ha risc d'incendi. El brom també s'utilitza en la fabricació de biocides, com el biobrom (2,2-dibromo-3-nitrilopropionamida). S'utilitza àmpliament en el tractament de l'aigua. Les solucions concentrades de bromur de calci BaBr2 i bromur de magnesi MgBr2 (salmorres clares) s'utilitzen en la perforació de petroli. Són solucions molt denses (uns 1,8 kg/m³) i quan s'aboquen al forat de perforació s'enfonsen a través de l'aigua fins al fons. Ajuden a lubricar el trepant, augmentant la seva capacitat de perforació més profunda. També ajuden a dispersar els sòlids que s'estan perforant. Un altre ús del brom és per fer bromometà BrCH3, utilitzat com a fumigant contra plagues, i per netejar els sòls abans de plantar. No obstant això, això està perdent importància ja que hi ha acords internacionals per reduir-ne l'ús ja que, com els CFC, es considera que provoca l'esgotament de l'ozó quan és transportat a l'estratosfera.[11]
Iode
[modifica]
El iode entra en la indústria química en menor escala. El principal productor és Japó, on l'iode es treu de les algues marines. L'aigua de mar conté només uns 0,05 ppm d'iode, però algunes espècies d'algues marines poden concentrar aquest iode molts cops, de manera que l'extracció comercial de l'iode és possible. L'ús industrial més important de compostos d'iode és la petita quantitat de iodur d'argent AgI utilitzada amb bromur d'argent AgBr en la fotografia. El iode absorbeix fàcilment els raigs X i s'utilitza com a agent de contrast en la imatge mèdica de raigs X. El iode també està present en molts productes farmacèutics i agents antimicrobians (desinfectants i antisèptics). El iodat de calci Ca(IO3)2, el iodat de potassi KIO3 i el iodur de potassi KI es troben entre els compostos que contenen iode afegits a l'alimentació animal i a la sal per al consum humà per prevenir trastorns mèdics per la manca d'ions iode i iodur al cos.[11]
S'obté del iodat de sodi present en un 5 % en el nitrat de sodi NaNO3 dels jaciments de Xile per tractament amb diòxid de sofre:
A continuació es combina el iodur amb iodat per obtenir, finalment, el iode:[11]
La indústria química orgànica
[modifica]La indústria química pesada, en la seva forma clàssica, es basava en la química inorgànica, preocupada per tots els elements excepte el carboni i els seus compostos, però incloent, com s'ha vist, els carbonats. De manera similar, la indústria química lleugera fa servir la química orgànica, preocupada per certs composts de carboni com els hidrocarburs, combinacions d'hidrogen i carboni. A finals dels anys 60, sorgí el terme "química orgànica pesada" per a composts com el benzè, el fenol, l'etè i el clorur de vinil.
Hidrocarburs aromàtics
[modifica]El benzè C6H6, que forma la base dels composts aromàtics, ha estat un producte químic industrial durant molt de temps. Inicialment s'obtenia mitjançant la carbonització (escalfament) del carbó, que produeix coc, gas combustible i diversos subproductes, incloent el benzè. El benzè i el fenol C6H6OH estan relacionats químicament i també estan relacionats amb el toluè C6H6CH3 i els xilens CH3C6H6CH3, que es poden considerar com una part del grup aromàtic de productes químics orgànics, sent els composts aromàtics més fàcilment definits com aquells amb propietats químiques similars a les del benzè.
-
Benzè.
-
Toluè.
-
Fenol.
-
o-xilè
-
Etilbenzè.
La manca d'aromàtics fou evident per primera vegada durant la Primera Guerra Mundial, quan la toluè (metilbenzè) tenia gran demanda per fabricar trinitrotoluè (TNT) C6H6CH3(NO2)3, l'explosiu principal utilitzat en aquell moment. Es desenvoluparen mètodes per obtenir toluè del petroli. Molts anys després, després de la Segona Guerra Mundial, el benzè i tots els altres aromàtics derivats d'ell eren necessaris en quantitats molt majors del que el coc metal·lúrgic podia subministrar, i la major part d'aquests aromàtics ara provenen principalment del petroli.
Benzè i metilbenzens
[modifica]
Aproximadament la meitat del benzè que es fabrica s'utilitza per produir etilbenzè C6H6CH2CH3, que al seu torn s'utilitza per fer poliestirè. El cumè representa una altra quarta part, que s'utilitza per fer fenol C6H6OH i propanona (acetona) CH3COCH3 que es converteixen, per exemple, en una àmplia gamma de polímers. Per exemple, a partir del fenol s'obtenen alguns polímers molt importants, entre els quals destaquen les poliamides (nilons), els policarbonats i les resines fenòliques.[11]
Un altre ús important del benzè és la fabricació de ciclohexà C6H12, que s'utilitza, al seu torn, per fabricar àcid hexanodioic (àcid adípic) i caprolactama, intermedis essencials en la fabricació de poliamides. Un altre ús del benzè és en la fabricació d'alquilbenzè sulfonats, tensioactius importants.
Nitrant el benzè s'obté nitrobenzè C6H6NO2 que es pot reduir a fenilamima (anilina) C6H6NH2 emprada per produir colorants azoics, diisocianat de difenilmetà (MDI) que s'utilitza per fabricar poliuretans i també s'utilitza en la fabricació de l'analgèsic, el paracetamol.


Més del 50 % del toluè C6H6CH3 produït a una refineria es converteix en benzè per desalquilació i desproporció. El toluè també s'utilitza per fabricar TDI (diisocianat de toluè o diisocianat de metilbenzè), un dels reactius utilitzats per fabricar poliuretans. També s'utilitza àmpliament com a dissolvent, per exemple, per als polímers alquídics (resines) utilitzats en pintures.
El dimetilbenzè o xilè més utilitzat és l'1,4-dimetilbenzè o p-xilè CH3C6H6CH3. S'oxida a àcid benzè-1,4-dicarboxílic (àcid tereftàlic) que reacciona amb l'etan-1,2-diol (etilenglicol) per formar el monòmer del polièster, el tereftalat de polietilè (PET).
L'1,2-dimetilbenzè (o-xilè) s'oxida a anhídrid benzè-1,2-dicarboxílic (anhídrid ftàlic) que al seu torn es converteix en èsters de l'àcid benzè-1,2-dicarboxílic, per exemple dioctilbenzè-1 ,2-dicarboxilats, que s'utilitzen com a plastificants. També s'utilitza per fer resines alquídiques.
Hidrocarburs alifàtics
[modifica]Hidrocarburs insaturats
[modifica]Els productes químics orgànics més senzills són els hidrocarburs saturats metà CH4, età H3C–CH3, propà H3C–CH2–CH3, butà H3C–CH2–CH2–CH3 i altres. Aquests són útils com a combustibles, però són químicament poc reactius, així que per processar-los i obtenir altres productes químics, es "trenquen" mitjançant un tractament tèrmic per convertir-los en hidrocarburs insaturats. Aquests tenen menys hidrògens i presenten un o més enllaços dobles o triples entre carboni. Alguns dels més importants industrialment són: l'acetilè o etí HC≡CH, l'etè H2C=CH2, propè H3C–CH=CH2 i el butadiè H2C=CH–CH=CH2.
Etè o etilè
[modifica]L'etilè o etè, és un dels productes químics orgànics més produïts en volum, es pot produir tant junts amb l'acetilè com amb el propilè. Dona lloc a molts productes, molts d'ells en gran volum. Alguns dels més importants són l'acetaldehid, l'acrilonitril, l'àcid acètic i l'anhídrid acètic. No obstant això, aquestes substàncies en general també es poden fer a partir de l'acetilè, i l'acetilè també es pot fer a partir d'una font completament diferent, el carbur de calci CaC2.
Acetilè
[modifica]
El carbur de calci és una font més adequada d'acetilè en un país que té energia hidroelèctrica però manca de reserves de petroli. El major productor d'acetilè és el Japó; Polònia, Rússia i molts altres països també són productors destacats. El carbur de calci genera acetilè quan actua sobre l'aigua:
Aquesta reacció s'empra a petita escala per donar acetilè adequat per a la il·luminació a causa de la seva flama extremadament brillant. L'acetilè també es produeix a gran escala per a la conversió química. L'acetilè també es fa servir per a la soldadura oxiacetilènica, ja que, en cremar-se amb oxigen, produeix una temperatura extremadament alta.
El carbur de calci, matèria primera per a l'acetilè, té altres utilitats. Quan es tracta amb nitrogen, dona cianamida de calci, valuosa com a fertilitzant i herbicida, i al mateix temps matèria primera per a la producció de melamina, utilitzada en la fabricació d'alguns plàstics moderns:
Propè
[modifica]El propè o propilè no es produeix en volum tan gran com l'etilè i s'utilitza principalment amb finalitats químiques. És una matèria primera important per a certs detergents. Condueix a derivats que es fan servir com a additius d'essència antipetardeig.
Elastòmers
[modifica]
El butadiè es fa servir per produir plàstics i elastòmers, un grup de substàncies relacionades amb els plàstics. En un principi, els elastòmers es prepararen com a substituts sintètics del cautxú natural. Com ha passat sovint amb els substituts sintètics, però, se sintetitzaren moltes varietats diferents; algunes eren realment millors que el cautxú natural en alguns aspectes i altres millors en altres.
L'interès per un material sintètic que es podia utilitzar en pneumàtics d'automòbils començà a Alemanya ja a la Primera Guerra Mundial, quan els subministraments dels països tropicals productors de cautxú es tallaren. Es produí un cautxú sintètic que es podia utilitzar per a pneumàtics, encara que el vehicle havia de ser elevat quan no estava en moviment per evitar desenvolupar una zona plana als pneumàtics. Molta recerca a Alemanya i als Estats Units portaren al desenvolupament, poc abans de la Segona Guerra Mundial, de diversos elastòmers. El més important d'ells, i de molt el millor per als pneumàtics, s'obtingué a partir d'un copolímer de 75 parts de butadiè i 25 parts de estirè. Es produeix en molta més quantitat que cap dels altres sintètics. És millor que el cautxú natural en alguns aspectes, però pitjor en altres. Sovint es fa servir en barreges amb altres gomes.
L'acrilonitril CH2-CH-C≡N es pot copolimeritzar amb el butadiè (aproximadament un terç d'acrilonitril, dos terços de butadiè) per formar goma nitrílica (NBR). Aquest compost sintètic té propietats diferents d'altres i es fa servir per a mànegues de goma, revestiments de dipòsits, cintes transportadores, juntes i aïllaments de filferro. L'acrilonitril i l'estirè, juntament amb el butadiè, formen un terpolímer, anomenat ABS, que és útil per a plàstics d'alta resistència a impactes.

L'acrilonitril conté nitrogen, i per tant és diferent en constitució química del cautxú natural, que conté només carboni i hidrogen. El cautxú natural té una unitat de repetició de cinc àtoms de carboni. Començant amb l'isopré insaturat C5H8, es pot fer un polímer amb l'arranjament espacial dels àtoms igual que en el cautxú natural i amb propietats molt similars. A aquest polímer se li diu a vegades cautxú natural sintètic. Un altre elastòmer d'hidrocarburs comença amb l'isobutilè C4H8)i dona lloc al butil, un cautxú caracteritzat per la seva resistència a l'oxigen i impermeabilitat als gasos, que es fa servir àmpliament en l'aïllament de cables i com a revestiment de teles.
L'acetilè és la matèria primera per a la cloroprè C4H5Cl, que es converteix en neoprè, un altre elastòmer versàtil d'excepcionals propietats. També hi ha productes semblants al cautxú que contenen sofre, coneguts als Estats Units com a tiocols. Un grup relacionat, que conté carboni, sofre i oxigen, les sulfones, són materials plàstics resistents. Els materials elastomèrics es tracten més detalladament a l'article elastòmer (cautxú natural i sintètic).
Materials pel·lícula
[modifica]La majoria dels grups de productes químics esmentats anteriorment que es poden utilitzar com a plàstics o elastòmers també es poden convertir en la forma de pel·lícules coherents. En els països més industrialitzats hi ha una demanda molt alta de pel·lícules per embolicar, principalment per aliments, i també a la indústria de la construcció. Les necessitats d'una pel·lícula varien enormement. Per a molts productes alimentaris, la pel·lícula d'embolcalls ha de tenir la capacitat de "respirar"; és a dir, ha de tenir certa permeabilitat al vapor d'aigua i també a l'oxigen. Les pel·lícules es poden desenvolupar amb alta permeabilitat o sense cap permeabilitat. En algunes aplicacions, la pel·lícula ha de ser autoadhesiva. Les pel·lícules es poden fer de qualsevol gruix, i per a alguns fins es requereix extrema resistència. El paper, o paper tractat, ha estat utilitzat, per descomptat, per a molts d'aquests fins durant molts anys, però té desavantatges com la baixa resistència, especialment quan està mullat, i és difícil fer-lo transparent. El cel·lofà va ser produït comercialment a partir de la dècada de 1920; la seva transparència va cridar l'atenció de seguida, iniciant una revolució en els materials d'embolcalls.
El cel·lofà és cel·lulosa regenerada. És similar al raió de viscosa, excepte que s'extrudeix pla, en comptes de com una fibra. Encara és molt popular però és altament sensible a l'aigua i als canvis d'humitat. Molts altres polímers ara el complementen i competeixen amb ell. El polietilè produeix pel·lícules fines i resistents; no hi ha una distinció clara entre una extrusió prima, útil per a una pel·lícula d'embolcalls, i productes més gruixuts utilitzats per a ampolles irrompibles. Molts productes de vinil s'utilitzen en pel·lícules, com també poliestirè, polièsters i niló. Un derivat químic del cauciú natural, el cauciú clorat, dona lloc a pel·lícules d'extraordinària elasticitat.
Des de les pel·lícules coherents que poden estar dretes per elles mateixes, és un petit pas cap a un dels components d'una pintura. En els dies abans de la tecnologia química, les pintures comercials es basaven en oli de llavors com a formador de pel·lícules. L'oli de llavors i el pigment feien una barreja massa densa, de manera que normalment s'alleujava amb trementina.

El diluent en la pintura és el component que ha experimentat menys canvis. La trementina, obtinguda dels pins, i de vegades com a subproducte en la fabricació de paper, encara s'utilitza. Un destil·lat de petroli, no obstant això, és igualment eficaç. El diluent s'evapora completament molt poc després que s'aplica la pintura. En les pintures lates, la pròpia pintura està en forma de petites gotes en aigua, i l'aigua és el diluent.
Negre de carbó
[modifica]
El pigment negre més destacat és el negre de carbó o negre de fum. Es considera un producte petroquímic perquè s'obté partir de gas natural o residus de petroli. Hi ha diversos processos que impliquen tant una combustió incompleta (cremar l'hidrogen d'un hidrocarbur, com el metà, i deixar el carboni) com una calor aplicada externament en un forn, dividint l'hidrocarbur en hidrogen i carboni.
L'ús més important del negre de carbó és en la composició del cautxú per a ser utilitzat en pneumàtics. El negre de carbó no només s'utilitza com a pigment sinó que també s'aplica en tintes d'impremta, essent una tinta poc diferent d'un revestiment aplicat. El negre de carbó crea la principal dificultat en el reciclatge del paper de diari perquè no s'ha trobat cap manera pràctica de destruir la tinta negra. Un ús especialitzat del negre de carbó és com a additiu als discs de gramòfon. Una forma especial de negre de carbó, derivada de l'acetilè, té el seu ús principal en piles seques electroquímiques.
Alcohols i els seus derivats
[modifica]Metanol i formaldehid
[modifica]El metanol CH3OH és el més simple dels alcohols. S'obté del gas de síntesi en forma de monòxid de carboni CO i hidrogen H2 (algunes vegades diòxid de carboni CO2 i hidrogen). La reacció és:
El metanol és un producte químic de gran volum; aproximadament la meitat de la producció es destina a produir formaldehid CH2O, un producte químic molt reactiu amb molts usos. Un dels mètodes emprats és l'oxidació del metanol amb oxigen catalitzat per òxid de ferro(III) i òxid de molibdè(VI) (procés FORMOX):
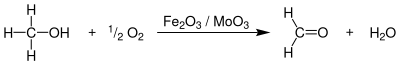
Una petita quantitat de formaldehid prové d'altres fonts, mitjançant l'oxidació directa d'hidrocarburs. Els usos més importants del formaldehid són en la formació de grups importants de plàstics, les resines urea-formaldehid i les resines fenol-formaldehid. A més, s'utilitza com a fungicida i com a conservant, en tractaments de paper i teixits, i en la síntesi de productes addicionals.
El metanol també intervé en la producció de diversos plàstics; dona lloc a derivats útils com el clorometà ClCH3, un dissolvent per tintes i colorants; i s'utilitza en la purificació de medicaments esteroides i hormonals.
Etanol i els seus productes
[modifica]
L'etanol o alcohol etílic CH3CH2OH és conegut per ser el component actiu de les begudes fermentades, però també s'utilitza àmpliament en la indústria. Quan es destina al consum humà, l'etanol sempre es produeix per fermentació d'un material adequat per formar cervesa, vi o begudes destil·lades de diverses classes. Per a ús industrial, a vegades es produeix per fermentació d'un material econòmic, com la melassa, però amb més freqüència es fa a partir de l'etilè fent-lo reaccionar amb aigua sota la influència d'un catalitzador, que pot ser àcid sulfúric o àcid fosfòric.
Un ús industrial important de l'etanol és convertir-lo per oxidació en acetaldehid CH3CHO que és generalment utilitzat en el pas següent per la mateixa empresa, sovint a la mateixa planta, de manera que l'etanol és realment un intermedi que s'utilitza immediatament.

L'etanol també s'utilitza en la preparació de diversos derivats, com el clorur d'etil (utilitzat en la producció de tetraetil de plom), en la fabricació de diversos plàstics i en les síntesis addicionals habituals. L'etanol destinat al consum humà està subjecte a impostos en tots els països, fet que faria prohibitius els costos de l'etanol per a qualsevol ús industrial. L'alcohol industrial, per tant, es desnaturalitza amb l'addició de petites quantitats de substàncies que s'escullen amb cura per ser molt desagradables en gust i difícils de treure però que no interfereixen amb l'ús industrial previst.
Altres alcohols
[modifica]El propan-1-ol, que no es fabrica en quantitats molt grans, té un ús principal en les tintes d'impremta. El propan-2-ol, en canvi, es fabrica a l'escala de milions de tones. Es fa a partir de propè per un procés similar al que es fa servir per convertir l'etè en etanol, i la fabricació de propan-2-ol per aquest procés inicià la indústria petroquímica a la dècada de 1920. L'ús principal del propan-2-ol és en la fabricació d'acetona CH3COCH3, que s'utilitza àmpliament com a dissolvent i com a material inicial en la fabricació de nombrosos altres compostos orgànics. Quantitats més petites de propan-2-ol es converteixen en altres productes químics o s'utilitzen com a dissolvent, com a alcohol d'abricar o com a agent de desnaturalització de l'alcohol etílic.
Alcohols superiors, és a dir, amb més de tres àtoms de carboni, massa nombrosos per detallar aquí, també es fabriquen. També cal fer menció de l'alcohol dihíbrid, el glicol d'etilè. Aquest producte químic es produeix en gran volum i es fa d'etilè mitjançant una ruta indirecta. El seu ús principal és en mescla anticongelant per a radiadors d'automòbils. També s'utilitza en líquids de frens i té nombrosos derivats que s'utilitzen en resines, pintures i explosius, així com en la fabricació de fibres de polièster. Reaccions similars per a propilè donen propilè glicol, el principal ús del qual és com a agent humectant en aliments i tabac.
Operacions bàsiques a la indústria química
[modifica]El principals processos a la indústria química són els següents:
Preparació de les substàncies reactives
[modifica]Per aconseguir una màxima velocitat de reacció primer s'han de separar les substàncies abans de fer-les reaccionar. Existeixen diferents formes de separar les substàncies, però les més corrents són:
- Desintegració: Per fer una bona desintegració s'han de triturar els materials, i, depenent de la màquina que es faci servir podem fer:
- Trossejament: Trosseejadora de rodets, trossejadora de martell, trossejadora circular, entre altres.
- Trituració: Trituradores de discs, trituradores de percussió, etc.
- Molta: Utilitzen el molí de boles, molí pendular, el tubular, etc.
- Mescla: Quan es fan reaccionar diferents substàncies entre si, es fa la mescla. Perquè reaccionin, es reparteix de forma homogènia per així poder tenir la mateixa reacció.
Separació de substàncies
[modifica]A vegades a algunes indústries només fan aquest procés per a l'obtenció dels productes. Un exemple clar pot ser la separació de l'alcohol amb altres substàncies. Existeixen molts sistemes per poder fer la separació de substàncies, per+o els dos més importants són:
- Sistemes tèrmics: Aquest sistema es basa en la separació de substàncies segons l'estat físic, es poden fer mitjançant els següents mètodes:
- Vaporització (líquids)
- Destil·lació (Vaporització de líquids)
- Rectificació (repetició del procés de destil·lació)
- Absorció(captació d'un gas per mitjà d'un líquid)
- Sistemes mecànics: S'utilitza quan en un procés químic apareixen barrejes de líquids amb sòlides quan estan en suspenció. Fan servir els següents mètodes:
- Decantació: Mitjançant la gravetat separa la materia sòlida quan està suspesa en un líquid.
- Filtració: Separa de forma mecànica les mescles de sòlids amb líquids
- Centrifugació: Separació de sòlids amb líquids i líquids amb líquids.
Reacció de substàncies
[modifica]Aquest és el procés més important d'una indústria química, ja que es transformen les substàncies per a l'obtenció d'una altra nova mitjançant la reacció química. Es canvia la seva estructura molecular.
Existeixen diferents tipus del funcionament dels reactors:
- Per Càrregues: Des d'un començament es barregen totes les substàncies que s'hagin de reaccionar, això es fa durant el temps necessari perquè es produeixi la reacció química, d'aquesta manera s'obtindran nous productes.
- Procés continu: Les substànicies que es reaccionen s'introdueixen de forma contínua juntament amb els altres components en l'espai de reacció, axí s'obté el producte de forma contínua.
- Procés semicontinu: El reactor és alimentat per càrregues i també dona un producte continuadament, s'introdueixen en dos fases, la fase més densa s'introdueix en el reactor, mentre que la fase més lleugera s'introdueix de forma discontínua.
Envasament dels productes
[modifica]Aquest procés també és un dels més importants a aquesta indústria, ja que no només es tracta de l'obtenció de noves substàncies, sinó que també hem d'envasar-les en un material convenient per a poder emmagatzemar-la, mantenir-la i transportar-la. Alguns productes poden ser perillosos, per això s'ha de tenir molta cura amb l'envasat que es faci servir. Tot això dependrà de l'estat físic del producte.
Companyies
[modifica]BASF, Dow, Degussa, Eastman Chemical Company, Shell, Bayer, INEOS, ExxonMobil, DuPont, SABIC, Braskem i Mitsubishi tenen plantes de producció a molts països, també hi ha milers d'empreses menors.
Referències
[modifica]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 Killheffer, John V.; Standen, Anthony. «Chemical industry». Encyclopedia Britannica. Encyclopedia Britannica, 01-02-2024. [Consulta: 24 febrer 2024].
- ↑ «Productos Químicos (HS: ) Product Trade, Exporters and Importers» (en castellà). Observatorio de Complejidad Económica (OEC). [Consulta: 28 febrer 2024].
- ↑ Kostick, Dennis (2006). "Soda Ash", 2005 Minerals Yearbook, United States Geological Survey.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 Babor, Joseph A.. Química general moderna : una introducción a la química física y a la química descriptiva superior (inorgánica, orgánica y bioquímica). 8{487} ed., reimp. Barcelona: Marín, imp. 1979. ISBN 8471029979.
- ↑ «Potash Statistics and Information». US Geological Survey, 01-01-2024. [Consulta: 27 febrer 2024].
- ↑ 6,0 6,1 OECD. Global Hydrogen Review 2023 (en anglès). París: Organisation for Economic Co-operation and Development, 2023. DOI 10.1787/cb2635f6-en.
- ↑ «gas de síntesi». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «metanol». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Ding, Jie; Ye, Runping; Fu, Yanghe; He, Yiming; Wu, Ye «Direct synthesis of urea from carbon dioxide and ammonia» (en anglès). Nature Communications, 14, 1, 31-07-2023, pàg. 4586. DOI: 10.1038/s41467-023-40351-5. ISSN: 2041-1723. PMC: PMC10390537. PMID: 37524739.
- ↑ Pardiñas Alvite, J.; Feijoo Revilla, R. Sistemas Auxiliares del Motor. Editex. ISBN 9788411348317.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 «Basic chemicals» (en anglès britànic). The Essential Chemical Industry. Department of Chemistry, University of York, 09-12-2016. [Consulta: 26 febrer 2024].
- ↑ 12,0 12,1 12,2 Martínez Sinibald, Sílvia. La Indústria del clor-àlcali. Generalitat de Catalunya. Departament de Medi Ambient, 2003. ISBN 84-393-6100-9.
- ↑ Koel, Mihkel; Kaljurand, Mihkel. Green Analytical Chemistry 2nd Edition (en anglès). Royal Society of Chemistry, 2019-03-13, p. 5. ISBN 978-1-78801-486-1.
- ↑ Stellman, Jeanne Mager. Encyclopaedia of Occupational Health and Safety (en anglès). International Labour Organization, 1998, p. 104-184. ISBN 978-92-2-109817-1.
- Fred Aftalion A History of the International Chemical Industry. University of Pennsylvania Press. 1991. online version
- Llibre de text: Tecnologia 2 batxillerat