Sal (química)

| Denominació de les sals |
|
Les sals es denominen d'acord amb l'àcid del que deriven:
|
En química, una sal és un compost iònic que resulta de la reacció de neutralització d'un àcid i una base.[1] Estan compostes de cations (ions carregats positivament) i anions (ions carregats negativament), de manera que el producte és elèctricament neutral. Aquests ions components poden ser inorgànics (tals com el clorur, Cl−) o orgànics (com l'acetat, CH₃COO−); o bé ions monoatòmics (com el fluorur, F−) o ions poliatòmics (com el sulfat, SO₄2−).
Hi ha molts tipus diversos de sals. Les sals que s'hidrolitzen per produir ions hidròxid quan es dissolen en aigua són sals bàsiques, i les sals que s'hidrolitzen per produir ions oxoni quan es dissolen en aigua són sals àcides. Les sals neutrals són aquelles que no són considerades ni bàsiques ni àcides. D'altra banda, els zwitterions
un centre aniònic i un centre catiònic en la mateixa molècula, encara que no són considerats pas com a sals. Alguns exemples inclouen els aminoàcids, molts metabòlits, pèptids i proteïnes.
Les sals foses i les solucions que contenen sals dissoltes (per exemple, clorur de sodi en aigua) són anomenats electròlits, ja que són capaços de conduir l'electricitat. Tal com es pot observar en el citoplasma d'una cèl·lula, a la sang, a l'orina, a la saba i a les aigües minerals, les barreges de diferents tipus de ions en una solució tot sovint no forma salts definides un cop s'ha evaporat d'aigua.
Un exemple molt corrent de sal és la sal comuna, denominada també sal de cuina o simplement sal; concretament s'anomena clorur de sodi. La seva fórmula química és NaCl i és el producte de la base hidròxid de sodi (NaOH) i àcid clorhídric (HCl).
Formació
[modifica]Les sals es formen per una reacció química entre:
- Una base i un àcid, ex. NH₃ + HCl → NH₄Cl
- Un metall i un àcid, ex. Mg + H₂SO₄ → MgSO₄ + H₂
- Una base i un anhídrid àcid, ex. 2 NaOH + Cl₂O → 2 NaClO + H₂O
- Un àcid i un anhídrid bàsic, ex. 2 HNO₃ + Na₂O → 2 NaNO₃ + H₂O
- També es poden formar sals si es mesclen solucions de salts diferents, els seus ions es recombinen, i la nova salt és insoluble i precipitats (vegeu: equilibri de solubilitat), per exemple:
- Pb (NO₃)₂(aq) + Na₂SO₄(aq) → PbSO₄(s) + NaNO₃(aq)
Classificació
[modifica]Les sals es poden classificar segons els següents grups:[2]
- Sals hidràcides, haloïdees o binàries neutres: són compostos binaris formats per un metall i un no-metall, sense cap altre element. Exemples: clorur de sodi (NaCl), clorur de ferro (III) (FeCl₃) sulfur de ferro (II) (FeS).
- Sals d'oxoàcids, oxoàcides o ternària neutra: es substitueixen tots els hidrògens. Exemple: hipoclorit de sodi (NaClO).
- Sals àcides: Són aquelles que contenen alhora un hidró substituïble i un o més cations metàl·lics. No obstant això, alguns anions inorgànics poden contenir hidrògens difícilment substituïbles. Exemple: hidrogencarbonat de sodi (més conegut com a bicarbonat de sodi, NaHCO₃). Si aquest està unit a un oxigen i té l'estat d'oxidació +I, les sals amb aquests anions no poden considerar-se sals àcides.[3]
- Sals bàsiques o hidroxisals: contenen ions hidròxid (OH-), a part d'altres anions. Exemple: hidroxicarbonat de ferro (III) (Fe(OH)CO₃).
- Sals dobles: es substitueixen els hidrògens per dos o més cations. Exemple: carbonat doble de potassi i liti (KLiCO₃).
- Hidroxisals: sals formades a partir d'un hidròxid amfòter.
- Sals mixtes: contenen diversos anions. Exemples: clorurfluorur de calci (CaClF), clorurfluorur de potassi (K₄ClPO₄), nitratsulfat de ferro (III) (Fe(NO₃)SO₄).
- Oxisals: formades per la unió d'un òxid i d'una sal. Exemples: oxinitrat de plom (IV) (PbO(NO₃)₂), oxiclorur de cobalt (III) (CoOCl).
- Sals hidratades o hidrats: sals amb molècules d'aigua a la seva estructura cristal·lina. Exemples: òxid de plom (III) semihidratat (PbO·½H₂O), sulfat de calci dihidratat (CaSO₄·2H₂O).
Nomenclatura
[modifica]
Segons la nomenclatura tradicional, les sals s'anomenen amb el nom de l'anió, amb un cert prefix i sufix, seguit de la preposició de i el nom del catió. Cal distingir entre diferents casos:
- En les sals d'hidràcids, es substitueix la terminació -hídric de l'hidràcid del qual prové l'anió per la terminació -ur. Per exemple, NaCl és el clorur de sodi; l'anió Cl- prové de l'hidràcid HCl (àcid clorhídric).
- En les sals d'oxoàcids, es substitueix la terminació -ós o -ic de l'oxoàcid del qual prové l'anió per la corresponent -it o -at. Per exemple, el Ca₃(PO₄)₂ és el fosfat de calci; l'anió PO₄3- prové de l'H₃PO₄ (àcid fosfòric).
- Les sals àcides (sals que provenen d'àcids polipròtics i que contenen àtoms d'hidrogen substituïbles) s'anomenen indicant el nombre d'hidrogens no substituïts que resten a la molècula, usant el prefix corresponent. Per exemple, l'NaHS és l'hidrogensulfur de sodi; l'anió HS- prové de l'àcid sulfhídric.
- Les sals bàsiques (sals que contenen ions hidroxil, OH-) s'anomenen indicant el nombre d'hidroxils seguit de l'anió central i finalment el catió. Per exemple, l'MgCl(OH) és l'hidroxiclorur de magnesi.
- Les sals hidratades (que contenen aigua de cristal·lització) s'anomenen indicant la sal corresponent i tot seguit el nombre d'aigües d'hidratació.
Alguns cations que formen part de sals són:
- Amoni NH₄+
- Calci Ca2+
- Ferro Fe2+ and Fe3+
- Magnesi Mg2+
- Potassi K+
- Piridini C₅H₅NH+
- Amoni quaternari NR₄+
- Sodi Na+
Alguns anions que formen part de sals són (entre parèntesis, els àcids dels quals provenen, si aplica):
- Acetat CH₃COO− (àcid acètic)
- Carbonat CO₃2− (àcid carbònic)
- Clorur Cl− (àcid clorhídric)
- Citrat HOC(COO−)(CH₂COO−)₂ (àcid cítric)
- Cianur C≡N− (àcid cianhídric)
- Nitrat NO₃− (àcid nítric)
- Nitrit NO₂− (àcid nitrós)
- Fosfat PO₄3− (àcid fosfòric)
- Sulfat SO₄2− (àcid sulfúric)
Propietats
[modifica]Propietats físiques
[modifica]
En general, les sals són materials de cristal·lins amb estructura iònica. Per exemple, els cristalls d'halurs de metalls alcalins i alcalinoterris (NaCl, CsCl, CaF₂) construïts d'anions, situats al principi de l'empaquetament esfèric més dens, i cations que ocupen buits dins el paquet. Cristalls de sal iònics poden ser també construïts a partir de residus d'àcid combinats en una infinitat d'estructures dimensionals aniòniques i fragments d'aquests amb cations a les cavitats (com els silicats). Aquesta estructura es reflecteix apropiadament en les seves propietats físiques: tenen alts punts de fusió i en estat sòlid són dielèctrics.[4]
De particular interès són els líquids iònics, amb punts de fusió per sota de 100 °C. Durant la fusió anormal de líquids iònics pràcticament no hi ha pressió de vapor, però si una alta viscositat. Les propietats especials d'aquestes sals s'expliquen per la baixa simetria del catió, la interacció feble entre els ions i una bona distribució de la càrrega del catió.[5]
Propietats químiques
[modifica]Les propietats químiques són determinats per les propietats dels cations i anions o una part d'ells.
Les sals reaccionen amb els àcids i les bases, obtenint-se el producte de reacció i un gas precipitat o una substància tal com aigua
Les sals reaccionen amb els metalls quan aquest s'allibera de la sal de metall en una sèrie electroquímica de reactivitat:
Les sals reaccionen entre si i el producte resultant de la reacció (produeixen gas, i precipiten sediments o aigua); aquestes reaccions poden tenir lloc amb el canvi en els estats d'oxidació dels àtoms reactius:
Algunes sals es descomponen quan s'escalfen:
Color
[modifica]

Les sals poden tenir l'aparença de ser clares i transparents (com el clorur de sodi), opaques i fins i tot metàl·liques i brillants (com la pirita o sulfur de ferro). En molts casos l'opacitat o transparència aparents estan relacionades amb la diferència de mida dels monocristalls individuals; com que la llum es reflecteix en les fronteres de gra, els cristalls grans tendeixen a ser transparents, mentre que els agregats policristal·lins tenen l'aparença de pols blanca.
Les sals poden prendre molts colors diferents. Alguns exemples són:
- Groc (cromat de sodi)
- Taronja (cromat de potassi)
- Vermell (ferricianur de potassi)
- Malva (clorur de cobalt (II))
- Blau (sulfat de coure (II), blau de Prússia)
- Lila (permanganat de potassi)
- Verd (clorur de níquel (II))
- Blanc (clorur de sodi)
- Negre (òxid de manganès (IV))
- Sense color (sulfat de magnesi)
La majoria de minerals i pigments inorgànics, així com molts tints orgànics sintètics, són sals. El color de la sal específica és degut a la presència d'electrons desaparellats a l'orbital atòmic dels elements de transició.
Gust
[modifica]Les sals diferents poden provocar tots els cinc diferents gustos bàsics com, per exemple, el salat (clorur de sodi), el dolç (acetat de plom (II), que provoca saturnisme si s'ingereix), l'agre (bitartrat de potassi), l'amarg (sulfat de magnesi) i l'umami (glutamat monosòdic).
Olor
[modifica]Les sals d'àcids forts i bases fortes ("sals fortes") no sol volàtils i no tenen olor, mentre que les sals tant de bases febles com d'àcids febles ("sals febles") poden tenir olor en forma d'àcid conjugat (per exemple, acetats com l'àcid acètic o vinagre, i cianurs com el cianur d'hidrogen com l'ametller) o en forma de base conjugada (per exemple, sals d'amoni com l'amoníac) dels ions components. Aquesta descomposició parcial i lenta és usualment accelerada amb la presència d'aigua, ja que la hidròlisi és l'altra meitat de l'equació de la reacció reversible de formació de les sals febles.
Solucions salines
[modifica]- Una solució salina és el resultat de la reacció d'un àcid fort amb una base forta. Resulta altament ionitzada i, per tant, neutra. L'explicació és que els contra ions dels àcids forts i les bases febles són bastant estables, i per tant no hidrolitzen l'aigua. Un exemple seria el clorur de sodi, el bromur de liti i algunes altres.
- Una solució salina d'un àcid fort amb una base feble és àcida. Això és així perquè, després de dissociar-se la sal en dissoldre's, la base feble té tendència a captar OH-, hidròxids que n'obtindrà hidrolitzant l'aigua. Finalment, es produeix un excés d'ió oxoni en dissolució que li confereixen acidesa a la dissolució. A més feble sigui la base, més àcida serà la dissolució resultant.
- Químicament: Una solució salina d'un àcid feble amb una base forta és bàsica. El mecanisme és el mateix que en el cas anterior: l'àcid, en ser feble, tendirà a captar un protó, que ha de procedir necessàriament de la hidròlisi de l'aigua. Un exemple, la dissolució en aigua de l'acetat de sodi.
- Col·loquialment s'anomena solució salina a la mescla de sal comuna (NaCl) i aigua.
Localització
[modifica]Les sals es troben o bé en forma de mineral com a part de les roques (com l'halita), o bé dissoltes en l'aigua (per exemple, l'aigua de mar). Són un component vital dels éssers vius, en els quals les podem trobar de diferents formes:
- Dissoltes dins els organismes en els ions que les constitueixen, els quals poden actuar en determinats processos biològics:
- Transmissió dels impulsos nerviosos
- Contracció muscular
- Síntesi i activitat de la clorofil·la
- Transport de l'oxigen de l'hemoglobina
- Cofactors que ajuden als enzims
- Formant part d'estructures sòlides insolubles que proporcionen protecció o sosteniment (ossos, closques…)
- Associades a molècules orgàniques: hi ha ions que són imprescindibles per a la síntesi d'algunes biomolècules (com per exemple el iode per a les hormones fabricades a la glàndula tiroide), o per a determinades funcions (per exemple, el ió fosfat associat a lípids forma els fosfolípids de la membrana cel·lular; fosfoproteïnes com la caseïna de la llet; la molècula d'hemoglobina que conté ferro…)
Importància biològica
[modifica]Les sals químiques poden tenir diverses funcions:
- Funció estructural: les sals sòlides formen l'estructura dels minerals i les estructures esquelètiques (externes o internes) de protecció i de sosteniment dels organismes.
- Funció reguladora:
- Funció del tampó del pH: les sals són substàncies que regulen el pH d'una dissolució.
- Pressió osmòtica: l'osmosi és un fenomen que es produeix quan hi ha dues dissolucions diferents de concentracions diferents separades per una membrana semipermeable que permet el pas de les substàncies de baix pes molecular. Té la funció d'igualar les dues dissolucions de manera que tinguin la mateixa concentració mitjançant el pas del dissolvent.
- Funcions específiques: moltes sals o els seus ions són necessaris per a determinats processos biològics com la contracció muscular, la transmissió d'impulsos nerviosos, etc.
| Nom de la sal | Productes que la contenen | Efecte sobre el cos humà | Malalties per la escassetat |
|---|---|---|---|
| 1. sals de calci | Llet, peix, verdures | Promoure el creixement i la força dels ossos | Pobre creixement esquelètic, càries, etc |
| 2. sals de ferro | Fetge de res, carn de boví | Formen part de l'hemoglobina | Anèmia |
| 3. sals de magnesi | Pèsols, albercocs secs | Millorar el funcionament de l'intestí | El deteriorament del sistema digestiu |
Estudi de les sals
[modifica]Les primeres investigacions científiques sobre les sals se situa al començament del segle xviii i a càrrec de membres de l'Académie des Sciences de París. Wilhelm Homberg (1652-1715), un metge de nacionalitat holandesa, va ser el seu principal impulsor. S'havia format a Alemanya, Itàlia i Anglaterra on va conèixer Robert Boyle i es va incorporar a l'Académie el 1691. Homberg va treballar en la preparació dels resultats de les investigacions de les anàlisis vegetals fets fins aquell moment. Va fer un seguit de treballs sobre la naturalesa de les sals que, en aquella època, eren un grup de substàncies que incloïa indistintament àcids, àlcalis i els compostos d'ambdós, i que, Homberg va treballar per diferenciar-les. Seguint la nomenclatura suggerida pel francès Nicolas Lémery les va anomenar sals mitjanes (sels moyens), una denominació que posteriorment passaria a «sals neutres». Aquesta separació significava la definició d'un nou grup de composició química amb propietats pròpies d'un compost, com ara, volatilitat, inflamabilitat, fluïdesa, etc. que es podien explicar per la naturalesa dels principis constituents, considerats els portadors de les propietats. Per contra, a la definició que donava Homberg de la sal mitjana s'acceptava la idea dels àcids i les bases com substàncies molt diferents, integrables en un compost sense que les propietats originals es mantinguessin en el compost resultant. D'altra banda, enfront de la noció clàssica d'element o principi químic, els components de les sals mitjanes eren substàncies tangibles, recognoscibles per les seves propietats en un laboratori, analitzables i reproduïbles. Aquesta nova perspectiva va animar alguns químics francesos a avançar en el treball de diferenciació de diferents tipus d'àcids, de bases i de sals i, alhora, a agrupar les sales, en funció de les bases que les formaven. EN aquesta línia d'investigació es varen distingir els treballs duts a terme el 1736 per Henri-Louis Duhamel du Monceau (1700-1782), unes investigacions que el varen portar a diferenciar entre dos tipus d'àlcalis fixes que actualment coneixem com a sosa i potassa. D'igual forma, el nou concepte de les sals mitjanes va esdevenir la clau per a la creació de les taules d'afinitat, un dels apartats més destacats de la química del segle xviii.[6]
Sals orgàniques
[modifica]A més de les sals inorgàniques descrites anteriorment, també existeixen un gran nombre de sals d'enllaços orgànics. Els anions d'aquestes sals provenen dels respectius àcids orgànics. Són especialment importants les sals dels àcids carbònics, com per exemple l'àcid acètic, d'entre les moltes sals conegudes com a acetats (CH₃COO−). Així, poden combinar-se amb Na+ per formar l'acetat de sodi, o amb Cu2+ per formar l'acetat de coure. L'àcid acètic és un àcid monocarboxílic (només té un grup -COOH), i només pot formar anions monovalents. L'àcid cítric és un àcid tricarboxílic (té tres grups -COOH), i pot formar anions trivalents; hom anomena citrats les seves sals, com ara el citrat de sodi i el citrat de calci. Molts acetats i citrats formen cristalls, però aquesta no és pas la veritable raó per la qual s'anomenen sals. L'única raó és l'existència d'enllaços iònics entre anions i cations. A l'interior dels ions dels enllaços orgànics hom troba enllaços covalents.
Les sals dels àcids carbònics, com ara els àcids grassos, tenen força utilitats pràctiques. Les sals de sodi o de potassi dels àcids grassos s'anomenen sabons. Als sabons hom troba sovint diferents sals d'àcids grassos. D'entre les utilitats pràctiques cal destacar el sabó de Marsella. Un altre exemple són les sals de l'àcid palmític, que hom anomena palmitats. Les sals formades a partir de molècules orgàniques tan llargues acostumen a ser no-cristal·lines.
De forma anàloga als sulfats inorgànics (SO₄2−), existeixen també els sulfats orgànics (R-O-SO₃−), com el laurilsulfat de sodi, que s'utilitza com a tensioactiu en xampús i gels de dutxa. També existeixen sals d'alcohols, els alcòxids o alcoholats. Els alcohols són àcids extremament febles, i per això no se'ls acostuma a anomenar així. Sota condicions extremes, produeixen enllaços de la forma R-O−M+ (on M és un metall). Anàlogament amb el que succeeix amb molts àcids inorgànics, els alcoholats reaccionen en contacte amb aigua mitjançant hidròlisi i així formen els respectius alcohols.
| Hidròlisi de les sals òxides | |
|---|---|
| Etòxid de sodi | |
| Òxid de sodi | |
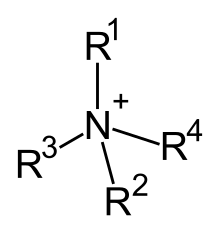
Pel que fa als cations orgànics, molts tenen enllaços similars als del catió amoni (NH₄+). Hom els anomena genèricament cations d'amoni quaternari. En aquests enllaços, l'àtom de nitrogen té quatre grups alquil (R-) i una càrrega positiva. Per exemple, el radical alquilamoni bromur de cetiltrimetilamoni és un radical d'amoni orgànic, on l'àtom de brom actua com anió. Algunes aplicacions pràctiques rauen en el fet que aquests radicals tenen tres grups alquil curts i un de llarg, la qual cosa fa que actuïn com a tensioactius en solucions aquoses. Aquest tipus de radicals tenen un rol important en l'intercanvi de substàncies dels éssers vius, com per exemple en el cas de la colina.
En principi, tota amina orgànica pot convertir-se en un catió mitjançant la captació d'un protó (H+). De la mateixa forma que l'amoníac (NH₃) reacciona per convertir-se en un ió amoni (NH₄+), una amina primària (R-NH₂; R = radical orgànic) pot reaccionar en un catió R-NH₃+. Com que sovint aquests enllaços són més polars i per tant més solubles en aigua que les substàncies originals, els principis actius que contenen nitrogen poden substituir-se per àcid clorhídric i obtenir sals, per exemple, que hom anomena clorhidrats. Això en facilita l'absorció pel cos. Els clorhidrats, contràriament amb el que succeeix amb les amines, es purifiquen de forma més fàcil mitjançant recristal·lització.
A més de les molècules que poden tenir una càrrega positiva o negativa, també existeixen molècules que compten alhora amb una càrrega positiva i negativa. Hom les anomena zwitterions. La betaïna n'és un exemple.
Els aminoàcids compten amb un grup carboxil (-COOH) un grup amino (-NH₂), i poden reaccionar tant de forma àcida com de forma bàsica. En reaccions de neutralització, formen un grup aniònic (-COO−) i un grup catiònic (-NH₃+) i, per tant, constitueixen un zwitterió. L'aminoàcid més senzill és la glicina, molt soluble en aigua. Contràriament amb el que succeeix amb altres ions dissolts en aigua, els zwitterions mostren una baixa conductivitat elèctrica. (amfòters)
Exemples de cations i anions orgànics
[modifica]| Enllaços aniònics orgànics | ||
|---|---|---|
| Tipus | Exemple | Estructura |
| Àcids carboxílics | Acetats |  |
| Palmitats |  | |
| Citrats |  | |
| Sulfats orgànics | Lauril sulfats |  |
| Alcoholats | Etanolats | |
| Enllaços catiònics orgànics | ||
| Tipus | Exemple | Estructura |
| Cations quaternaris d'amoni |
Hexadeciltrimetilamonis |  |
| Colines |  | |
| Cations orgànics d'amoníac |
Sals d'anilina, ex. hidroclòrid d'anilina |
 |
| Sals interiors: cations i anions dins d'una molècula | ||
| Tipus | Exemple | Estructura |
| Betaïnes | Betaïnes | 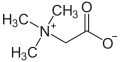 |
| Aminoàcids | Alanina | 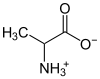 |
Sals en el món farmacèutic
[modifica]Dins el món de les farmàcies, ens trobem que són diverses les sals que s'utilitzen per a la preparació d'alguns derivats. Algunes de les més conegudes són les següents:[1]
- Clorur de sodi purificat: emprat en la preparació de sèrum fisiològic.
- Sulfat de sodi o sal de Glauber
- Sulfat de magnesi o sal d'Epsom: compost químic que conté magnesi, sofre i oxigen, amb la fórmula MgSO₄. Sovint es troba en la forma d'epsomita heptahidratada (MgSO₄•7H₂O), (coneguda també com a sal d'Epsom).
- Oxalat de potassi o sal de graelles
- Tartrat mixt de potassi i sodi o sal de Seignette o sal de Rochelle: la seva fórmula química és KNaC 4 H 4 O 6 · 4H 2 O, i el seu nom prové del seu descobridor, Pierre Seignette, farmacèutic de la Rochelle.
- Acetat de potassi o sal diurètica: és una sal neutra de l'àcid acètic i el potassi la fórmula és: CH 3 CO 2 K. També denominat en la indústria alimentària amb el codi E 261 per ser un regulador de l'acidesa.
- Bicarbonat de sodi o sal de Vichy: compost sòlid cristal·lí de color blanc molt soluble en aigua, amb un lleuger gust alcalí semblant al carbonat de sodi. La seva fórmula química és NaHCO₃, i s'obté mitjançant el procés de Solvay.
- Carbonat amònic o sal volàtil
Referències
[modifica]- ↑ 1,0 1,1 «Sal (química)». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Martínez Lorenzo, Antonio (1997). Formulación química IUPAC. Editorial Bruño. ISBN 84-216-0874-6. (en castellà)
- ↑ Casassas i Simó, 1997, p. 183.
- ↑ Knuni︠a︡nt︠s︡, Gl. red. I. L.. Khimicheskai︠a︡ ėnt︠s︡iklopedii︠a︡ (en rús). Moscou: Sovetskai︠a︡ ėnt︠s︡iklopedii︠a︡, 1990. ISBN 5-85270-035-5.
- ↑ Wasserscheid P., Keim W. «Ionic Liquids—New “Solutions” for Transition Metal Catalysis» (en anglès). Angew. Chem. Int. Ed, 39, 21, 2000. DOI: 10.1002/1521-3773(20001103)39:21. PMID: 11091453.
- ↑ Bertomeu Sánchez, José Ramón; García Belmar, Antonio. La revolución química: Entre la historia y la memoria (en castellà), 2011. ISBN 8437086280 [Consulta: 21 juny 2013]., pàg.28
Bibliografia
[modifica]- Casassas i Simó, Enric; Sales i Cabré, Joaquim. Nomenclatura de química inorgànica : recomanacions de 1990 : Unió internacional de química pura i aplicada. 1a edició. Barcelona: Institut d'Estudis Catalans, 1997. ISBN 9788472833609 [Consulta: 21 juny 2013].
- Hawkes, Stephen J. «Salts are Mostly NOT Ionized» (en anglès). Journal of Chemical Education, 73, 5, 01-05-1996, pàg. 421. DOI: 10.1021/ed073p421.
- Jakubke, Hans-Dieter. Lexikon der Chemie A bis Z (en alemany). [Studienausg.]. Heidelberg: Spektrum, Akad. Verl., 2003. ISBN 9783827411518 [Consulta: 21 juny 2013].
- Kurlansky, Mark. Salt : a world history (en anglès). Nova York: Penguin Books, 2002. ISBN 0-14-200161-9.
Vegeu també
[modifica]Enllaços externs
[modifica]- «MRBLOCH SALT ARCHIVES» (en anglès). [Consulta: 20 juny 2013].
- «Viquillibres en alemany: Ions, sals, reaccions de precipitació i enllaços iònics» (en alemany). Arxivat de l'original el 2010-02-20. [Consulta: 4 setembre 2010].















